菊粉对速冻熟制拉面品质的影响及塔尔米菊粉拉面的辅助降糖降脂作用
张亚明,王德萍,陈钦杰,敬思群,,*
(1.新疆大学生命科学与技术学院,新疆乌鲁木齐830046;2.韶关学院英东食品科学与工程学院,广东韶关512005)
II型糖尿病是一种复杂的疾病,造成严重的社会经济问题[1-2]。胰岛素抵抗在果蝇和人类中具有共同的分子机制[3],以果蝇作为II型糖尿病动物模型,具有繁殖快、周期短[4],饲养成本低,更易做群体分析等优点[5-6]。在治疗糖尿病的过程中,除了必要的药物控制,饮食治疗则是作为Ⅱ型糖尿病治疗的重要基础措施[7]。杂粮含有丰富的微量元素、维生素以及膳食纤维,具有显著地促进肠蠕动、帮助糖尿病患者降低胰岛素和甘油三酯水平等功能特性,因此杂粮面条成为食品行业研究和开发的热点[8-9]。
塔尔米(Panicum miliaceum L),形状类似于俗称的“小米”,色泽金黄,颗粒饱满,为禾本科黍属,不仅基本营养成分齐全,还含有丰富的不饱和脂肪酸[10],哈萨克族和蒙古族等少数民族将塔尔米放于酥油茶中食用,认为其具有降血糖、降血脂及降血压等功效[11]。实验室前期用塔尔米替代部分小麦粉制成速冻熟制拉面,发现塔尔米粉加入面团后能够改善面团的粉质特性。但随塔尔米添加量的提高,面团的吸水率会降低,因为塔尔米无法形成面筋网络结构,会使面条在速冻后解冻复热的过程中出现拉伸特性下降、蒸煮损失率提高、感官品质变差等问题。
菊粉是一类天然多糖,由D-呋喃果糖分子以β-(2→1)键连接而成,又称为菊糖,是中国卫生部批准的新资源食品[12-13]。研究表明,菊粉的添加可以改善面团的流变学特性[14-15]、增强面团的面筋强度[16],在鲜湿面加工中,添加5%的菊粉可以降低面条的硬度和黏性,但菊粉添加量过多会影响面条的品质及口感[17]。另一方面,菊粉属于可溶性膳食纤维[18],不易被胃肠道消化吸收,可以促进肠道益生菌增殖,具有调节血糖、降低血脂的作用[19-24]。
因此,本研究将菊粉作为面条改良剂添加到以小麦粉和塔尔米粉为原料制成的速冻熟制拉面中,分析菊粉的添加对塔尔米速冻熟制拉面品质的影响;另一方面,以果蝇为动物实验模型,考察塔尔米菊粉速冻熟制拉面对高糖及高脂诱导的II型糖尿病果蝇的干预作用、塔尔米和菊粉的协同辅助降糖降脂作用,以期为塔尔米菊粉速冻熟制拉面产业化生产和进一步研究奠定基础。
1 材料与方法
1.1 材料与仪器
雄性黑檀体果蝇(Ebony Flies)购买于中山大学分子生物学与遗传学实验室;天山小麦粉 新疆阿尔曼清真食品工业集团有限公司;塔尔米粉 实验室自制(托里县达尔汗农产品购销农民专业合作社提供制备方法);菊粉(食品级)丰宁平安高科实业有限公司;海藻糖(食品级)德州汇洋生物科技有限公司;亚麻籽粉(食品级)内蒙古益善园生物科技有限公司;高酰基结冷胶(食品级)新疆阜丰生物科技有限公司;甘油三酯、海藻糖、总蛋白含量测定试剂盒 南京建成生物工程研究所;蔗糖(分析纯)天津永晟精细化工有限公司;麦芽糖(分析纯)上海麦克林生化科技有限公司;对羟基苯甲酸甲酯、丙酸 西陇科学股份有限公司;琼脂、大豆粉、玉米粉、酵母粉、食用盐 市购。
DW-86L490J型超低温冰箱、BCD-225WDGK型冰箱 青岛海尔股份有限公司;C21-RC266型电磁炉 广东美的生活电器制造有限公司;LEO1430VP型扫描电镜 德国LEO公司;721G型紫外分光光度计 上海精科上分厂;HE-3000 G型全波长多功能酶标分析仪 北京赛尔福知心科技有限公司;HH-4型数显恒温水浴锅 常州越新仪器制造有限公司;H1650R型台式高速冷冻离心机 上海卢湘仪离心机仪器有限公司;GZ-250-GⅡ型智能光照培养箱 韶关市广智科技设备有限公司;SW CJ-2G型双人单面净化工作台 苏州博莱尔净化设备有限公司。
1.2 实验方法
1.2.1 塔尔米速冻熟制拉面的制备 小麦粉、塔尔米粉、水、盐→和面→醒面(30 min)→二次和面→醒面→沸水煮(3 min)→冷却→沥干(3 min)→速冻→冻藏→包装。
操作要点:
和面:将面粉和塔尔米粉末混合均匀,将盐溶于水中再进行和面。
冷却:将煮好的拉面捞出,过冷水使其快速冷却至室温。
冻藏:-30℃超低温冰箱冻藏30 min后,及时放入-18℃冰箱中进行冷藏。
1.2.2 菊粉对速冻熟制拉面品质的影响 塔尔米拉面配方:小麦粉、塔尔米粉15%(以小麦粉为基数)、水59%、盐1%。在塔尔米拉面配方里,分别加入菊粉0、0.05%、0.10%、0.15%、0.20%,按1.2.1所示工艺制得速冻熟制拉面,以膨胀率、蒸煮损失率、微观结构、拉伸特性为指标,分析菊粉对速冻熟制拉面品质的影响,确定菊粉最适添加量。
1.2.3 速冻熟制拉面品质指标的测定
1.2.3.1 膨胀率的测定 参照任彬[25]的方法进行。称取10 g按1.2.1所示工艺制得速冻熟制拉面,记为m1(g);置于80 mL蒸馏水中煮沸1 min,捞出面条,用蒸馏水淋去湿面条外部的水后室温晾干,天平称重,记为m2(g)。

1.2.3.2 蒸煮损失率的测定 参照阿瓦古丽等[26]的方法进行。称取10 g速冻熟制拉面样品,于80 mL蒸馏水中煮沸1 min,捞出。取煮沸后的面汤,于460 nm波长处检测其吸光度,以蒸馏水为参比,以面汤的吸光值表示面条的蒸煮损失。面汤的吸光值越大,表示蒸煮损失越大,拉面品质越差。
1.2.3.3 表面微观结构观察 参照徐芬等[27]的方法采用扫描电镜(SEM)。速冻熟制拉面样品经冷冻干燥后,取出样品小心截取一个横截面,避免横截面受到压迫使内部结构遭到破坏,取截面较为平整的样品放入电镜载物腔,将样品移至载物腔中央,关闭载物腔后抽真空,电脑扫描观察其放大500倍的微观结构。
1.2.3.4 拉伸特性的测定 参照葛秀秀[28]的方法进行。称取50 g解冻煮熟的拉面,量取1000 mL蒸馏水,待水再次沸腾时开始计时,煮至最佳烹饪时间后取出拉面,漂洗30 s,吸干湿拉面表面的水分。将面条取出置于试验台上,在TPA模式下使用P75探针,面条以恒定速度向上伸展,直至面条刚刚拉断。在测试过程中,禁止触摸样品和上下探针以防止测试数据受到影响,每个样品进行8次平行测试,取平均值。
1.2.4 塔尔米菊粉速冻熟制拉面体内辅助降糖降脂实验
1.2.4.1 雌雄果蝇的鉴别 根据表1进行雌、雄果蝇的鉴别。

表1 雌雄果蝇外观特征Table 1 Appearance characteristics of male and female male and female drosophila
1.2.4.2 高糖、高脂诱导的果蝇Ⅱ型糖尿病模型的建立 将挑选出的雄性果蝇进行随机分为8组,每组30只。空白对照组的果蝇使用普通果蝇培养基,其余果蝇孵育在高糖或高脂培养基1周后,再分别随机分为模型组、基础配方组、阳性对照组、塔尔米菊粉联用低剂量组、塔尔米菊粉联用高剂量组、塔尔米组、菊粉组,分别给药1周后按试剂盒方法测定海藻糖、甘油三酯、总蛋白含量。
1.2.4.3 果蝇培养基的制备 参考文献[29]操作步骤制备果蝇培养基。高糖/高脂果蝇培养基为在普通果蝇培养基的基础上,加入重量为培养基重量20%的蔗糖/棕榈酸,制备步骤相同。阳性对照组培养基为在普通培养基中,加入重量为培养基重量0.1%的二甲双胍。塔尔米菊粉联用低剂量组、塔尔米菊粉联用高剂量组、塔尔米组、菊粉组培养基配方为按照表2的分组,在普通培养基中,加入对应重量的速冻熟制拉面样品。
其中不同拉面配方如下:
基础配方组为全小麦粉;塔尔米组为小麦粉、塔尔米粉15.10%(以小麦粉为基数);菊粉组为小麦粉、菊粉15.10%(以小麦粉为基数);塔尔米菊粉联用组为小麦粉、塔尔米粉15%(以小麦粉为基数)、菊粉0.10%。
1.2.4.4 实验分组 分组情况见表2。
1.3 数据处理
实验数据采用SPSS22软件进行统计学分析,结果均用“平均值±标准差”()表示,以t检验进行统计学显著性检验,用Origin 2018软件作图。
2 结果与分析
2.1 菊粉对速冻熟制拉面品质的影响
2.1.1 菊粉对速冻熟制拉面膨胀率/蒸煮损失率的影响 膨胀率越低,说明面条结构稳定程度越高[30]。如图1A所示,随着菊粉添加量的增加,拉面的膨胀率呈现先降低后增加的趋势。当菊粉添加量小于0.10%时,随着菊粉添加量的增加,速冻熟制拉面的膨胀率有大幅度的减小。菊粉添加量为0.10%时,速冻熟制拉面的膨胀率最低(29.80%±0.45%)。当菊粉添加量超过0.10%时,随着菊粉添加量的增加,速冻熟制拉面的膨胀率又有所升高(菊粉添加量为0.20%时,膨胀率为35.12%±0.76%。这是由于菊粉在一定范围内能够增强面团的强度[31],从而降低膨胀率。菊粉添加量高于0.10%时,速冻熟制拉面的膨胀率不断增大,分析是因为菊粉是一种可溶性膳食纤维,超过最适添加量后,随着添加量的提高,会出现一定程度的吸水现象,导致膨胀率提高[32],但总体膨胀率均小于未添加菊粉的拉面。
蒸煮损失率是反映面条微观结构的连续性及面条品质的重要指标[33]。吸光值越大,表示蒸煮损失越大,拉面品质越差[34]。如图1B所示,随着菊粉添加量的增加,吸光度呈现先降低后增大的趋势。当菊粉添加量小于0.10%时,随着菊粉添加量的增加,速冻熟制拉面的吸光值不断减小,菊粉添加量为0.10%时,速冻熟制拉面的吸光值最低,为(0.23±0.01)Abs,蒸煮损失率最小。分析原因为添加少量菊粉可增加面团的凝胶特性,降低拉面吸水率[35],从而降低蒸煮损失率。菊粉添加量高于0.10%时,速冻熟制拉面的吸光值不断增大,当菊粉添加量增加至0.20%时,吸光度增大至0.34±0.02 Abs。分析原因为随着菊粉加入比例的变大,面团凝胶形成能力逐渐降低,水溶性不断增大[31],导致蒸煮损失率增加。因此以膨胀率及蒸煮损失率为考察指标时,速冻熟制拉面菊粉最适添加量为0.10%。

表2 高糖/高脂诱导的Ⅱ型糖尿病果蝇实验分组Table 2 Experimental groups of high blood sugar/fat induced drosophila type 2 diabetes
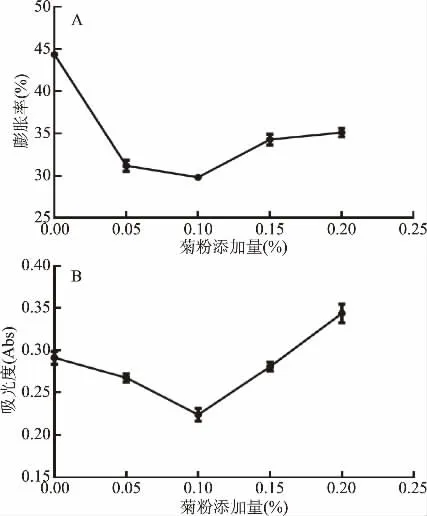
图1 菊粉对塔尔米速冻熟制拉面膨胀率、蒸煮损失率的影响Fig.1 Effect of inulin content on expansion rate/cooking loss of ta-er-mi quick-frozen cooked noodles
2.1.2 菊粉对速冻拉面微观结构的影响 如图2所示,不同菊粉添加量的速冻熟制拉面样品截面的孔隙率、孔隙大小差异较大,说明菊粉对速冻熟制拉面的内部结构有一定的影响,菊粉添加量为0时,拉面网络结构松散,孔隙率大。随着菊粉添加量的增加面团网络结构开始变得紧密,孔隙率、孔隙大小降低。菊粉添加量为0.10%时,其网络结构最为紧密,且孔隙率低、孔隙小且均匀,因此以微观结构为考察指标时,速冻熟制拉面中菊粉的最适添加量为0.10%。
2.1.3 菊粉对拉面拉伸特性的影响 由表3可知,随着菊粉添加量的增加,拉面的拉断力和拉伸距离两个指标均呈先增大后减小的趋势。当菊粉添加量为0.10%,速冻熟制拉面的拉断力达到最大,为(45.15±0.10)g。菊粉添加量为0.05%时,拉伸距离值最大,为(8.75±0.10)mm。这与张令文等[36]研究天然菊粉对面团流变学及面条品质影响的结果一致。分析原因为菊粉对面团的延展性有影响,随着菊粉的添加量增加到一定程度,速冻熟制拉面的延展性达到最高值,再增加菊粉的添加量会导致面条的硬度增大[37],从而使面条的断裂强力和断裂伸张也呈先上升后下降的趋势。结合扫描电镜图,综合考虑两个指标,菊粉最适添加量为0.10%。
2.2 速冻熟制拉面对高糖诱导的Ⅱ型糖尿病果蝇糖代谢的影响
在果蝇中,饮食中摄取的糖分会通过消化道和肠道运输到脂肪体中,转化成海藻糖释放到血淋巴中进行糖循环[38-40]。海藻糖是昆虫血淋巴内主要糖类物质[41],因此测定海藻糖含量可反映果蝇血糖水平[29]。多余的糖分会以糖原的形式储存在肌肉和脂肪体中[42],同时脂肪体参与调控果蝇体内糖含量的高低[43-44]。因此选择海藻糖及甘油三酯为指标研究速冻熟制拉面对高糖诱导的Ⅱ型糖尿病果蝇糖代谢的影响。
不同配方速冻熟制拉面对高糖诱导的Ⅱ型糖尿病果蝇总蛋白、甘油三酯、海藻糖含量影响见图3。
蛋白质是动物细胞、组织的重要成分,其含量的变化直接影响动物的各种生理机能和生长发育情况[45]。由图3可知,与正常组相比,高糖模型组总蛋白含量有所降低,但无统计学意义(P>0.05),说明高糖诱导对果蝇生长发育无显著影响;甘油三酯含量及海藻糖含量极显著增加(P<0.01),说明模型建立成功。

图2 不同菊粉添加量的速冻熟制拉面SEM图(500×)Fig.2 SEM diagram of quick-frozen cooked noodles with different inulin addition(500×)

表3 菊粉对塔尔米速冻熟制拉面拉伸特性影响Table 3 Effect of inulin on the tensile properties of ta-er-mi quick-frozen cooked noodles
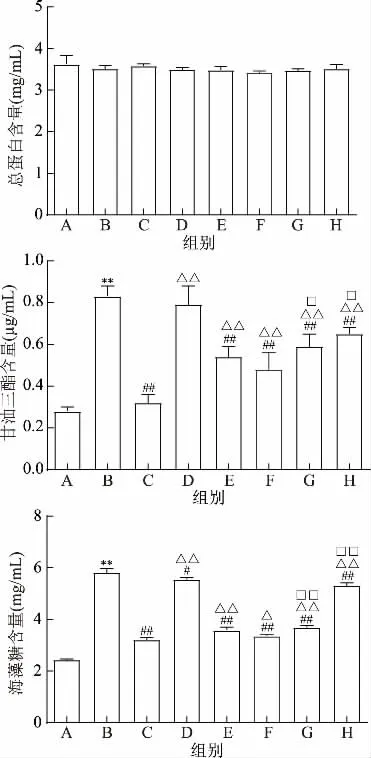
图3 塔尔米菊粉拉面对高糖诱导的Ⅱ型糖尿病果蝇总蛋白/甘油三酯/海藻糖含量的影响Table 3 Effects of ta-er-mi and inulin noodle on total protein/triglyceride/trehalose content in high sugar induced drosophila type 2 diabetes
与模型组相比,各组总蛋白含量均有所降低,但无统计学意义(P>0.05),说明各配方拉面对高糖诱导的Ⅱ型糖尿病果蝇生长发育无显著影响;添加了塔尔米及菊粉的拉面均能极显著降低甘油三酯及海藻糖含量(P<0.01),其中塔尔米菊粉联用高剂量组作用最显著,相比于模型组甘油三酯含量降低42.17%,海藻糖含量降低41.99%。
与塔尔米菊粉联用速冻熟制拉面组相比,单独使用塔尔米和单独使用菊粉的拉面降低高糖诱导的Ⅱ型糖尿病果蝇的甘油三酯含量和海藻糖含量作用相对较弱(分别为P<0.05,P<0.01)。说明塔尔米菊粉联合作用效果强于菊粉和塔尔米单独作用,具有协同辅助降糖作用。
塔尔米菊粉联用高剂量组降低甘油三酯及海藻糖含量能力与阳性对照组相比差异显著(P<0.05)。不同配方速冻熟制拉面对高糖诱导的果蝇总蛋白、甘油三酯、海藻糖含量虽有所降低,但与阳性对照组相比,还是具有一定差异。
2.3 速冻熟制拉面对高脂诱导的Ⅱ型糖尿病果蝇脂代谢的影响
有研究报道,脂肪体通过对饮食中碳水化合物含量的变化来调节大脑中DILPs的分泌[46]。果蝇脂质代谢与哺乳动物类似,其体内脂质代谢的主要物质一脂肪酸(fatty acid,FA)一部分直接从饮食中获得,还有一部分是将甘油三酯通过脂肪酶分解得到[47-48]。因此选择海藻糖及甘油三酯为指标研究速冻熟制拉面对高脂诱导的Ⅱ型糖尿病果蝇脂代谢的影响。
不同配方速冻熟制拉面对高脂诱导的Ⅱ型糖尿病果蝇总蛋白、甘油三酯、海藻糖含量影响见图4。与正常组相比,模型组总蛋白含量有所降低,但无显著差异(P>0.05),说明高脂诱导对果蝇生长发育无显著影响;甘油三酯含量及海藻糖含量极显著升高(P<0.01),说明模型建立成功。
与模型组相比,各组总蛋白含量无显著差异(P>0.05),说明各配方拉面对高脂诱导的Ⅱ型糖尿病果蝇生长发育无显著影响;基础配方拉面组甘油三酯含量极显著降低(P<0.01),海藻糖含量有所降低,但无显著差异(P>0.05);添加塔尔米和菊粉的各组拉面甘油三酯含量和海藻糖含量均极显著降低(P<0.01),其中塔尔米菊粉联用高剂量组拉面作用最显著(P<0.01),相比于模型组甘油三酯含量降低63.05%,海藻糖含量降低20.15%。
其中,塔尔米菊粉联用高剂量组降低甘油三酯及海藻糖含量能力与阳性对照组相比差异极显著(P<0.01)。
与塔尔米菊粉联用速冻熟制拉面组相比,单独使用塔尔米和单独使用菊粉的拉面降低高脂诱导的Ⅱ型糖尿病果蝇的甘油三酯含量和海藻糖含量作用相对较弱(P<0.01)。说明塔尔米菊粉联合作用效果强于菊粉和塔尔米单独作用,具有协同辅助降血脂作用。
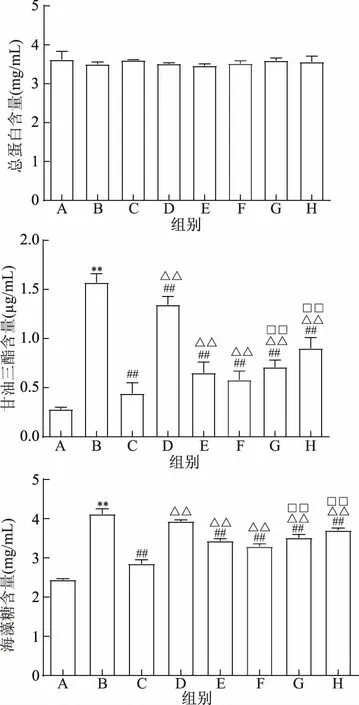
图4 塔尔米菊粉拉面对高脂诱导的Ⅱ型糖尿病果蝇总蛋白/甘油三酯/海藻糖含量的影响Fig.4 Effects of ta-er-mi and inulin noodle on total protein/triglyceride/trehalose content in high fat induced drosophila type 2 diabetes
综上,添加菊粉和塔尔米的拉面均能降低高糖及高脂诱导的Ⅱ型糖尿病果蝇甘油三酯含量及海藻糖含量,但对其总蛋白含量无显著影响(P>0.05),其中塔尔米菊粉联用高剂量组拉面的作用最显著(P<0.01)。
3 结论
添加菊粉后,塔尔米速冻熟制拉面膨胀率、蒸煮损失率、微观结构均有所改善,当菊粉添加量为0.10%时,拉面的膨胀率、蒸煮损失率均为最低值分别为29.80%±0.45%、(0.23±0.01)Abs,微观结构最紧密、孔隙率低、孔隙小且均匀,拉伸特性最强,拉断力为(45.15±0.10)g、拉伸距离值为(8.75±0.10)mm。添加了菊粉和塔尔米的速冻熟制拉面能降低高糖及高脂诱导的II型糖尿病果蝇的海藻糖及甘油三脂含量(P<0.01),说明添加了塔尔米和菊粉的速冻熟制拉面具有一定的调节血脂水平和降血糖作用;其中,同时添加塔尔米和菊粉的拉面降低甘油三酯和海藻糖含量作用最显著(P<0.01),优于单独添加塔尔米和菊粉的拉面,说明塔尔米和菊粉有协同辅助降糖降脂作用。

