大豆秸秆制备活性炭及其Cu2+吸附性能的研究
燕 翔,张少飞,*,王都留,裴 平,王文健,李 娟,李 菲,赵艳霞
(1.陇南师范高等专科学校农林技术学院,甘肃陇南742500;2.新疆阿图什市格达良乡库也克小学,新疆阿图什845355;3.陇南市成县鸡峰镇张坪小学,甘肃陇南742513)
工业含铜废水主要来源于皮革制造、电镀、电子材料漂洗、金属矿业、重金属加工及农药等行业,对动植物体、人体和生态环境有很大危害[1]。目前处理废水中Cu2+的主要方法有离子交换法[2]、化学沉淀法[3]、湿法还原法[4]、铁屑微电解法[5]、电化学法[6]、吸附法[7]等,其中,活性炭吸附法是最常用的一种处理技术[8]。活性炭是一种常用的多孔碳材料,具有孔隙结构发达、比表面积巨大、吸附能力强、化学稳定性好、再生方便等特点,被广泛应用于液相和气相的吸附、脱色、精制、分离、催化等领域,在环保、食品、医药、化工等方面有重要意义[9]。
近年来利用农作物秸秆制备活性炭是研究热点之一,国内外许多学者对利用农作物秸秆制备活性炭及其对Cu2+吸附性能进行了研究[10-12]。我国大豆秸秆资源颇为丰富,大豆秸秆中约含纤维素48.7%,半纤维素12.7%,木质素27.12%~36.98%,灰分2.90%[13-14]。纤维素和半纤维素中主要含有含氧官能团,如羧基、羟基、醚和羰基,木质素是高度聚合的复杂酚类聚合物,分子结构中存在着芳香基、酚羟基、醇羟基、羰基、共轭双键等活性基团[15],大豆秸秆适宜于用作制备活性炭的原料[16]。目前,大豆秸秆主要用作饲料,利用率不高,用于制备活性炭的研究也鲜有报道。田叶顺[17]以大豆秸秆为原料,CO2为活化剂,Fe(NO3)3·9H2O为催化剂前驱体,通过微波加热技术制得生物质基脱硫活性炭材料。朱波[18]通过柠檬酸化学改性大豆秸秆,制备出对重金属离子有着较好吸附性能的生物吸附剂。
氯化锌是近年来利用农业废弃物制备活性炭常用的化学活化剂之一[19]。一般认为氯化锌在原料炭化和活化过程中具有较强的脱羟基及脱水的双重作用,活化阶段氯化锌溶液对纤维素产生侵蚀、溶解作用,使原料内部形成细孔结构;炭化阶段氯化锌能促进纤维素、半纤维素和木质素热解,通过缩聚反应进行芳构化,形成基于多层石墨结构的初始裂隙;C、H、O在结构中发生交联反应而增加炭的芳香层。此外,大部分氯化锌沉积在炭中起骨架作用,当洗涤除去氯化锌后使炭粒形成多孔结构;氯化锌沉积还能保护炽热炭被氧化,有利于提高活性炭的产率[20]。
本实验以大豆秸秆为原料,采用ZnCl2活化、马弗炉炭化法制备大豆秸秆活性炭(简称SSAC),主要考察了炭化温度、炭化时间对亚甲基蓝吸附值的影响,并得到最优化制备条件。对最优化条件下制得的SSAC,通过SEM、FTIR进行形貌、官能团结构表征,通过静态吸附实验考察SSAC对模拟废水中Cu2+的吸附性能,并对影响吸附性能的因素加以探讨,以期为提高大豆秸秆的利用率和含Cu2+废水处理提供一定的参考。
1 材料与方法
1.1 材料与仪器
大豆秸秆 甘肃省陇南市成县当地;ZnCl2天津市天力化学试剂有限公司;KBr 天津市化学试剂一厂;CuSO4·5H2O 天津市大茂化学试剂厂;亚甲基蓝 北京化工厂;所有试剂均为分析纯。
ULTRA PLUS热场发射扫描式电子显微镜 德国Zeiss公司;VERTEX 70傅里叶红外光谱仪 德国Bruker公司;UV-2600紫外可见分光光度计 津岛仪器(苏州)苏州有限公司;721S分光光度计 上海精科;PHS-3B型精密p H计 上海博取仪器有限公司;400Y多功能粉碎机 铂欧五金厂;ZY-MB马弗炉 洛阳中苑实验电炉厂;WH-3旋涡混合器 陕西恒盛仪器设备有限公司;GZX-GFC·101-O-BS电热恒温鼓风干燥箱 上海博泰实验设备有限公司;TS-200B恒温培养振荡器 上海捷呈实验仪器有限公司。
1.2 实验方法
1.2.1 大豆秸秆活性炭的制备工艺 以大豆秸秆为原料,采用ZnCl2活化法制备活性炭,制备工艺流程见图1。
具体操作步骤如下:
活化:将洗净的大豆秸秆置于烘箱内80℃下干燥6 h,粉碎机粉碎后,用80目筛过筛。称取200 g大豆秸秆细粉于烧杯中,加入300 mL的3 mol/L ZnCl2溶液,搅拌均匀,密封浸渍活化48 h。浸渍后的物料于80℃下烘干24 h。

图1 SSAC制备工艺流程Fig.1 Preparation process of SSAC
炭化:将干燥后的物料移至马弗炉中,升温至设定温度,并保温一定时间。在没有氮气保护的条件下,坩埚需盖好坩埚盖,以便适当隔绝空气。
水洗:炭化后SSAC冷却至室温,用蒸馏水反复洗涤至滤液p H近中性。将SSAC放入电热鼓风烘箱中,110℃下烘干4 h,磨细后用200目筛子过筛,密封贮存在干燥器中,以备进行产品性能分析。
1.2.2 炭化条件对SSAC吸附性能的影响 将干燥过的物料分别在400、500、600、700、800℃条件下,置于马弗炉中热解10、20、30、40、50 min得到不同炭化条件下的SSAC。考察炭化温度、炭化时间对活性炭亚甲基蓝吸附值的影响。
1.2.3 大豆秸秆活性炭亚甲基兰吸附值的测定 依据国标GB/T 12496.10-1999《水质活性炭试验方法——亚甲基蓝吸附值的测定》测定:称取0.100 g活性炭样品置于100 mL具磨口塞的锥形烧瓶中,通过滴定管加入适量的1.5 g/L亚甲基蓝试验液,待试样全部湿润后,立即置于旋涡振荡机上振荡20 min后过滤。用分光光度计在波长665 nm下测定吸光度,当该吸光度与CuSO4标准滤色液(称取4.000 g CuSO4·5H2O溶于1000 mL水中)的吸光度相当时,所耗用亚甲基蓝试验液的体积即为SSAC亚甲基蓝吸附值,单位以mL/0.1 g为表示。
1.2.4 大豆秸秆活性炭的形貌结构表征
1.2.4.1 扫描电镜(SEM)将优化条件(炭化温度700℃、炭化40 min)下制得的活性炭样品喷金后,采用ULTRA PLUS热场发射扫描电子显微镜,扫描电压为5.0 kV,放大为20000和30000倍,观察、记录SSAC的形貌。
1.2.4.2 傅里叶-红外光谱分析(FT-IR)称取优化条件下制得的活性炭0.002 g,与0.2 g的KBr混合均匀,在10 t/cm2的压力下压制成透明压片,利用VERTEX 70傅里叶红外光谱仪在4000~400 cm-1对样品进行扫描,检测SSAC的表面官能团。相同条件下对大豆秸秆粉(soybean straw powder,记作SSP)进行FT-IR分析。
1.2.5 大豆秸秆活性炭对Cu2+吸附性能试验
1.2.5.1 Cu2+标准曲线的绘制 准确移取10 mg/L CuSO4标准溶液于100 mL容量瓶中,配制浓度为0、2.0、4.0、6.0、8.0、10.0 mg/L的Cu2+标准溶液,调节pH5.0,用蒸馏水作参照,在最佳波长440 nm,用紫外分光光度计测定Cu2+标准曲线。
1.2.5.2 吸附温度对大豆秸秆活性炭吸附Cu2+效果的影响 取10 mg/L CuSO4标准溶液100 mL,调节pH5.0,加入优化条件下制得SSAC 0.2 g,在20、30、40、50、60℃下恒温振荡2 h后滤膜过滤,用紫外分光光度计测定活性炭对Cu2+的吸附量。
1.2.5.3 pH对大豆秸秆活性炭吸附Cu2+效果的影响 取10 mg/L Cu2+溶液100 mL,加入优化条件的SSAC 0.2 g,在pH分别为2.5、3.5、4.5、5.0、5.5、6.5的条件下,50℃恒温振荡(转速200 r/min)2 h后滤膜过滤,用紫外分光光度计测定活性炭对Cu2+的吸附量。
1.2.5.4 时间对SSAC吸附Cu2+效果的影响 取10 mg/L CuSO4标准溶液100 mL,调节pH5.0,加入优化条件下制得SSAC 0.2 g,在50℃下恒温振荡1、2、3、4、5、10、15、20、25、30、35、40、50和60 min后立刻取出后进行滤膜过滤,用紫外分光光度法测定SSAC对Cu2+的吸附量。
1.3 数据处理
1.3.1 亚甲基蓝吸附值的计算 SSAC亚甲基蓝吸附值按式(1)计算。
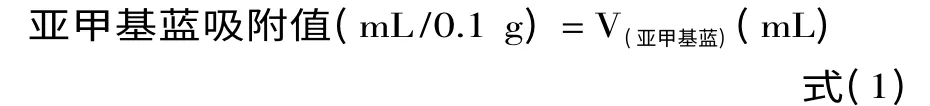
1.3.2 Cu2+吸附量和去除率的计算 SSAC对Cu2+吸附量和去除率分别按式(2)、(3)计算。
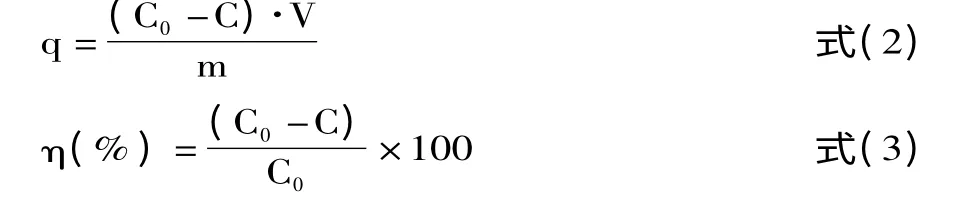
式中:q为平衡吸附容量,mg/g;η为去除率,%;C0、C为吸附前后Cu2+的浓度,mg/L;V为Cu2+溶液体积,L;m为活性炭的质量,g。
1.3.3 统计分析 大豆秸秆粉、SSAC的傅里叶-红外光谱图实验数据利用Origin 9软件进行作图。
2 结果与分析
2.1 大豆秸秆活性炭制备工艺条件
影响秸秆活化的因素较多,受条件限制,仅选取炭化温度、炭化时间两个因素,以亚甲基蓝吸附值作为指标,考察制备工艺参数对亚甲基蓝吸附值的影响。试验数据见表1。
2.1.1 亚甲基蓝吸附值的极差分析 SSAC亚甲基蓝吸附值的极差分析见表2。从表2中可以看出,亚甲基蓝值的极差主次顺序为:炭化时间>炭化温度。氯化锌法制备SSAC的优化组合是A4B4,即炭化温度700℃、炭化时间40 min。优化水平下SSAC亚甲基蓝吸附值的最大值为1.84 mL/0.1 g。
将各因素水平的平均值k1、k2、k3等与因素水平对应起来作图,可以得到亚甲基蓝吸附值的因素关系图,见图2。
2.1.2 炭化时间的影响 炭化时间对活性炭的孔的生长和发展有较大影响。由图2(a)可知,随炭化时间的增加亚甲基蓝吸附值逐渐增大,40 min时到最大值,40 min后随炭化时间延长,亚甲基蓝吸附值开始逐渐下降。时间过短时,原料中纤维素、木质素分解不完全,缩聚反应和交联反应也不彻底,炭结构未形成多孔结构,导致SSAC吸附能力较低。随着炭化反应时间延长,大多数活性区表面的碳原子被移除,使微孔长大并产生新孔,孔容增加,SSAC比表面积增大,吸附力增强[20]。40 min后随炭化时间延长,活性炭颗粒呈现热塑性而失去刚性,造成炭粒结构塌陷,使微孔孔道破坏而形成中孔,甚至大孔。此外,炭粒结构塌陷还可能阻塞己形成的微孔孔道,导致吸附性能会下降[21]。因此,炭化时间为40 min较为适宜。

表1 SSAC制备工艺参数对亚甲基蓝吸附值的影响Table 1 Influence of parameters of activated carbon preparation on methylene blue adsorption
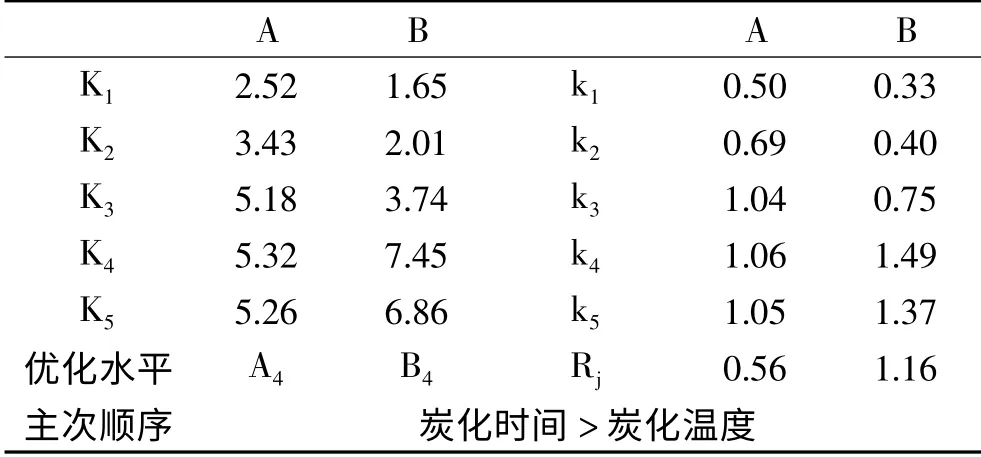
表2 亚甲基蓝吸附值的极差分析Table 2 Range analysis of methylene blue adsorption
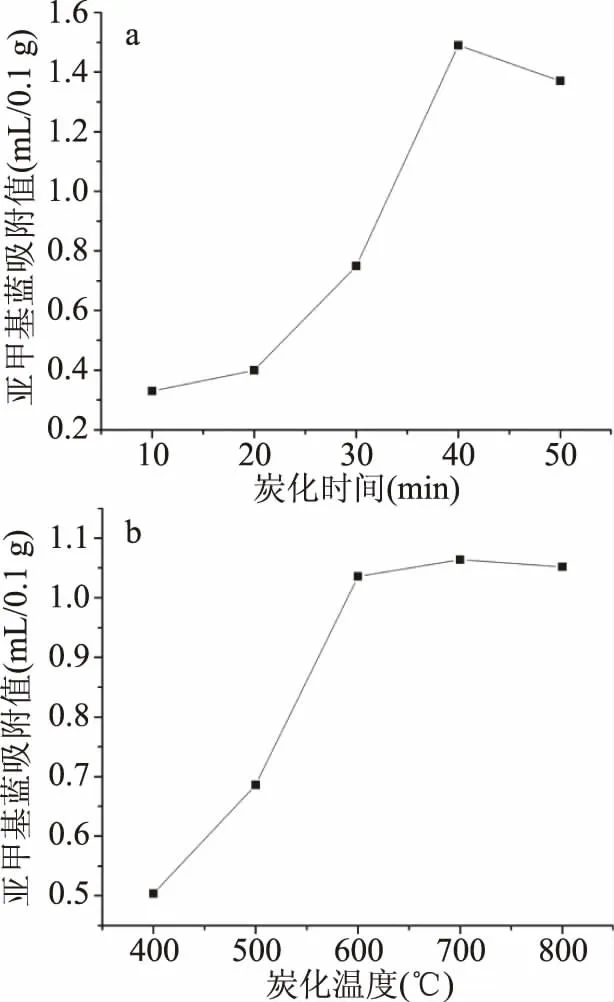
图2 亚甲基蓝吸附值与因素水平关系图Fig.2 Relationship between the level of factor and methyl blue adsorption value
2.1.3 炭化温度的影响 从图2(b)中看出,在400~600℃的范围,随着温度升高亚甲基蓝吸附值增大趋势明显,600℃后呈缓慢增大趋势,700℃时达到最大值,之后开始逐渐降低,但变化趋势平缓。这是由于炭化初期随温度升高,炭化反应速率加快,大量的C以CO2、H和O以H2O等小分子的形式脱去,形成丰富的孔隙结构[22],SSAC吸附性增强。炭化温度越高,产生的挥发性气体越多,形成的孔隙越多,使得后续活化进行得更彻底。但600℃后活性炭孔隙结构可能因烧蚀加剧而塌陷,使原有微孔不断扩大,形成中孔和大孔,引起其吸附性能下降[23]。因此,炭化温度为700℃较为适宜。
2.2 大豆秸秆活性炭的表征结果
2.2.1 扫描电镜分析(SEM)大豆秸秆粉(SSP)和SSAC的扫描电镜图如图3所示。从图3(a)SSP活化炭化前的形貌可以看出,部分粉粒依然保持规则的小纤维管束结构,图3(b)是放大20000倍下的粉粒形态,表面光滑完整。从图3(c)SSAC炭粒形貌看出,炭粒呈现多层状的裂隙形态,且内部形成凹陷。这是由于ZnCl2有催化脱羟基及脱水的双重功能,炭化过程中能促进纤维素热解,以CO2和水蒸气形式逸出,形成了基于石墨结构的层状裂隙[20],使SSAC炭粒具有丰富的比表面积。另外,图3(c)和(d)可知,大豆秸秆经活化炭化在表面形成光滑、粒度较为均匀的炭微球,其颗粒直径为0.5~5μm。由于氯化锌是路易斯酸,大豆秸秆中的纤维素、半纤维素等有机大分子在氯化锌的催化作用下则会逐渐分解形成甲酸、乙酸等小分子有机酸,当这些中间体小分子浓度达到一定临界值时,彼此之间发生脱水及芳构化反应而聚合成晶核,且随着炭化反应的不断深入,晶核逐渐长大并最终形成表面光滑的炭微球。炭球的形成使SSAC的吸附面积更加丰富,进一步增强SSAC的吸附性能[24]。

图3 SSP和SSAC扫描电镜图片Fig.3 SEM images of SSPand SSAC
2.2.2 红外光谱分析(FT-IR) 在图4(a)SSP的FT-IR谱图中,3478、2919和2844、1735~1650 cm-1分别应于来源木质素中羟基的O-H伸缩振动峰、甲基CH3和亚甲基CH2的C-H不对称和对称伸缩振动、羰基C=O的吸收峰。1559~1504 cm-1之间的4个吸收峰归属木质素特有的苯环骨架的特征吸收峰(C=C)[25]。在图4(b)SSAC的FT-IR谱图中,原出现在图(a)中羰基区的C=O峰、芳环骨架(C=C)的峰基本消失,表明大豆秸秆中木质素大部分分解;在2919和2844 cm-1的C-H特征吸收峰几乎消失,1400 cm-1处的酚羟基O-H面内弯曲振动峰减小,表明与木质素中芳基相连的甲氧基因高温炭化而基本完全分解[18]。
图4(a)SSAC谱图中,3481、2924、1650、1269~885 cm-1之间的吸收峰,分别对应于O-H、C-H、C=O、醚C-O-C;956 cm-1的吸收峰是纤维中醚键的特征峰;670 cm-1为羟基-OH面外变形振动[26]。图4(b)中,在3417 cm-1处形成一个对应于缔合O-H键的加宽的强吸收峰,这是因为炭化反应中O-H键断裂和缩合而引起振动频率红移[27]。1623 cm-1的尖锐吸收峰是C=O发生共轭效应而波数降低的酮、羰基化合物和酯基的伸缩振动;1035、956 cm-1的吸收峰消失或减弱,表明大豆秸秆中纤维素中C-O键和O-H键断裂而完全分解;在1234和1085 cm-1附近出现六元双氧环醚中C-O-C的反对称伸缩振动。图4(a)中的920 cm-1附近的峰消失,表明纤维素中的吡喃环结构被彻底破坏,也表明纤维素被分解[18]。
上述FTIR谱图表明,经过ZnCl2活化、高温炭化后,在SSAC中形成了丰富的羰基、羟基、酯基、醚键等极性含氧基团。
2.3 大豆秸秆活性炭对铜离子吸附的研究
2.3.1 Cu2+标准曲线 Cu2+标准工作曲线见图5。对曲线进行回归分析,得到曲线方程其方程为:y=0.0067x-0.0001(x:铜离子浓度,y:吸光度),线性决定系数R2为0.9942。在2.0~10.0 mg/L的浓度范围内,体系吸光度值与Cu2+浓度呈较良好的线性关系,适用于本次研究的样品中Cu2+含量测定。
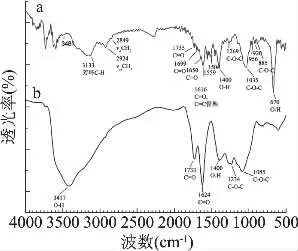
图4 SSP和SSAC的FT-IR图谱Fig.4 FT-IR images of SSP and SSAC

图5 铜离子标准曲线Fig.5 Standard curve of Cu2+
2.3.2 吸附温度对活性炭吸附效果的影响 温度对SSAC吸附Cu2+的影响如图6所示。在20~50℃的温度范围内,SSAC对Cu2+的吸附量随温度升高而增加,50℃时达到最大值,随后呈下降趋势。这是因为随着溶液温度升高,分子热运动加剧,更多Cu2+离子穿过SSAC表面孔隙,进入到内部孔隙中,提高SSAC对Cu2+物理吸附能力[21]。吸附温度超过50℃时,SSAC对Cu2+吸附浓度呈下降趋势,因为温度过高也会导致解吸速度加快,使吸附能力反而降低[28]。故SSAC吸附Cu2+的最佳温度为50℃为宜。
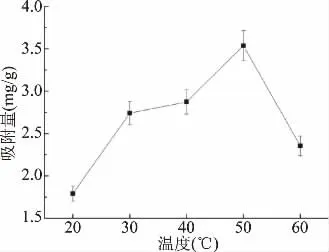
图6 SSAC吸附温度对Cu2+吸附量的影响Fig.6 Effect of adsorbent temperature on the Cu2+adsorption
2.3.3 pH对活性炭吸附效果的影响 溶液pH会影响SSAC上活性功能位点的解离及Cu2+在溶液中的化学形态[29],本试验选择在p H为2.5~6.5的酸性条件下考察活性炭对Cu2+的吸附效果[30]。试验结果如图7所示。

图7 pH对SSAC吸附Cu2+的影响Fig.7 Effect of pH on the Cu2+adsorption
由图7可知,Cu2+离子溶液p H对于SSAC吸附量的影响较明显。当pH2.5~5.0时活性炭吸附量随pH升高而迅速增大,在pH5.0时吸附量达到最大;当pH>5.0时SSAC吸附量开始逐渐下降,pH>5.5时SSAC吸附量明显下降。这是因为在pH较低时,H+与Cu2+竞争SSAC上的结合位点,大量H+会与SSAC孔隙表面的羰基、羧基、羟基等官能团结合,占据了Cu2+吸附位点[31];随Cu2+溶液pH的升高,SSAC表面官能团被质子化,使其表面电势密度降低,Cu2+离子与活性炭表面的静电斥力减少[32];同时由于活性炭表面的官能团为弱酸性,溶液pH升高时,SSAC上负电势点增多,使Cu2+吸附量逐渐增加[32]。此外Cu2+水解出现CuOH+,其易与SSAC表面的羟基发生离子交换反应,使吸附量增大[33]。而当p H>5时,Cu2+主要以Cu(OH)2沉淀和少量CuOH+状态存在,Cu2+离子浓度下降,吸附量开始逐渐下降[34-36]。吸附过程主要是Cu2+、CuOH+、Cu(OH)2与活性炭颗粒表面通过离子交换或氢键相结合[29],其化学反应式为:

其中:R代表SSAC颗粒。上面4个化学反应式中,式(4)~(6)属于离子交换,式(7)属于氢键结合。由试验结果可知,综合考虑各种因素,SSAC对Cu2+吸附的最佳p H为5。
2.3.4 时间对活性炭吸附效果的影响 时间对SSAC吸附Cu2+的影响见图8。吸附初期(前20 min),吸附量随时间快速升高,在20~50 min之间吸附量缓慢升高,50 min时吸附量达到最大值4.589 mg/g,Cu2+脱除率为91.77%。50 min后吸附量略有下降,可能因为解吸反应较为明显[36]。所以,当溶液温度为50℃,pH5时,最佳吸附时间应取50 min。
3 结论
本研究以大豆秸秆为原料,以ZnCl2为活化剂制备大豆秸秆活性炭,以亚甲基蓝吸附值为参考指标,最优化制备工艺条件为:ZnCl2活化剂浓度为3 mol/L、温度为700℃、炭化时间为40 min,此条件下亚甲基蓝吸附值为1.84 mL/0.1 g。用SSAC模拟吸附Cu2+离子废水,吸附剂投加量为0.2 g时,最佳吸附条件为:温度为50℃,p H为5.0,吸附时间50 min,最大吸附量为4.589 mg/g,Cu2+脱除率为91.77%。研究结果表明,SSAC不仅具有丰富发达的基于多层石墨结构的裂隙,而且表面含有丰富的C=O、O-H、C=C和C-O等官能团,使SSAC对Cu2+离子具有较好的吸附能力,适用于含Cu2+废水处理;本研究也为进一步拓展大豆秸秆的利用提供了参考。

图8 时间对SSAC吸附Cu2+的影响Fig.8 Effect of time on the Cu2+adsorption

