基于钯炭催化剂的苯酚加氢反应及其本征动力学
王 鹏, 李 涛, 张海涛, 房鼎业
(华东理工大学化工学院, 上海 200237)
环己酮是一种重要的化工原料,在工业生产中用途广泛,主要可分为酰胺用环己酮和非酰胺用环己酮两大类[1]。酰胺用环己酮主要用于生产己内酰胺和己二酸,而己内酰胺和己二酸可用于合成尼龙6和尼龙66等;非酰胺用环己酮可用作油漆涂料的溶剂等。

本文将Pd/C催化剂应用到苯酚加氢反应中,比较了常用于苯酚加氢反应的几种溶剂,然后选择苯作为溶剂,考察了温度、压力、氢气与苯酚物质的量之比(n(H2)∶n(Phenol))、苯酚的质量空速(WHSV)等反应条件对苯酚加氢反应的影响;建立了本征动力学模型,利用25组正交试验数据进行参数估值,并对动力学模型进行了检验。
1 实验装置和流程
1.1 实验装置
固定床反应器,北京欣航盾石化科技有限公司,型号为MRT-6114;气相色谱仪,美国Agilent公司,型号为GC-7890B,检测器为FID,色谱柱为CP 7414型(30 m×0.32 mm×1.80 μm)。
反应在固定床管式反应器(内径为10 mm,长度为500 mm)中进行,实验装置如图1所示。由于所用的固定床反应器高径比较大,因此整个反应器可视为平推流反应器。
1.2 实验流程

图1 苯酚加氢流程图Fig. 1 Flow sheet of phenol hydrogenation
本文所使用的催化剂是由国内某企业开发的新型Pd/C催化剂。将一定质量的Pd/C催化剂和相同粒度、相同体积的石英砂均匀混合,然后装填在反应管中的恒温段处。催化剂使用前需要先用氢气还原,还原条件为:压力0.1 MPa、温度190 ℃、H2流量40 mL/min,还原时间15 h。
通过程序升温设置反应温度,通过背压阀控制压力,苯酚与苯的混合溶液(苯酚与苯质量比为1∶2)经平流泵控制进入预热器后汽化,并与通过质量流量计控制的氢气在预热器中混合,然后进入反应管中进行气相催化反应。反应稳定后,每隔6 h从取样口取出反应产物,采用气相色谱仪对反应产物进行分析,柱箱程序升温初始温度为40 ℃,升温速率为20 ℃/min,升温至180 ℃,然后保持 5 min,通过内标法计算反应产物中各组分的含量,内标物为碳酸二甲酯。
2 结果与讨论
2.1 反应条件对反应的影响
2.1.1 溶剂的选择 苯酚在常温下为固态,为使苯酚能够通过平流泵进料,需要选择合适的溶剂溶解苯酚。选用苯酚加氢体系比较常用的二氯甲烷、环己烷、乙醇、苯等几种溶剂溶解苯酚(溶剂与苯酚质量比均为2∶1),在温度为190 ℃,压力为0.1 MPa,苯酚质量空速为0.4 h−1,n(H2)∶n(Phenol)=4的条件下,比较上述几种溶剂溶解苯酚时苯酚转化率(X)和环己酮选择性(S)的差别,实验结果如表1所示。由表1可知,二氯甲烷作溶剂时,苯酚转化率和环己酮选择性都不高,不适用于本反应体系;环己烷作溶剂时,苯酚转化率和环己酮选择性均比较高;乙醇作溶剂时,苯酚转化率很高,但环己酮选择性不高,说明醇类溶剂更有利于环己酮继续加氢生成环己醇,但乙醇会吸附在Pd/C催化剂的活性位上,从而对苯酚加氢反应产生不利影响;苯作溶剂时,苯酚转化率和环己酮选择性都很高,说明苯这种非极性溶剂更适合于本反应体系。综上,选择苯作为本反应体系的溶剂。
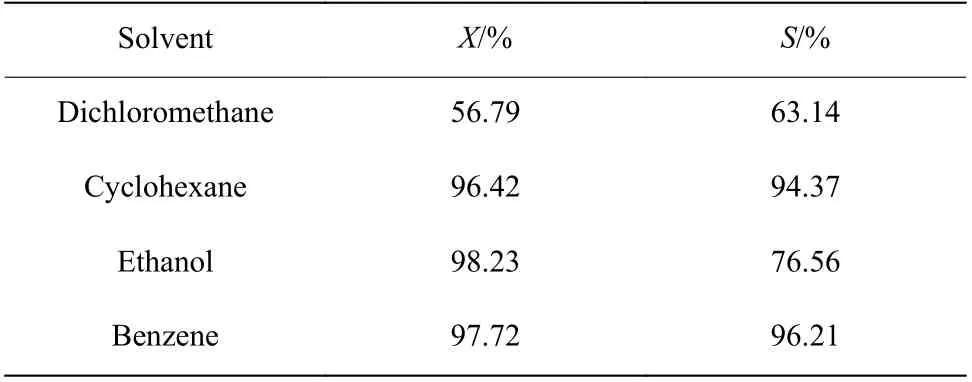
表1 溶剂对反应的影响Table 1 Effect of solvent on the reaction
2.1.2 温度对反应的影响 在压力为0.1 MPa,苯酚质量空速为0.4 h−1,n(H2)∶n(Phenol)=4的条件下,考察了反应温度为160~250 ℃时,苯酚转化率和环己酮选择性的变化情况,结果如图2所示。苯酚加氢反应是放热反应,温度对反应的影响很大。当温度从160 ℃升高到250 ℃时,苯酚转化率先增大后减小,在190 ℃时达到最高;当温度高于220 ℃时,苯酚转化率下降较快,这主要是由于热力学的限制以及吸附在Pd/C催化剂表面的反应物浓度减小所致[10]。同时温度过高,催化剂可能发生失活,并会导致更多副产物(如环己醇)生成,因而环己酮选择性逐渐下降。综上可知,苯酚加氢反应的适宜温度范围为175~205 ℃。
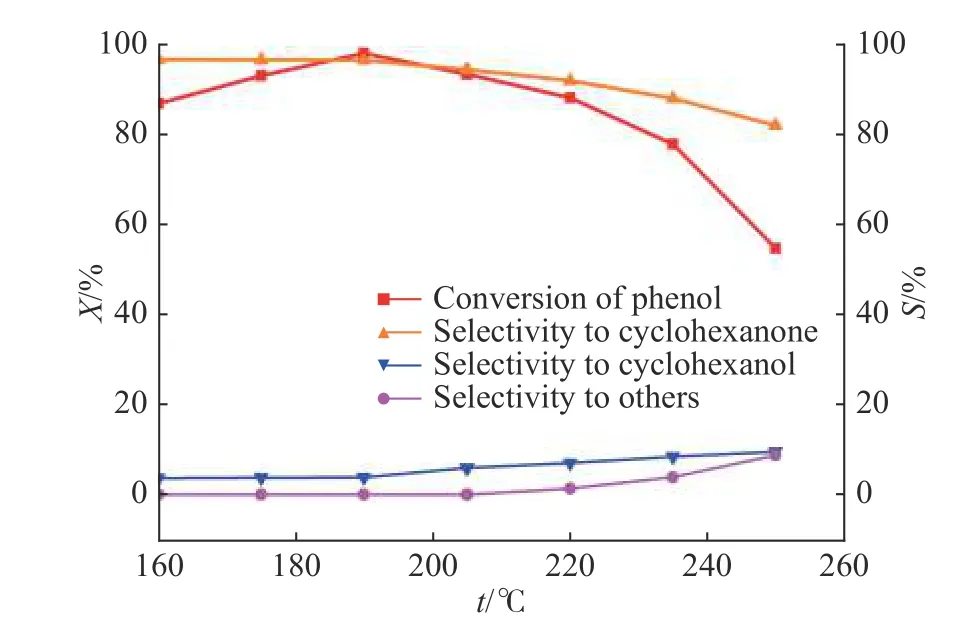
图2 温度对反应的影响Fig. 2 Effect of temperature on the reaction
2.1.3 压力对反应的影响 在温度为190 ℃,苯酚质量空速为0.4 h−1,n(H2)∶n(Phenol)=4的条件下,考察了压力为0.1~2.0 MPa时,苯酚转化率和环己酮选择性的变化情况,结果如图3所示。苯酚加氢反应过程中分子数减少,因此增大反应压力有利于提高苯酚的转化率。当反应器内的压力由0.1 MPa逐渐增加到2.0 MPa时,苯酚转化率逐渐缓慢升高,但环己酮选择性下降。由于反应压力增大会导致副产物环己醇的选择性升高,高压对生成环己醇有利[11-14],因此适宜的反应压力为0.1 MPa。
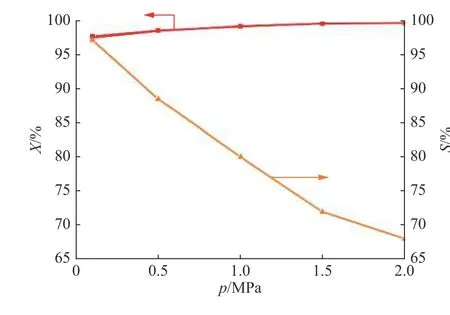
图3 压力对反应的影响Fig. 3 Effect of pressure on the reaction
2.1.4 氢气与苯酚物质的量之比对反应的影响 在温度为190 ℃,压力为0.1 MPa,苯酚质量空速为0.4 h−1的条件下,考察了n(H2)∶n(Phenol)为2~12时,苯酚转化率和环己酮选择性的变化情况,结果如图4所示。随着n(H2)∶n(Phenol)的增大,苯酚转化率逐渐增加,当n(H2)∶n(Phenol)>4时,苯酚转化率增加幅度很小,并逐渐平稳;随着n(H2)∶n(Phenol)的增大,环己酮的选择性逐渐下降。这是因为苯酚加氢反应分为两步,分别是苯酚加氢生成环己酮和环己酮加氢生成环己醇,增大n(H2)∶n(Phenol)的值相当于增加了氢气体积分数,会生成更多的环己醇。当n(H2)∶n(Phenol)>6时,环己酮选择性减小的趋势逐渐变缓,此时氢气已经过量很多,继续增加氢气的量对反应的影响很有限。为了保证苯酚转化率和环己酮选择性都比较高,选择n(H2)∶n(Phenol)≈4比较适宜。
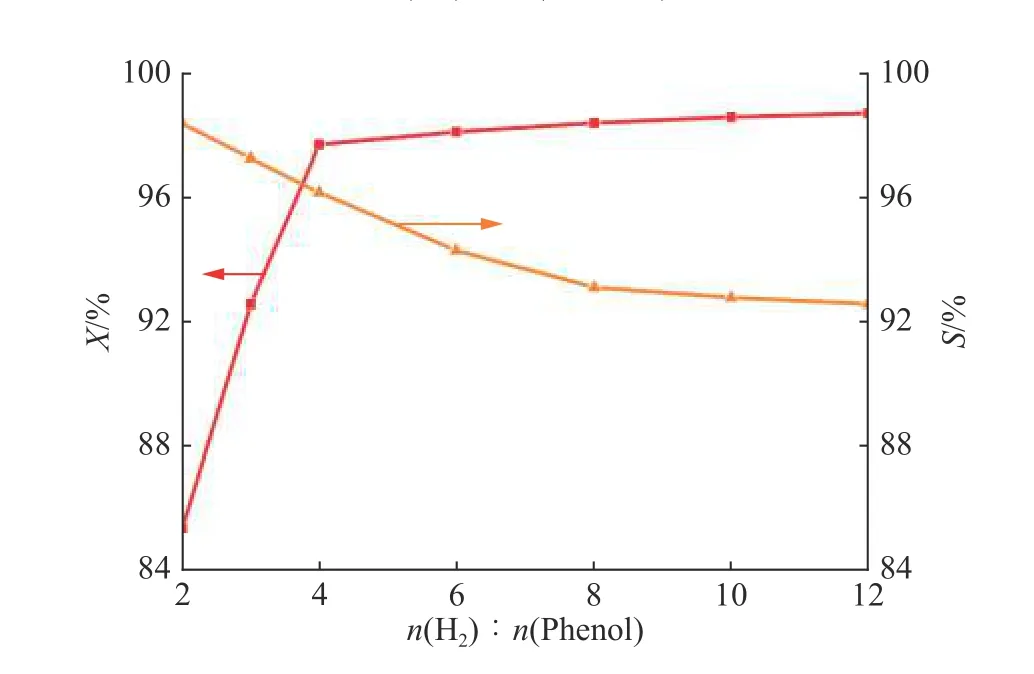
图4 氢气与苯酚物质的量之比对反应的影响Fig. 4 Effect of mole ratio of H2 to phenol on the reaction
2.1.5 苯酚质量空速对反应的影响 在温度为190 ℃,压力为0.1 MPa,n(H2)∶n(Phenol)=4的条件下,考察了苯酚质量空速为0.2~1.0 h−1时,苯酚转化率和环己酮选择性的变化情况,结果如图5所示。随着苯酚质量空速的增加,苯酚的转化率逐渐下降,这是因为苯酚的质量空速越大即单位时间里通过Pd/C催化剂的反应物越多,反应物在Pd/C催化剂上的停留时间就越短,所以转化率下降。随着苯酚质量空速的增加,环己酮选择性缓慢增大,这是因为较短的停留时间会减少环己酮继续加氢生成环己醇的量。因此,苯酚质量空速在0.2~0.4 h−1比较适宜。

图5 苯酚质量空速对反应的影响Fig. 5 Effect of weight hourly space velocity of phenol on the reaction
2.2 本征反应动力学
2.2.1 内外扩散的消除 内扩散的影响可以通过改变Pd/C催化剂的颗粒大小来消除。在反应压力为0.1~0.5 MPa,反应温度为190 ℃,n(H2)∶n(Phenol)=4,苯酚的质量空速为0.4 h−1的条件下,选用不同粒径的催化剂进行实验,结果如表2所示。因此可认为选用80~100目(150~180 μm)的催化剂颗粒已经消除了内扩散的影响。
在反应压力为0.1~0.5 MPa,反应温度为190 ℃,n(H2)∶n(Phenol)=4的条件下,进行两组实验,使用的催化剂质量分别为1.52 、0.91 g,得到苯酚的转化率与m∶WHSV(催化剂质量与苯酚质量空速之比)之间的关系如图6所示。由图6可知,当m∶WHSV<5 h·g时,可以忽略外扩散的影响。

图6 催化剂质量与苯酚质量空速之比对苯酚转化率的影响Fig. 6 Effect of ratio of catalyst mass to WHSV on phenol conversion
2.2.2 本征动力学实验条件与结果 当Pd/C催化剂的质量为1.52 g,粒径为 80~100目(150~180 μm),反应 压 力 为0.1~0.5 MPa,反 应 温 度 为160~220 ℃,n(H2)∶n(Phenol)为2~10,苯酚质量空速为0.4 h−1时,苯酚加氢本征动力学实验数据及结果见表3。
2.2.3 动力学模型的建立 苯酚加氢体系主要包括两个反应,分别如式(1)~式(2)所示:

采用文献[15]中验证的苯酚在钯表面加氢的反应机理,苯酚吸附在钯活性位上生成活性中间体苯氧基,并与吸附在钯活性位上的氢气发生反应,生成环己酮。环己酮从载体表面发生脱附,或是在适宜条件下继续与吸附在钯活性位上的氢气发生反应生成环己醇。以苯氧基与氢气反应生产环己酮为速率控制步骤,以理想吸附模型为基础,同时忽略环己醇和溶剂的吸附,推导出苯酚加氢反应的本征动力学模型,反应速率如式(3)~式(4)所示。

式中,r为反应速率,ki(i为1,2)为反应速率常数,Kj(j为C6H5OH,C6H10O,H2)为吸附平衡常数,K'为平衡常数,p为反应压力,C6H5OH指苯酚,C6H10O指环己酮,C6H12O指环己醇。
平衡常数K'使用文献值[16]:

其中ki0和Kj0分别表示初始反应速率常数和初始吸附平衡常数,E表示活化能,∆H表示焓变,R表示热力学常数。
2.2.4 参数估值 选取C6H10O和C6H12O为关键组分,并以C6H10O和C6H12O出口摩尔分数(y)的计算值(cal.)和实验值(exp.)的残差平方和为目标函数f,即

其中M为实验次数。
采用通用全局算法结合最大继承法,将表1中25组实验数据代入式(3)、(4)中进行参数估值,得到模型中的参数分别为:

表3 固定床反应器内苯酚加氢动力学实验数据Table 3 Kinetic experimental data of phenol hydrogenation in fixed bed reactor

2.2.5 模型检验 对上述本征动力学模型进行统计检验,结果如表4所示。其中MP为参数个数,ρ2为相关系数,F为方差检验。ρ2的值越接近1,所得模型的可靠性越好。ρ2和F的表达式分别如式(14)和式(15)所示。

对于非线性回归,一般要求F>10F0.05(MP,M−(MP–1)),此时模型才是高度显著的。由表4可知,ρ2>0.99,F>10F0.05(10,14),表明在实验条件下,上述动力学模型是适用的。

表4 动力学模型统计检验Table 4 Statistical test of the kinetic model
环己酮、环己醇在反应产物中摩尔分数的实验值与模型计算值如图7和图8所示。
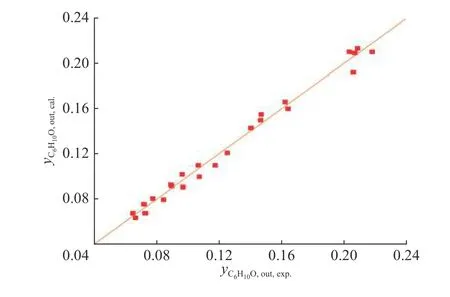
图7 环己酮出口摩尔分数实验值与模型计算值Fig. 7 Experimental values and model calculated values of cyclohexanone molar fraction at reactor outlet

图8 环己醇出口摩尔分数实验值与模型计算值Fig. 8 Experimental values and model calculated values of cyclohexanol molar fraction at reactor outlet
从图7和图8可以看出,环己酮和环己醇出口浓度的实验值和上述动力学模型计算值吻合良好,计算得到环己酮和环己醇出口浓度相对误差的绝对值的平均值分别为4.3%和5.2%。
3 结 论
(1)Pd/C催化剂用于苯酚加氢制备环己酮且选择苯作为溶剂时,适宜的反应条件为:反应温度175~205 ℃,反应压力0.1 MPa,n(H2)∶n(Phenol)≈4,苯酚质量空速0.2~0.4 h−1。
(2)使用80~100目(150~180 μm)的Pd/C催化剂,在反应压力为0.1~0.5 MPa,反应温度为160~220 ℃,苯酚质量空速为0.4 h−1,n(H2)∶n(Phenol)为2~10的条件下,通过25组正交试验得到苯酚加氢本征动力学实验数据,建立了以理想吸附模型为基础的动力学模型,通过通用全局算法结合最大继承法得到了动力学参数估值并对动力学模型进行了检验。

