蛋白酶水解美味牛肝菌工艺优化及酶解产物的抗氧化活性
黄 典,高 雅,刘 蕾,章慧莺, ,张玉玉,陈海涛,孙宝国,曾 艳
(1.北京工商大学轻工科学技术学院,北京市食品风味化学重点实验室,北京 100048;2.国家合成生物技术创新中心,天津 300308)
美味牛肝菌(Boletus edulisBull.Fr.)又名白牛肝、大脚菇,是产量最多,最具经济价值的牛肝菌品种之一[1]。美味牛肝菌具有很高的营养价值,富含蛋白质、脂肪、多糖、氨基酸以及多种微量元素[2]。同时也具有很好的药用价值,在抗炎、抗氧化、抗疲劳、抗肿瘤以及免疫调节等方面都有重要作用[3]。目前美味牛肝菌产品形式单一,附加值低,在收购及加工过程中会产生大量残次品、菇柄及碎屑,造成极大的环境污染和资源浪费[4]。研究美味牛肝菌的精细加工对于美味牛肝菌资源的综合利用具有重要意义。
食用菌是一种高蛋白、低脂肪的优质蛋白原料,是天然生物活性蛋白和多肽的重要来源[5−11]。与动植物蛋白原料相比,食用菌蛋白酶解制备抗氧化产物的研究并没有受到太多关注[12−16]。美味牛肝菌干制样品蛋白质含量高达35%左右,可作为各类蛋白与多肽产品的原材料。目前对于美味牛肝菌抗氧化活性的研究仍主要集中在多糖、黄酮、多酚、甾体及萜类等生物活性成分[17],其蛋白水解产物抗氧化活性的相关研究尚未见报道。
本文以美味牛肝菌为原料,利用蛋白酶制备具有抗氧化活性的酶解产物。以DPPH·清除率和水解度为指标,在单因素实验的基础上采用响应面分析法优化制备工艺,并对其抗氧化性质进行测定,旨在为酶解工艺在美味牛肝菌精深加工中的应用提供理论依据,改善美味牛肝菌抗氧化产品品质,提高美味牛肝菌产品附加值。
1 材料与方法
1.1 材料与仪器
干制美味牛肝菌(蛋白质31.6 g/100 g,脂肪1.8 g/100 g,灰分7.2 g/100 g) 市售,产自云南楚雄;中性蛋白酶(15 万 U/g)、碱性蛋白酶(15 万 U/g)、风味蛋白酶(10 万 U/g) 食品级,南宁庞博生物工程有限公司;1,1-二苯基-2-苦基肼自由基(DPPH·) 梯希爱上海化成工业发展有限公司;抑制与产生超氧阴离子自由基()试剂盒、羟自由基(OH·)测定试剂盒、总抗氧化能力(T-AOC)测定试剂盒 南京建成科技有限公司;磷酸氢二钠、磷酸二氢钠、乙醇、四硼酸钠、丝氨酸、抗坏血酸 国药集团化学试剂有限公司;十二烷基硫酸钠、邻苯二甲醛、二硫苏糖醇 上海麦克林生化科技有限公司。
FDV 气引式粉碎机 佑崎机械有限公司;BSA423S 电子天平 德国Sartorius 公司;Fe20-K多功能pH 计 瑞士Mettler Toledo 公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;TGL16M 高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;DLSB-5-30 低温冷却循环泵 上海百典仪器设备有限公司;KQ3200DA 超声波清洗机 昆山市超声仪器有限公司;VORTEX3 漩涡混匀仪 德国KIA 公司;UV2600 紫外-可见分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 美味牛肝菌的酶解工艺 美味牛肝菌粉碎,过60 目筛。称取一定量美味牛肝菌粉,加入去离子水,调节pH,待混合液达到设定温度后,加入适量酶进行酶解,酶解结束后于沸水浴条件下灭酶10 min。待酶解液冷却至室温后,离心(4 ℃,10000 r/min,15 min),取上层清液备用。
1.2.2 酶种类的筛选 称取一定量美味牛肝菌粉样品于烧瓶中,加入去离子水,在酶的推荐pH(中性蛋白酶7.0,碱性蛋白酶8.0,风味蛋白酶7.5)和推荐温度50 ℃条件下进行酶解,初始酶解条件设置为加酶量5000 U/g,底物浓度5%,酶解时间90 min,酶解结束后沸水浴条件下灭酶10 min,离心,取上清液。以水解度、DPPH·清除率为评价指标,确定最佳蛋白酶种类。
1.2.3 单因素实验 称取一定量美味牛肝菌粉样品于烧瓶中,加入去离子水,选取最佳蛋白酶,调节pH 至推荐值,在酶解时间90 min、加酶量5000 U/g、酶解温度50 ℃的条件下研究底物浓度(1%、2%、3%、4%、5%、6%)对水解度和DPPH·清除率的影响;在加酶量5000 U/g、底物浓度5%、酶解温度50 ℃条件下研究酶解时间(30、60、90、120、150、180 min)对水解度和DPPH·清除率的影响;在底物浓度5%、酶解温度50 ℃、酶解时间90 min 条件下研究加酶量(2000、3000、4000、5000、6000、7000 U/g)对水解度和DPPH·清除率的影响;在底物浓度5%、加酶量3000 U/g、酶解时间90 min 条件下研究酶解温度(40、45、50、55、60、65 ℃)对水解度和DPPH·清除率的影响。
1.2.4 响应面试验 根据Box-Behnken 中心组合实验设计原理,运用Design-Expert V8.0.6.1 软件,基于单因素实验结果,采用4 因素3 水平的响应面分析法,以底物浓度(A)、酶解时间(B)、加酶量(C)、酶解温度(D)为自变量,酶解液水解度(Y1)和DPPH·清除率(Y2)为响应值,各因素三个水平采用-1、0、1 进行编码,因素水平和编码见表1[18]。

表1 Box-Behnken 实验因素水平设计Table 1 Factors and levels of Box-Benhnken design
1.2.5 水解度的测定 水解度指蛋白质中被水解的肽键占总肽键的百分比,采用OPA 法进行测定[19]:酶解液样品稀释待测,取400 μL 待测液于5 mL 试管中,加入3 mL OPA 试液,混匀,静置2 min,在340 nm 波长下测定吸光度。以丝氨酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到回归方程y=10.446x−0.0033,R2=0.9999。根据回归方程和酶解液测得的吸光度计算样品水解度,计算方法如式(1)、式(2)所示。

式中:WSerine-NH2表示每克蛋白质所含丝氨酸氨基的量,mmol/g;htot表示每克蛋白质所含的总肽键数,mmol/g;α,β分别用常数1.00、0.40 表示[20]。
1.2.6 DPPH·清除能力的测定 DPPH·清除能力的测定参照牛明福等[21]的方法进行调整:酶解液样品稀释待测,取2 mL 样品液,加入0.01 mmol/L 的DPPH·溶液2 mL,混匀,室温避光反应30 min,于517 nm 处测定吸光值A1;2 mL 无水乙醇和2 mL DPPH·溶液混匀,在517 nm 测定吸光值A2;取2 mL样品溶液,加入2 mL 无水乙醇测其吸光度A3,计算酶解液样品DPPH·清除率,计算方法如式(3)所示。
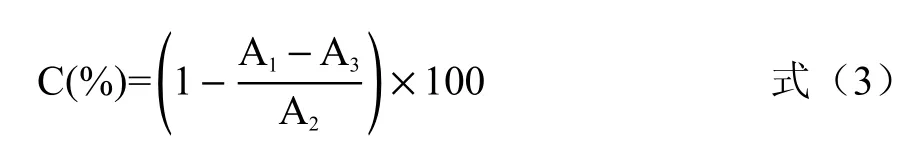
式中:C 表示DPPH·清除率,%;A1表示样品液加DPPH·测得的吸光值;A2表示无水乙醇加DPPH·测得的吸光值;A3表示样品液加无水乙醇测得的吸光值。
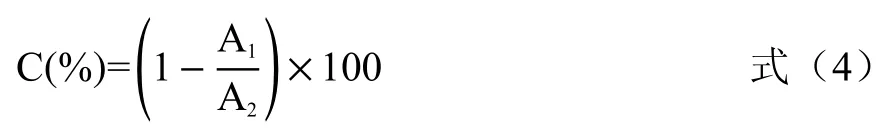
1.2.8 OH·清除能力的测定 采用OH·试剂盒测定,依据试剂盒说明书方法进行检测获得清除率。酶解液样品稀释待测,取0.2 mL 样品液,反应液加入步骤按试剂盒说明进行,于550 nm 处测定吸光值(A1);以去离子水代替样品溶液重复上述操作,测定吸光值(A2),计算酶解液样品OH·清除率,计算公式见式(5):
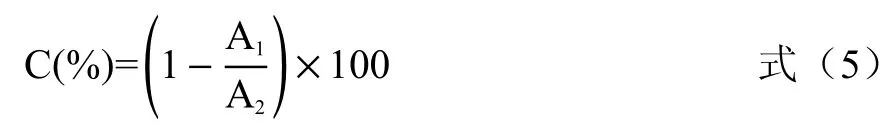
式中:C 表示OH·清除率,%;A1表示样品液加反应液测得的吸光值;A2表示以蒸馏水作为对照加反应液测得的吸光值。
1.2.9 总抗氧化能力的测定 采用总抗氧化能力(T-AOC)试剂盒测定,依据试剂盒说明书方法进行检测获得总抗氧化活力单位。酶解液样品稀释待测,取0.1 mL 样品液,反应液加入步骤按试剂盒说明进行,于520 nm 处测定样品吸光值(A1)和对照吸光值(A2),计算样品总抗氧化能力,计算公式见式(6):
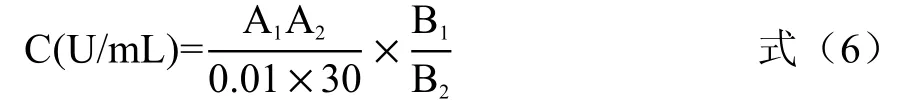
式中:C 表示总抗氧化能力单位,在37 ℃时,每分钟每mL 酶解液样品,使反应体系的吸光值每增加0.01 时,为一个总抗氧化能力单位;A1表示样品液加反应液测得的吸光值;A2表示对照组吸光值;B1表示反应液总量;B2表示样本取样量。
1.3 数据处理
所有实验数据均重复3 次,数据结果以(平均值±标准差)标示。采用Design-Expert 8.0.6、Origin 2019 软件设计和分析制图,并进行二次回归方程模拟和ANOVA 方差分析;P<0.05 为具有显著性差异。
2 结果与分析
2.1 酶种类的筛选
选择中性蛋白酶、碱性蛋白酶、风味蛋白酶对美味牛肝菌进行酶解,反应初始条件设置为底物浓度5%,酶用量5000 U/g,酶解时间90 min,酶解pH 为各蛋白酶的最适条件。以酶解产物的水解度和DPPH·清除率为指标筛选水解美味牛肝菌的最佳蛋白酶,结果如图1 所示。
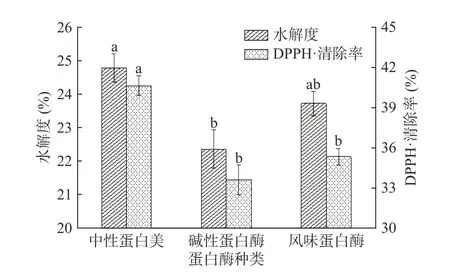
图1 蛋白酶种类对水解度和DPPH·清除率的影响Fig.1 Effects of different protease on hydrolysis degree and DPPH·scavenging rate
蛋白酶具有专一性,不同蛋白酶对同一种蛋白的酶切位点不同,因此酶解产物的水解度也不尽相同[15]。由图1 可知,三种蛋白酶酶解产物水解度存在差异,中性蛋白酶的水解度最高(P<0.05),这可能与中性蛋白酶的内切酶特性有关[22]。不同蛋白酶酶解产物含量和结构的差异导致其清除DPPH·的能力也有所区别。中性蛋白酶的DPPH·清除率最高,碱性蛋白酶和风味蛋白酶水解产物的DPPH·清除率无显著差异(P>0.05)。综合考虑酶种类对水解度和DPPH·清除率的影响,选择中性蛋白酶为最适酶进行后续酶解工艺的研究。
2.2 单因素实验结果
2.2.1 底物浓度的确定 底物浓度对美味牛肝菌酶解产物DPPH·清除率和水解度的影响如图2 所示。
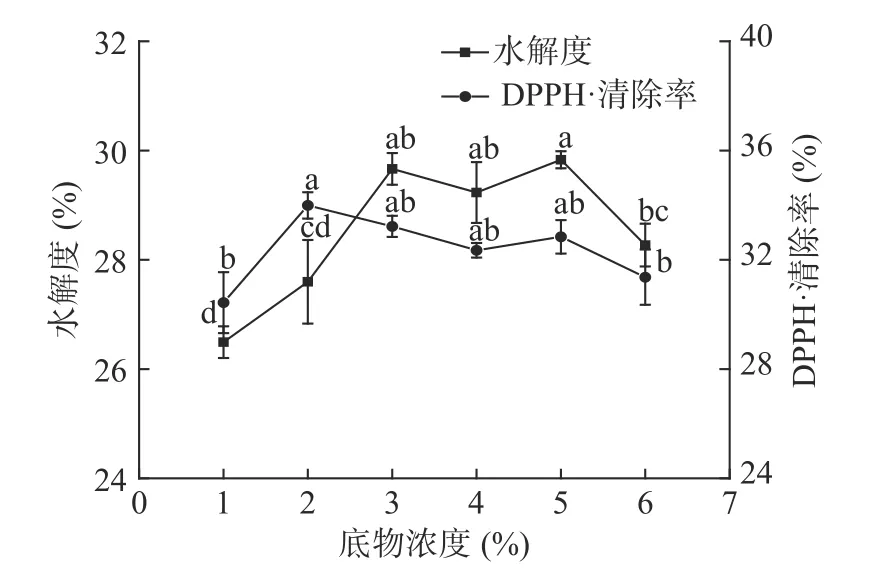
图2 底物浓度对水解度和DPPH·清除率的影响Fig.2 Effects of substrate concentration on hydrolysis degree and DPPH·scavenging rate
由图2 可知,底物浓度偏低时,水解度较低,这可能是在较低底物浓度下酶和底物的接触几率降低而造成的。随着底物浓度增大,水解度升高,底物浓度为3%~5%时,酶解产物水解度随底物浓度的增加无显著性差异。底物浓度为6%时,底物浓度太高导致酶促反应体系过于粘稠,不利于酶与底物的有效结合,影响蛋白酶活力的释放,酶解产物水解程度降低[23]。DPPH·清除率随底物浓度的增加呈先增加后减小的变化趋势,这可能是因为高浓度的肽导致功能部位受阻,并且由于相互作用导致抗氧化能力下降[24]。考虑到溶剂用量过多导致后续蒸发困难,从经济成本角度分析,综合考虑底物浓度对水解度和DPPH·清除率的影响,选择5%为最佳底物浓度。
2.2.2 酶解时间的确定 酶解时间对美味牛肝菌酶解产物DPPH·清除率和水解度的影响如图3 所示。
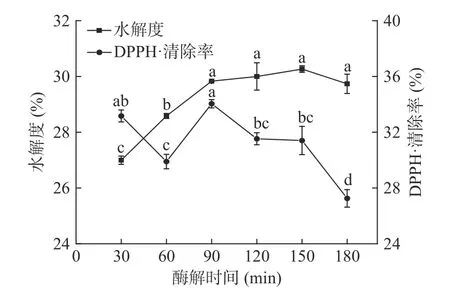
图3 酶解时间对水解度和DPPH·清除率的影响Fig.3 Effects of enzymolysis time on hydrolysis degree and DPPH·scavenging rate
由图3 可知,随着酶解时间的延长,水解度逐步升高,但在90 min 以后上升趋势不明显,可能是90 min时酶与底物已充分结合。同时,产物的累积会抑制酶的活力,随时间的延长,可酶解蛋白质与产物的浓度差逐渐降低,导致水解度变化较小。DPPH·清除率随时间变化的趋势可以看出,酶解时间短时,自由基清除能力强,可能的原因是大分子的蛋白复合物也具有一定自由基清除作用[25]。随着酶解时间的延长,DPPH·清除率呈先上升后下降的趋势,这可能是由于水解度过小时,具有抗氧化活性的肽段不能完全暴露,抗氧化性弱;水解度过大时,抗氧化肽被进一步降解为游离氨基酸,活性较低不能发挥多肽稳定自由基的作用[22]。为减少因酶解时间增加而带来的能源浪费,综合考虑酶解时间对水解度和DPPH·清除率的影响,选择90 min 为最佳酶解时间。
2.2.3 加酶量的确定 加酶量对美味牛肝菌酶解产物DPPH·清除率和水解度的影响如图4 所示。

图4 加酶量对水解度和DPPH·清除率的影响Fig.4 Effects of enzyme dosage on hydrolysis degree and DPPH·scavenging rate
由图4 可知,随着加酶量增加,水解度升高,原因可能是蛋白酶浓度的提高增大了与底物的接触面积,加快了酶促反应速度从而使水解度上升[26]。通过组间比较,发现酶添加量为3000、4000、5000 U/g 时,水解度无显著差异,这可能因为底物与酶的结合达到了饱和,不能再继续反应。酶添加量进一步增加时,底物总量不变,体系在其他因素满足的条件下,酶解液中的游离氨基态氮接近饱和,水解度变化减小。同时过高的酶添加量可能会造成蛋白酶自溶,从而使底物的水解度下降[24]。DPPH·清除率呈现先上升后下降的趋势,在加酶量3000 U/g 时,清除率最高。加酶量高于3000 U/g,酶解液的抗氧化能力减小,这可能是加酶量增大,酶和底物接触更充分,抗氧化成分被降解所致[15]。综合考虑加酶量增加产生的经济成本,以及加酶量对水解度和DPPH·清除率的影响,选择3000 U/g 为最优加酶量。
2.2.4 酶解温度的确定 酶解温度对美味牛肝菌酶解产物的DPPH·清除率和水解度的影响如图5 所示。
酶解温度对美味牛肝菌酶解产物的DPPH·清除率和水解度的影响如图5 所示。温度对酶的催化反应有很大影响,酶的最高催化活性只能维持在一定的温度范围内。由图5 可知,随着温度升高,水解度和DPPH·清除率均呈先升高后降低的变化趋势,温度超过45 ℃时,水解度和DPPH·清除率降低。酶在最适温度范围内,升高温度有利于酶促反应的进行,水解度增大。当温度高于最适温度时,酶稳定性降低,催化活性减弱,反应被抑制[27]。除影响酶解产物的水解程度以外,过高的温度也有可能影响多肽的抗氧化活性。综合考虑酶解温度对水解度和DPPH·清除率的影响,选择45 ℃为最佳酶解温度。
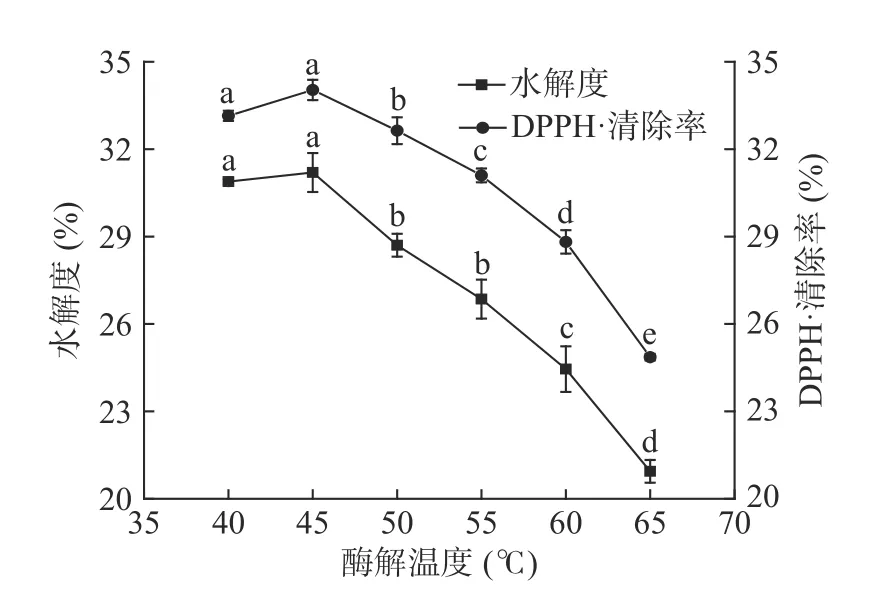
图5 酶解温度对水解度和DPPH·清除率的影响Fig.5 Effects of enzymolysis temperature on hydrolysis degree and DPPH·scavenging rate
2.3 响应面分析
2.3.1 响应面结果 为进一步研究变量之间交互作用的影响关系,使用响应面分析法筛选最佳酶解工艺。根据单因素实验结果,基于Box-Behnken 采样原理,选取底物浓度(A)、酶解时间(B)、加酶量(C)、酶解温度(D)4 个因素为自变量,以酶解产物的酶解液水解度(Y1)和DPPH·清除率(Y2)为响应值,进行4 因素3 水平的响应面分析实验。实验结果见表2。
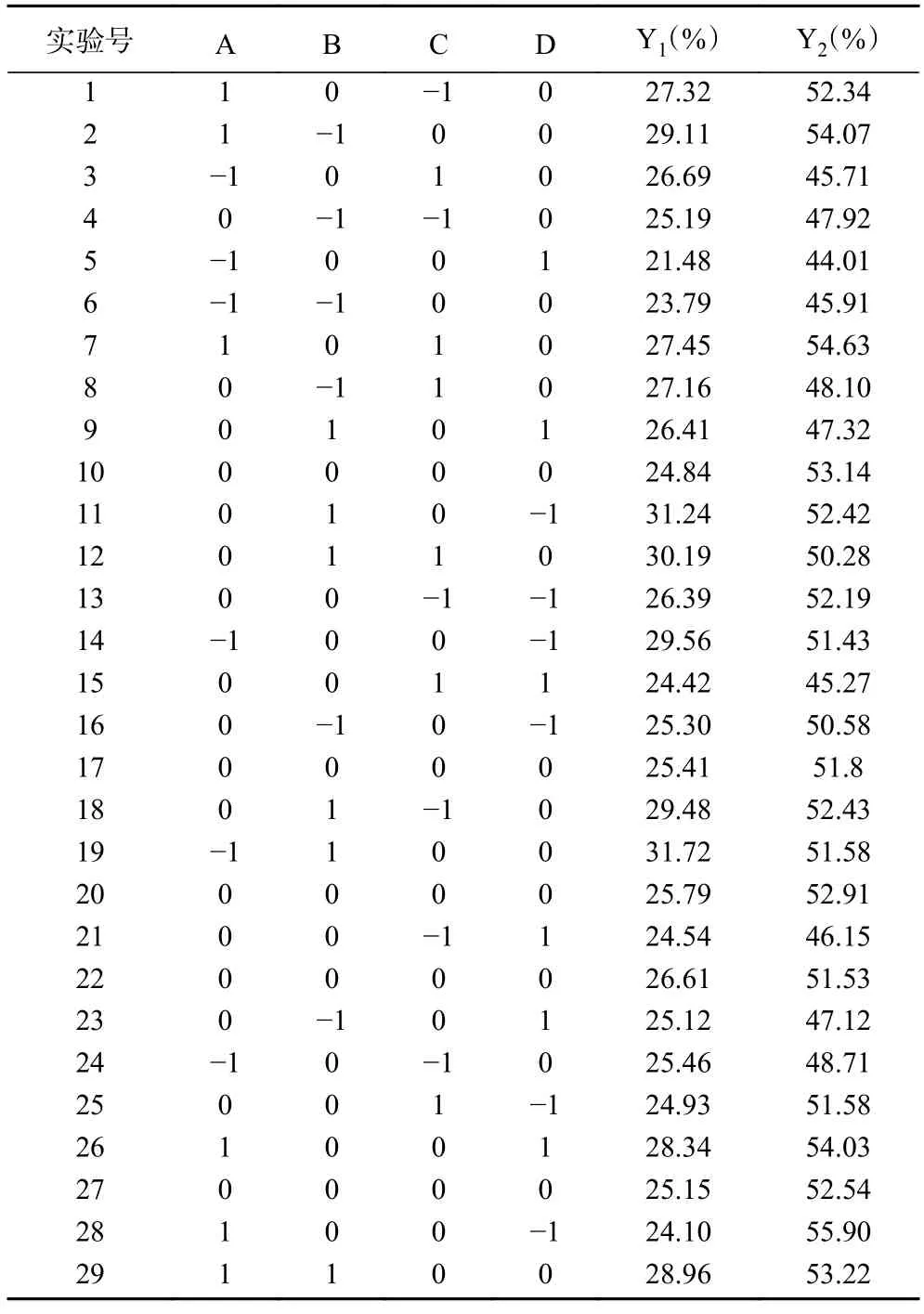
表2 响应面试验设计与结果Table 2 Response surface design and experimental results
运用Design-Expert 10.0.3 软件对实验数据进行分析并进行多元回归拟合,得到二次多项回归方程:

对回归方程进行方差分析如表3 和表4 所示。从表3 可以看出,模型的决定系数R2为0.9653,说明模型具有较高显著性,同时R2adj=0.9306,能够解释实验93.06%的响应值变异,说明此实验模型与真实数据拟合程度良好。工艺条件对水解度影响大小顺序为:酶解时间>酶解温度>底物浓度>加酶量。二次项中底物浓度和酶解时间对水解度的曲面效应极显著(P<0.01),在相互作用中,AB、AD、BD 表现为极显著(P<0.01)。由表4 可知,模型的决定系数R2为0.9593,模型具有高显著性。工艺条件对DPPH·清除率的影响大小顺序为底物浓度>酶解温度>酶解时间>加酶量,二次项中酶解时间、加酶量和酶解温度对DPPH·清除率的曲面效应极显著(P<0.01),在相互作用中,AB、AD 表现为极显著(P<0.01)。综上所述,可以用该模型分析和预测美味牛肝菌蛋白酶水解产物的水解度和DPPH·清除率,预测模型具有实践指导意义。
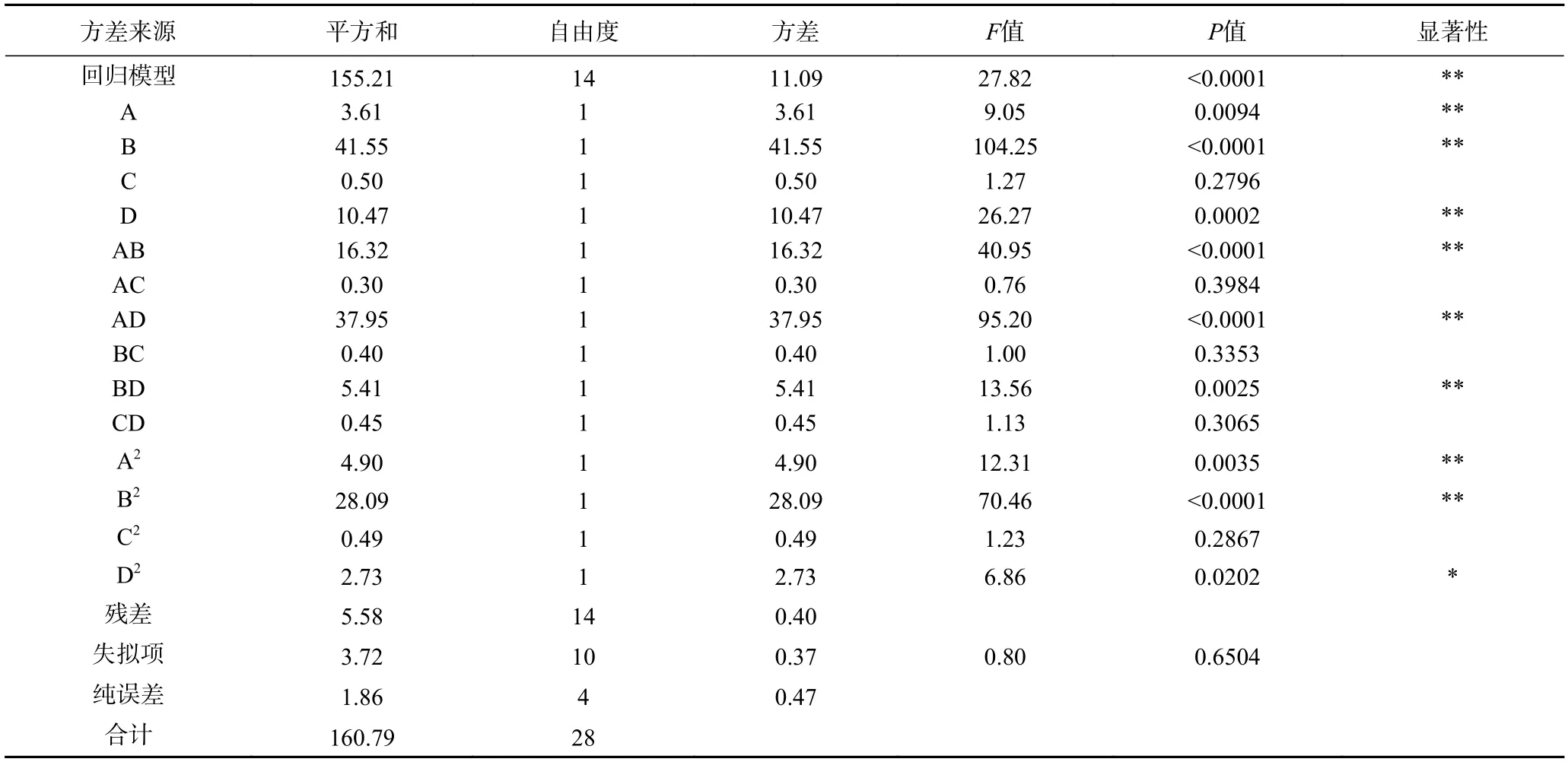
表3 响应水解度拟合回归方程的方差分析结果Table 3 Variance analysis for the fitted regression model of hydrolysis degree
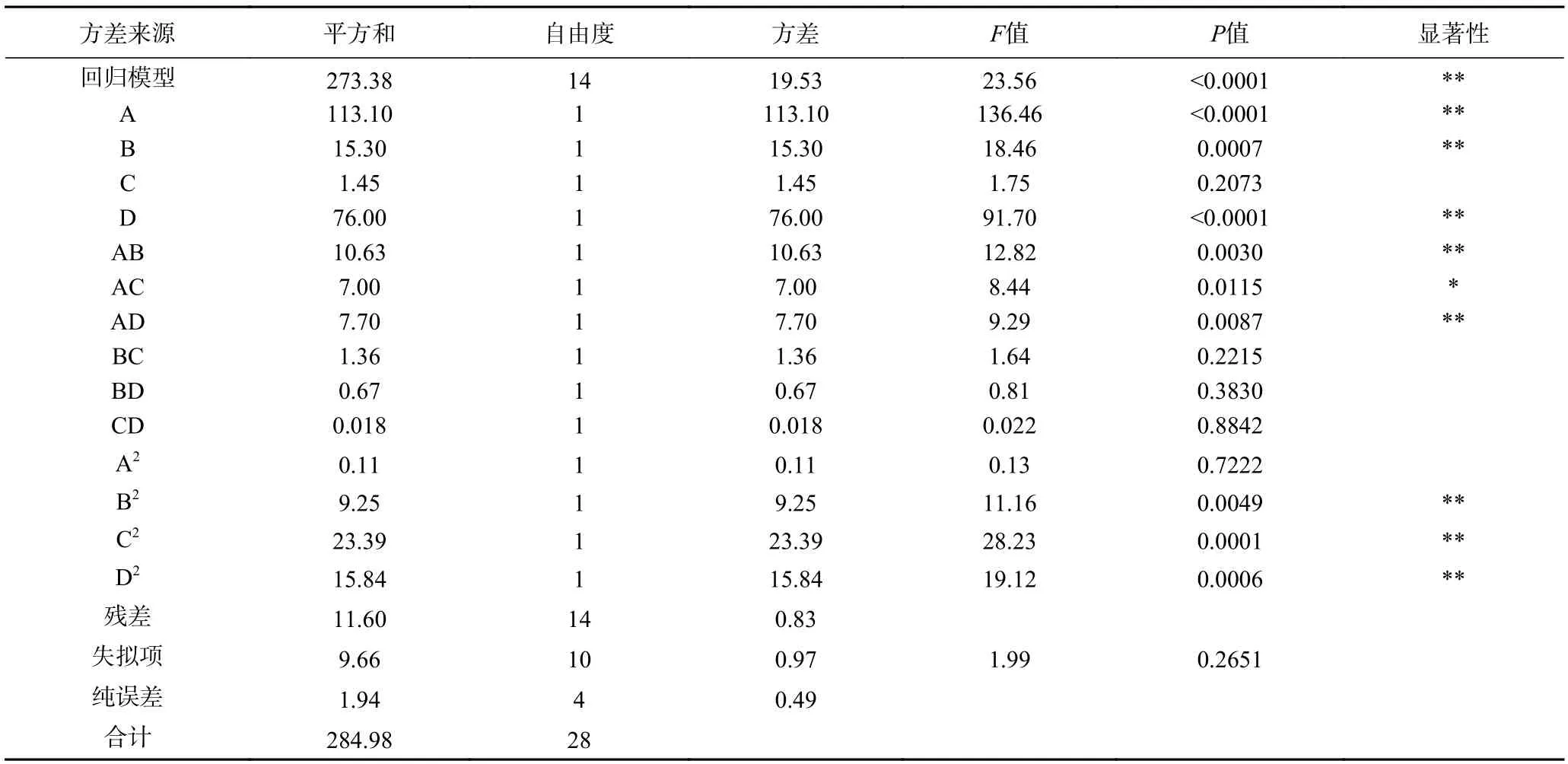
表4 响应DPPH·清除率拟合回归方程的方差分析结果Table 4 Variance analysis for the fitted regression model of DPPH·scavenging rate
2.3.2 响应面的交互作用分析 各因素之间交互作用对水解度的影响可通过图6 所展示的响应面三维图反映。响应面曲面坡度越陡峭,表示二者交互作用越显著[28−29]。由图6 可知,底物浓度-酶解时间、底物浓度-酶解温度、酶解时间-酶解温度交互作用对水解度的影响较为显著。底物浓度-酶解时间交互作用中,酶解时间较底物浓度引起响应曲面更大幅度的波动,对水解度的影响更加显著(图6A)。图6C 所示的底物浓度-酶解温度交互作用引起响应曲面较大幅度变化,表明二者交互作用对水解度影响极显著。由图6E 可知,增加酶解时间同时降低酶解温度有利于提高产物水解度。
不同工艺条件交互作用对DPPH·清除率的影响如图7 所示。底物浓度-酶解时间交互作用对DPPH·清除率的影响结果表明,DPPH·清除率随底物浓度的增加而增加,而酶解时间则引起自由基清除率先增加后降低的波动趋势,其中底物浓度在交互作用中的贡献更大(图7A)。与图7A 影响规律类似,图7B 所示的底物浓度-加酶量交互作用对DPPH·清除率的影响表现为自由基清除率与底物浓度呈正相关关系,而加酶量过大或过小都不利于提高DPPH·清除率。图7C 所示的底物浓度-酶解温度交互作用引起响应曲面较大幅度变化,二者交互作用对DPPH·清除率影响极显著。
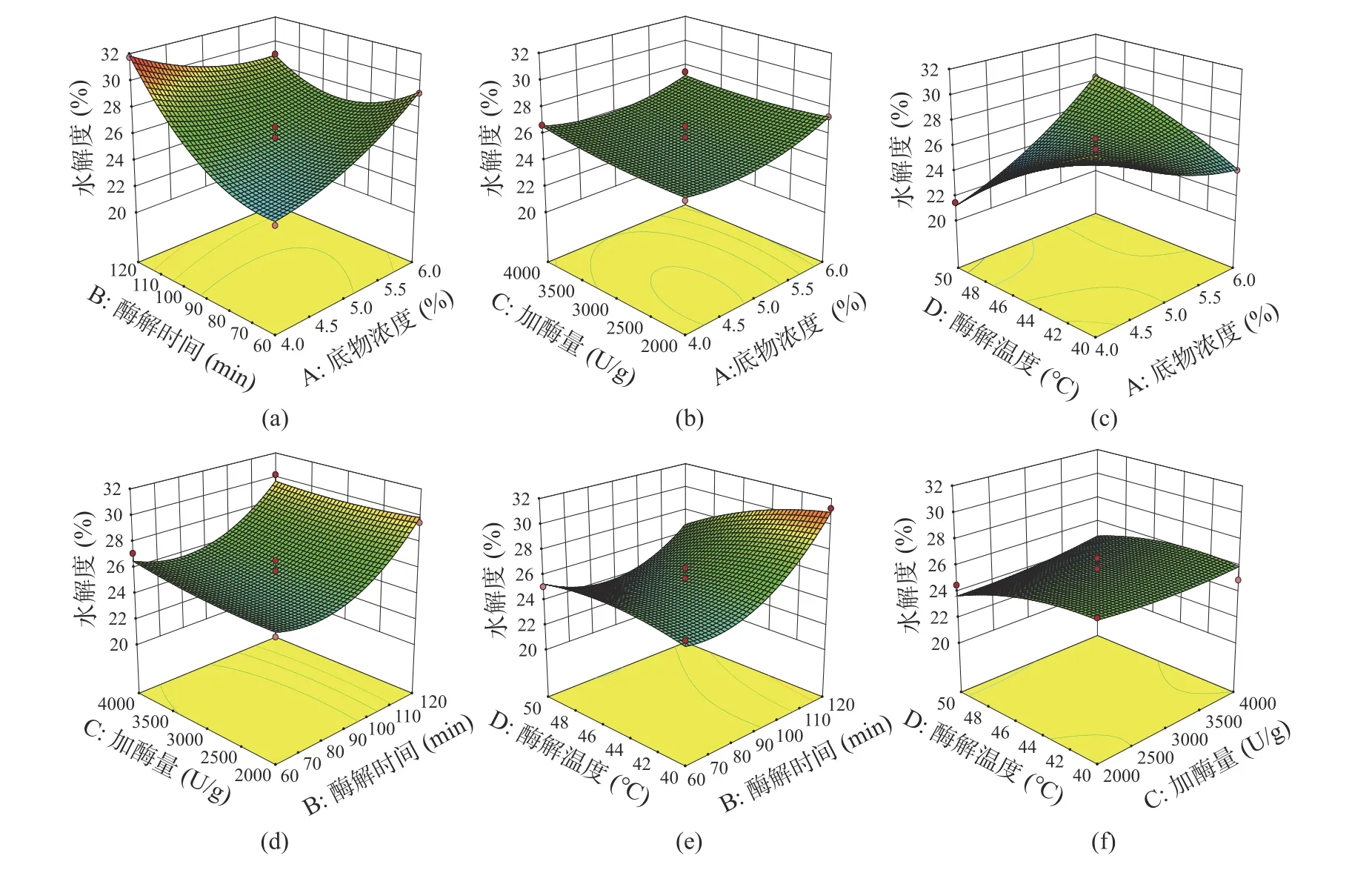
图6 各因素交互作用对水解度影响的响应面图Fig.6 Surface response plot of the interaction of various factors on hydrolysis degree
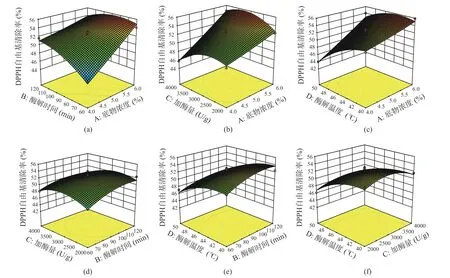
图7 各因素交互作用对DPPH·清除率影响的响应面图Fig.7 Surface response plot of the interaction of various factors on DPPH·scavenging rate
2.3.3 最优工艺条件实验验证 为协同考虑各因素之间的交互作用对水解度、DPPH·清除率的影响,进一步确定全局最优解,根据Design-Expert 10.0.3 软件运行结果,水解度和DPPH·清除率在底物浓度、酶解时间、加酶量、酶解温度等因素共同影响下的最优提取工艺为:底物浓度4%、酶解时间120 min、加酶量2423 U/g、酶解温度40℃,在此条件下模型预测的水解度为36.56%,DPPH·清除率为54.39%。
根据模型预测结果,结合实际工艺设置的可行性,取底物浓度4%、酶解时间120 min、加酶量2500 U/g、酶解温度40℃为条件进行三次重复实验,得平均水解度为34.12%±0.68%、平均DPPH·清除率为55.91%±1.21%,与模型预测结果接近,表明基于该响应面模型分析优化水解度和DPPH·清除率的酶解工艺有效可行。
2.4 美味牛肝菌酶解产物的抗氧化性质研究
2.4.1 对DPPH·清除能力的测定 以抗坏血酸为对照,美味牛肝菌酶解产物清除DPPH·的结果如图8所示。由图8 可知,在一定浓度范围内,酶解产物和抗坏血酸对DPPH·的清除率均随浓度的增加而增强。酶解产物浓度超过一定范围后,其自由基清除能力逐渐趋于平缓。根据线性回归方程计算,美味牛肝菌酶解产物清除DPPH·的IC50值为0.88 mg/mL,抗坏血酸清除DPPH·的IC50值为3.63 μg/mL,酶解产物对于DPPH·的清除能力低于抗坏血酸的清除能力,但一般认为抗氧化剂清除DPPH·的IC50值低于10 mg/mL 时,即具有较好的抗氧化性[30]。
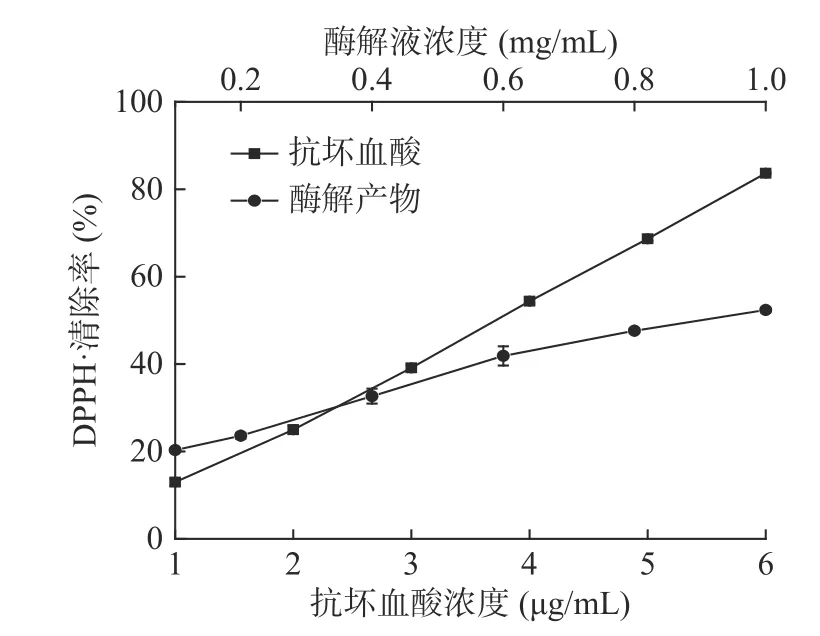
图8 酶解液对DPPH·的清除能力Fig.8 DPPH·scavenging activity of enzymatic hydrolysate
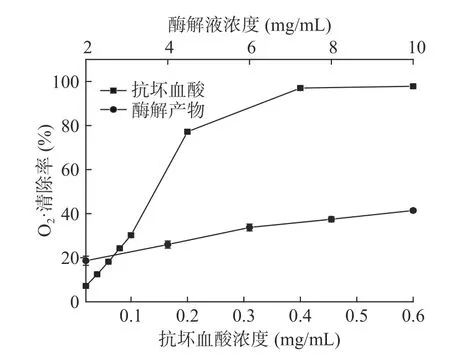
图9 酶解液对的清除能力Fig.9 scavenging activity of enzymatic hydrolysate
2.4.3 对OH·清除能力的测定 以抗坏血酸为对照,美味牛肝菌酶解产物清除OH·的结果如图10 所示。由图10 可知,在测定的酶解液浓度范围内,随浓度的增加,OH·的清除率也逐渐增加,与抗坏血酸对OH·的清除趋势一致。经拟合曲线得到酶解液清除OH·的IC50值为0.24 mg/mL,抗坏血酸清除OH·的IC50值为0.37 mg/mL。由此可看出,在本实验研究的酶解条件下得到的美味牛肝菌酶解液具有很好的OH·清除能力。
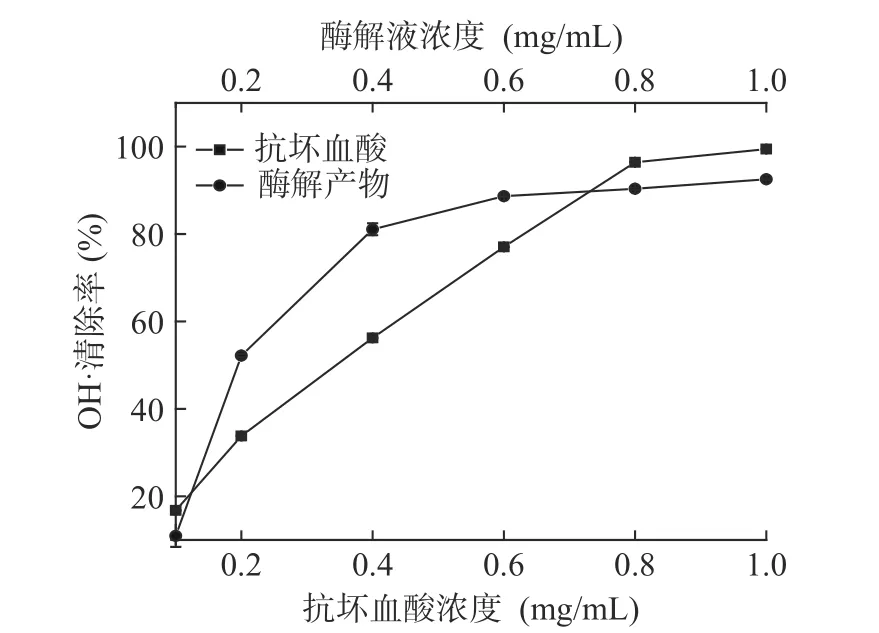
图10 酶解液对OH·的清除能力Fig.10 OH· scavenging activity of enzymatic hydrolysate
2.4.4 总抗氧化能力的测定 以抗坏血酸为对照,美味牛肝菌酶解产物总抗氧化能力测定结果如图11所示。由图11 可知,在测定浓度范围内,随浓度的增加,总抗氧化能力呈增加趋势。在最优酶解工艺条件下,制得的酶解液总抗氧化能力为18.82 U/mL,低于同浓度抗坏血酸溶液的抗氧化能力。
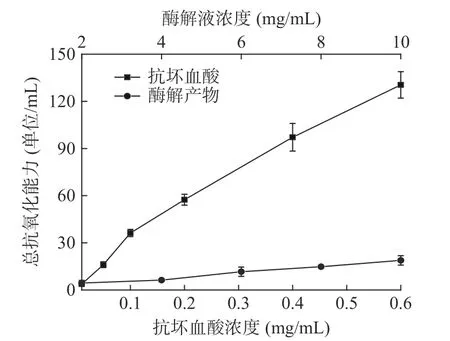
图11 酶解液总抗氧化能力Fig.11 Total antioxidant capacity of enzymatic hydrolysate
3 结论
使用蛋白酶对美味牛肝菌进行酶解,以水解度和DPPH·清除率为评价指标,在单因素实验基础上进行响应面试验,得出适宜美味牛肝菌水解的蛋白酶为中性蛋白酶,最佳酶解工艺条件为底物浓度4%,酶解时间120 min,加酶量2500 U/g,温度40 ℃,此条件下所得美味牛肝菌蛋白水解度为34.12%,DPPH·清除率为55.91%。
酶解工艺可显著提高美味牛肝菌的抗氧化能力。酶解产物清除DPPH·、OH·、三种自由基的IC50值分别为0.88、0.24、12.50 mg/mL,总抗氧化能力为18.82 U/mL,可用于功能食品的开发。研究仅对酶解液的抗氧化活性进行了初步探讨,后续可进一步分离、纯化和鉴定分子质量不同的肽段,探究其结构及体内体外抗氧化活性。

