超声波辅助提取与电渗析脱盐耦合技术对绿茶茶汤理化性质的影响
陈金定,高雅馨,高彦祥
(中国农业大学食品科学与营养工程学院,中国轻工业健康饮品重点实验室,北京 100083)
茶文化在我国具有悠久的历史,是我国的传统文化之一。随着人们生活节奏的加快及生活方式的改变,对于“茶文化”的需求逐渐从现饮现泡向更加便捷的茶饮料方向发展。茶饮料不仅具有解渴的功能,同时还富含多种生物活性成分,如茶多酚、茶氨酸、儿茶素等,具有多种营养和保健功能[1−2]。作为一种绿色健康的饮料,茶饮料受到众多消费者的青睐,近年来在我国迅速发展,已成为饮料行业的三大品类之一[3]。
然而,茶饮料在加工、运输、贮藏及销售过程中,成分极易发生变化,影响茶饮料的品质[4−5],尤其以茶饮料的加工过程中茶汤的提取方式对其品质的影响最为显著,因为提取是茶饮料加工的重要工序之一,提取技术的好坏直接影响后续的茶饮料加工品质[6]。目前绿茶提取方法主要有传统热水提取法、溶剂提取法、超临界流体萃取法、微波萃取法、酶法提取和超声波提取法等。超声波提取法利用超声波的机械粉碎和空化作用产生的冲击波和剪切力促使细胞破碎,提高茶汤中有效成分的溶出速度和数量,以达到提高提取效率的目的[7−8]。研究表明,采用超声辅助提取的绿茶茶汤中,茶多酚、咖啡碱、茶氨酸等活性成分含量均显著高于传统热水提取法[9−10]。
此外,茶饮料加工贮藏过程中极易出现褐变、营养成分降解及沉淀等问题,尤其以绿茶饮料的浑浊、沉淀问题较为突出,是制约茶饮料加工的重要因素之一。研究表明,茶饮料在加工贮藏过程中,沉淀的形成主要与茶饮料中的蛋白质、多酚、咖啡碱、游离氨基酸、糖类、脂类物质、有机酸以及金属离子等有关[11−14]。有研究指出,茶饮料中金属离子含量不高,但也是参与茶饮料沉淀的主要组成成分[15],Xu 等研究发现,绿茶浓缩液在4 ℃条件下贮藏过程中,形成的不可逆沉淀中含有大量的金属离子[11],郭爱秀等人发现Ca2+参与沉淀形成的机率最高[16],而郭炳莹等人认为茶汤中的氨基酸、咖啡碱等本身并不能与Ca2+生成沉淀,而是因为与茶多酚—钙络合物的吸附引起的共沉淀效应被带入钙络合沉淀中[17]。
电渗析技术是利用离子交换膜的选择透过性,在外加直流电场的作用下使阴阳离子定向迁移实现脱盐目的[18]。电渗析技术广泛应用于食品、化工、废水处理等行业[18−19],在食品行业中应用于菊糖[20]、竹笋[21]、芦笋[22]、酱油[23]等加工过程,但在茶饮料生产中的应用鲜有报道,仅检索到1997 年张正竹等采用自制Al2O3非对称滤膜对红茶提取液进行电渗析处理的研究报道[24]。将电渗析技术应用于茶汤的加工过程中,能够脱除茶汤中金属离子,减少其与茶汤中蛋白质、茶多酚等成分发生络合形成沉淀的机率,从而减少茶汤“冷后浑”的产生。
本文对不同超声功率辅助热水提取及传统热水提取的绿茶茶汤理化性质进行对比,研究超声辅助热水提取绿茶茶汤的理化指标变化规律,同时将所提取的茶汤进行电渗析处理,测定电渗析前后绿茶茶汤的浊度、电导率、茶多酚含量、咖啡碱含量及金属离子脱除率等指标,探究电渗析对绿茶茶汤品质影响及“冷后浑”的抑制效果,以期为茶饮料的生产加工提供新的理论依据。
1 材料与方法
1.1 材料与仪器
绿茶茶叶 编号GT126,购于杭州浙大百川生物食品技术有限公司;酒石酸钾钠、磷酸氢二钠、磷酸二氢钾、碳酸氢钠、碱式乙酸铅、盐酸、硫酸 分析纯,国药集团化学试剂有限公司;咖啡碱标准品 99%纯度,美国Sigma 公司;所有茶汤提取过程中用水为纯净水,理化指标测试过程中用水为去离子水。
UV-1800 紫外分光光度计 日本岛津;2100N型浊度仪 美国哈希公司;Abbemat 500 折光仪 安东帕;NH300 色差仪 深圳市三恩时科技有限公司;DL-5-B 低速离心机 上海安亭科学仪器厂;DHJF-2005 低温恒温搅拌反应浴 郑州长城科工贸有限公司;TGCXZ-2B 超声循环提取机 北京弘祥隆生物技术股份有限公司;FE20K 型pH 计 瑞士梅特勒一托利多公司;DDS-3-7A 电导率仪 上海仪电科学仪器股份有限公司;EX-3BT 台式电渗析装置、均相膜(AS-TOM-CGU 阳膜、ASTOM-AGU 阴膜) 杭州蓝然环境技术股份有限公司。
1.2 实验方法
1.2.1 绿茶茶汤制备及取样 超声辅助热水提取:取茶叶50 g,按茶水比1:19 添加纯净水,设定所需超声功率(130、260、390、520 W),搅拌加热浸提70 min,温度75 ℃,过双层纱布除去茶渣,趁热在5000 r/min 条件下离心30 min,离心后上清液过1500目滤布,得到绿茶茶汤;超声功率为0 W 时制备的茶汤即为传统热水提取的绿茶茶汤。
茶叶提取过程中每隔5 min 取样2 mL,静置5 min 后,取上层清液,测定可溶性固形物含量,提取结束后,测定茶汤的浊度、电导率、色差、茶多酚含量、咖啡碱含量指标。
1.2.2 绿茶茶汤电渗析处理 取热水提取或超声辅助热水提取的绿茶茶汤,置于电渗析装置的淡水室中进行电渗析处理,浓水室为0.5% NaCl 溶液,电极液为3%Na2SO4溶液,设定电压15 V,电流1.5 A,定时监测茶汤电导率变化,电导率无明显降低时为电渗析终点时间,电渗析结束后,用碳酸氢钠调整pH 至初始值,电渗析前后测定茶汤的浊度、茶多酚含量、咖啡碱含量及金属离子含量。
1.2.3 茶汤冷却处理 取电渗析处理前后的绿茶茶汤样品,置于4 ℃冰箱冷藏18 h,冷却前后测定其浊度,冷藏18 h 后离心,并测定离心沉淀率,同时将上清液重新置于4 ℃进行二次冷却,冷藏18 h,二次冷却结束后测定其浊度。
1.2.4 指标测定 可溶性固形物含量的检测采用折光仪检测[25];浊度采用2100N 型浊度仪测定;电导率采用电导率仪测定。
色差测定[26]:采用3nh NH300 色差仪测定每个样品的色差L*、a*、b*值,其中L*值代表亮度;a*值代表红绿色度,正值表示红色程度,负值表示绿色程度;b*值代表黄蓝色度,正值表示黄色程度,负值表示蓝色程度。
茶多酚含量测定采用酒石酸亚铁比色法,参考GB/T 21733-2008[27]。
咖啡碱含量测定采用紫外分光光度法,参考GB/T 8312-2013[28]。
茶多酚及咖啡碱损失率计算公式如下:
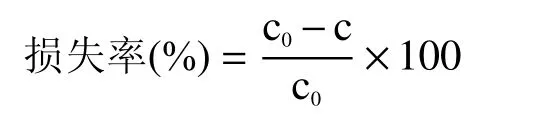
式中:c0为电渗析处理前茶汤中茶多酚/咖啡碱含量,mg/kg;c 为电渗析处理后茶汤中茶多酚/咖啡碱含量,mg/kg。
金属离子(钙、铜、铁、钾、镁、锰、钠、锌)测定采用电感耦合等离子体发射光谱法(ICP-OES),参考GB5009.268-2016[29]。
离心沉淀率测定[30]:准确称取茶汤样品,在4500 r/min 条件下离心30 min,倒出上清液后,测定沉淀重量,计算离心沉淀率,计算公式如下:
式中:m0为离心后沉淀重量,g;m 为离心前茶汤样品重量,g。
1.3 数据处理
每个样品均设3 次重复,采用SPSS 19.0 软件进行方差分析,处理间平均数的比较用最小显著差数法,由字母 a、b、c、d、e、f 或A、B、C、D、E、F 表示,相同字母表示无显著性差异,不同字母表示具有显著性差异(P<0.05)。图形绘制采用Origin9.1 绘图软件。
2 结果与分析
2.1 热水提取及不同超声功率辅助热水提取对绿茶茶汤理化性质影响
2.1.1 热水提取及不同超声功率辅助热水提取对绿茶茶汤物理指标影响 提取过程中茶汤可溶性固形物含量变化结果如图1 所示。热水提取及不同超声功率辅助提取过程中,随着提取时间延长,绿茶茶汤可溶性固形物含量增加趋势基本一致,均为先快速增加后趋于平稳。热水提取45 min 时,绿茶茶汤可溶性固形物含量增加趋于平稳,可溶性固形物含量为1.636oBrix,提取时间增加至70 min 时,绿茶茶汤可溶性固形物含量增加了1.20%;超声辅助提取绿茶茶汤过程中,提取50 min 时,茶汤可溶性固形物含量增加趋于平稳,接近最大值,50~70 min 时,茶汤可溶性固形物含量变化不显著,说明当提取时间达到45~50 min 时,绿茶中有效成分达到最大提取率。
在相同提取时间,超声辅助提取的茶汤可溶性固形物含量显著(P<0.05)高于热水提取,且随着超声功率的增加,绿茶茶汤的可溶性固形物含量逐渐增加,这是由于超声波与媒质产生相互作用,产生热作用、机械作用和空穴作用,在一定程度上破坏细胞壁结构,加速细胞内物质的溶出[30−31],故超声辅助提取绿茶茶汤的可溶性固形物含量明显高于热水提取的茶汤。超声提取功率增加至390 W 时,绿茶茶汤可溶性固形物达到最大值1.886oBrix,功率增加至最大值520 W 时,可溶性固形物含量较390 W 时无显著增加,但均显著(P<0.05)高于其它超声功率(130 和260 W)提取的茶汤,表明超声提取功率为390 W时,已达到最大提取率。
热水提取及不同超声功率辅助提取的绿茶茶汤浊度、电导率及色差变化,结果如图2 及图3 所示。超声辅助提取的绿茶茶汤浊度显著(P<0.05)高于热水提取,且随着超声功率的升高,茶汤的浊度逐渐增加,超声功率升高至390 W 时,茶汤浊度增加至最大值101 NTU,这可能是由于超声提取时,茶叶中物质大量溶出,造成茶汤的浊度升高,且物质溶出量达到上限后维持平稳,所以当超声功率增加至520 W 时,浊度不再增加[32];不同超声功率提取的绿茶茶汤电导率无显著差异,但均显著(P<0.05)高于热水提取的茶汤电导率,可能是由于超声提取过程中空化作用及机械振动、化学效应等导致处于螯合状态的金属离子解离成游离状态,导致电导率增加,游离状态的金属离子越多,更加有利于其在电渗析过程中脱除效果。
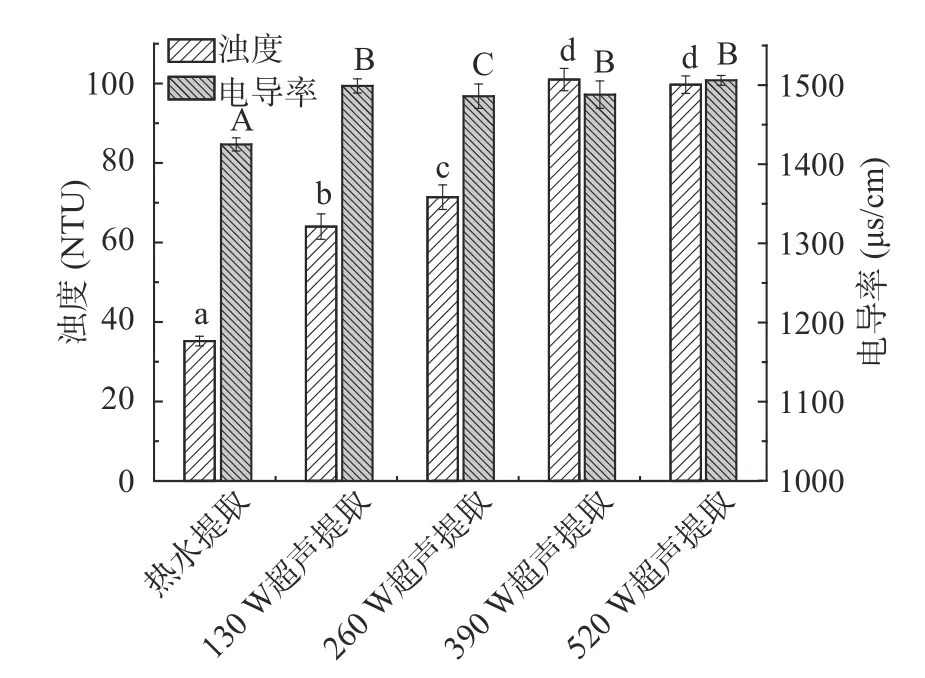
图2 不同方法提取的绿茶茶汤浊度及电导率Fig.2 Turbidity and conductivity of green tea infusion extracted by different methods
由图3 可以看出,超声辅助提取的绿茶茶汤色泽与热水提取的茶汤色泽有显著差异,亮度L*值显著(P<0.05)降低,且随着超声功率的升高逐渐降低;超声辅助提取绿茶茶汤红度a*值较热水提取绿茶茶汤显著(P<0.05)升高,且随超声功率增加逐渐升高;超声辅助提取绿茶茶汤黄度b*值较热水提取绿茶茶汤显著(P<0.05)升高,不同超声功率提取茶汤b*值无显著差异,可能是由于超声波对细胞的破坏作用导致茶叶中色素物质大量溶出[33],加深绿茶茶汤的色泽,影响绿茶茶汤的色度,故超声辅助提取的绿茶茶汤色泽较热水提取的茶汤色泽更深。孙杨研究结果发现,与水提取所得绿茶提取液相比,超声波辅助水提取得到的绿茶提取液亮度L*值显著降低,红度a*及黄度b*值均显著增加[34],与本研究结果一致。
2.1.2 热水提取及不同超声功率辅助热水提取对绿茶茶汤中茶多酚及咖啡碱含量影响 热水提取及不同超声功率提取茶汤中茶多酚及咖啡碱含量如图4所示。热水提取及不同超声功率辅助热水提取的绿茶茶汤中茶多酚与咖啡碱含量变化趋势一致,均为超声辅助热水提取显著(P<0.05)高于热水提取,且随着超声功率提高逐渐增加,超声功率增加至390 W 时,茶多酚及咖啡碱含量均达到最大值,分别为5903.14、1091.87 mg/kg,这是由于超声空化效应和机械作用增加细胞的通透性,促使茶多酚及咖啡碱加速向外扩散,提高提取效率。
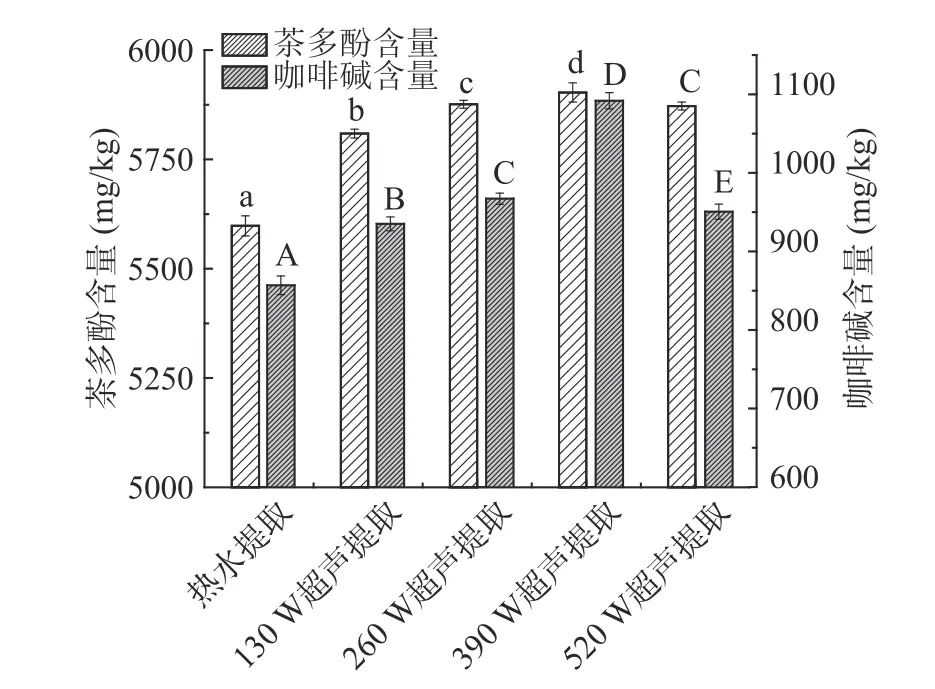
图4 不同方法提取的绿茶茶汤中茶多酚及咖啡碱含量Fig.4 Catechin and caffeine contents of green tea infusions extracted by different methods
超声功率增加至520 W 时,茶汤中的茶多酚及咖啡碱含量均出现降低趋势,分别降低至5872.32、954.57 mg/kg,这是由于当超声功率过高时,会导致茶多酚及咖啡碱的结构被破坏,或功率过高使超声场中原料产生局部升温现象,过高温度导致茶多酚及咖啡碱氧化分解[34−35]。陈云采用超声波辅助提取碧螺春中茶多酚的研究发现,超声功率在250~350 W 之间,茶多酚的提取率随超声功率的提高而增加,但随着超声功率继续增加,茶多酚提取率反而降低[36];贾育秀等采用超声波法提取凌云白毫茶中的咖啡碱,结果表明,超声波功率在40~200 W范围时,咖啡碱提取量随着功率升高而增加,但是功率升高至一定值,咖啡碱因降解使其含量反而降低[37],均与本研究结果一致。
2.2 电渗析处理对热水提取及不同超声功率辅助热水提取绿茶理化性质影响
2.2.1 电渗析处理前后绿茶茶汤浊度及电导率变化 将热水提取及不同超声功率提取的绿茶茶汤进行电渗析处理,经电渗析处理前后的电导率和浊度变化如表1 及图5 所示。
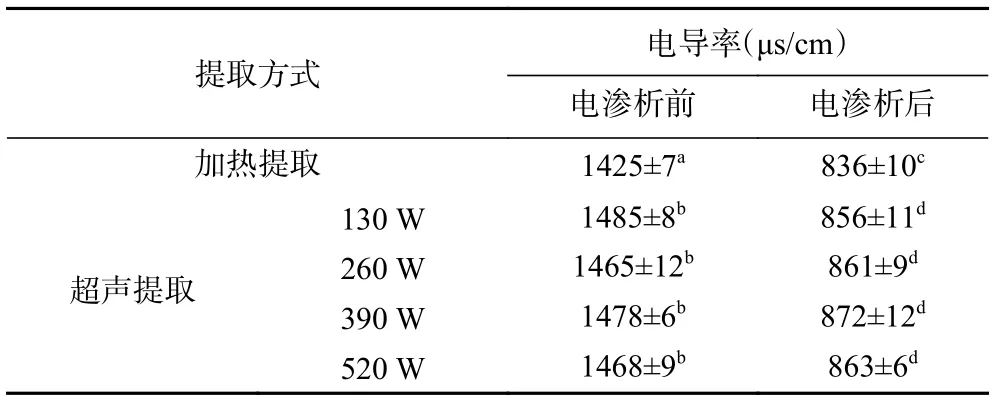
表1 热水提取及不同超声功率提取的绿茶茶汤电渗析处理前后电导率变化Table 1 Conductivity change of green tea infusions extracted by hot water and ultrasonic-assisted extraction after electrodialysis treatment
由表1 及图5 可以看出,经电渗析处理后,所有绿茶茶汤电导率与浊度均呈下降趋势,且经电渗析处理后,不同超声功率提取的绿茶茶汤的电导率无显著差异。电渗析处理过程中,由于外加电场的作用,使阴阳离子定向迁徙,从而达到脱除金属离子的目的,故电渗析处理后,茶汤电导率均出现显著降低。
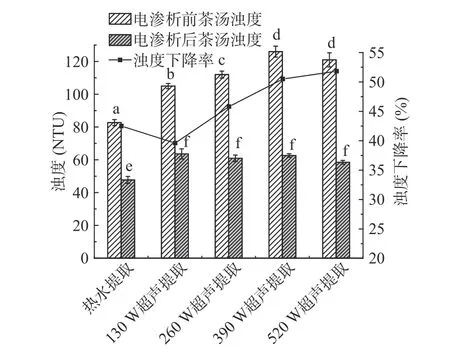
图5 热水提取及不同超声功率提取的绿茶茶汤电渗析前后浊度变化Fig.5 Turbidity change of green tea infusions extracted by hot water and ultrasonic-assisted extraction after electrodialysis treatment
由于超声辅助提取的绿茶茶汤浊度高于热水提取的样品,电渗析处理后,超声辅助提取的绿茶茶汤浊度依然显著(P>0.05)高于热水提取,不同超声功率之间无显著差异。经电渗析处理后,不同提取方式(热水提取、130、260、390、520 W 超声辅助提取)的茶汤浊度下降率分别为42.32%、39.43%、45.63%、50.32%、51.65%,由此可见,电渗析处理对超声辅助提取的茶汤澄清度提高效果更明显,说明电渗析处理过程对绿茶茶汤中产生浑浊的成分具有一定的脱除效果。
2.2.2 电渗析处理前后绿茶茶汤中茶多酚及咖啡碱含量变化 将热水提取及不同超声功率提取的绿茶茶汤进行电渗析处理,检测电渗析处理前后茶汤中茶多酚及咖啡碱含量的变化,并计算电渗析处理过程中茶多酚及咖啡碱的损失率,结果如图6 和图7 所示。
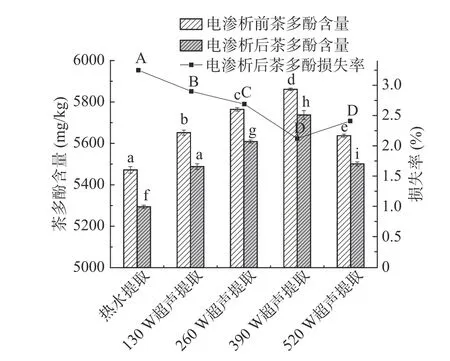
图6 热水提取及不同超声功率提取的绿茶茶汤电渗析前后茶多酚含量变化Fig.6 Catechin content change of green tea infusions extracted by hot water and ultrasonic-assisted water after electrodialysis treatment
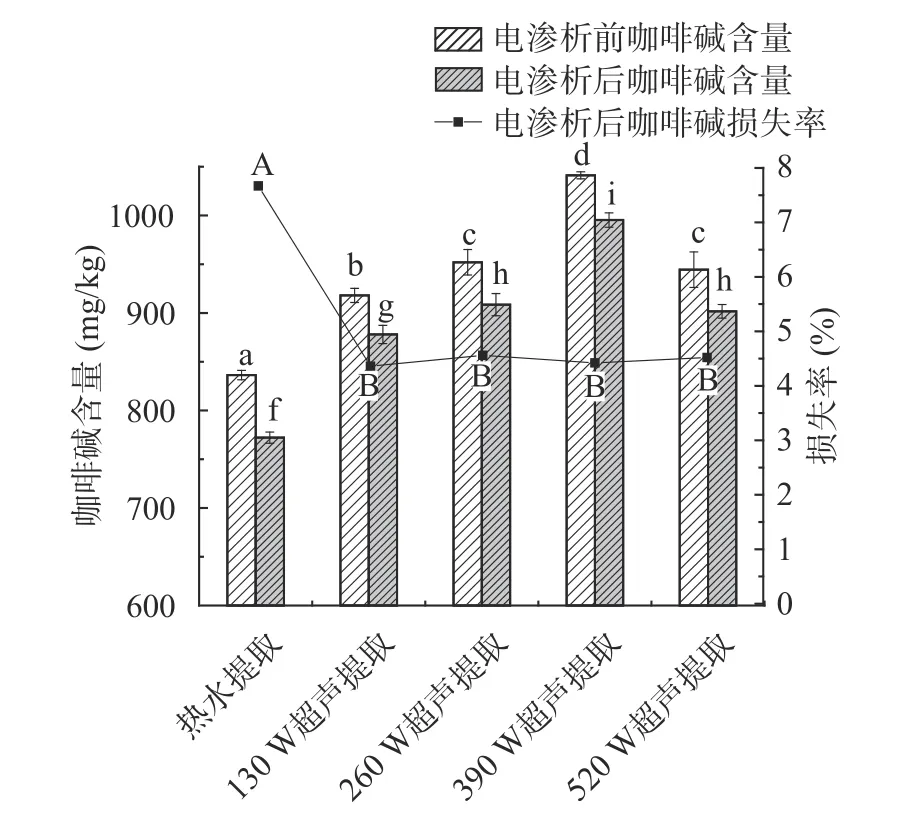
图7 热水提取及不同超声功率提取的绿茶茶汤电渗析前后咖啡碱含量变化Fig.7 Caffeine content change of green tea infusions extracted by hot water and ultrasonic-assisted water after electrodialysis treatment
电渗析处理后,所有茶汤样品的茶多酚及咖啡碱含量均呈下降趋势。热水提取的茶汤样品经电渗析处理后,茶多酚及咖啡碱的损失率均显著(P<0.05)高于超声辅助提取的茶汤。茶汤中茶多酚的损失率随着超声提取功率的增加显著(P<0.05)降低,超声功率高于390 W 时,不同超声功率提取的茶汤中茶多酚损失率无显著差异;不同超声功率提取的茶汤中咖啡碱的损失率无显著差异。热水提取的茶汤经电渗析处理后,茶多酚及咖啡碱的损失率分别为3.25%及7.67%,520 W 超声提取的茶汤经电渗析处理后,茶多酚及咖啡碱的损失率分别为2.41%、4.52%。张正竹采用0.1 μm Al2O3滤膜对红茶提取液进行电渗析处理,发现经电渗析处理后,红茶提取液中的咖啡碱由0.725 mg/mL 降至0.714 mg/mL,与本实验结果一致[24]。
2.2.3 电渗析处理前后绿茶茶汤中金属离子含量变化 选取热水提取、最小超声功率130 W 提取及最大超声功率520 W 提取的绿茶茶汤为代表样品,分别测定电渗析前后茶汤中8 种金属离子(钙、铜、铁、钾、镁、锰、钠、锌)含量变化,结果如表2 所示。
由表2 可以看出超声辅助提取的绿茶茶汤中钙、钾、镁、锰离子含量均高于热水提取的茶汤,且520 W 超声提取的茶汤中含量高于130 W 超声提取的茶汤;电渗析处理过程能够有效降低绿茶茶汤中钙、钾、镁、锰离子的含量,三种提取条件对钾的脱除率分别为89.59%、80.20%、67.46%,对锰的脱除率分别为88.56%、77.35%、64.92%,对钙及镁的脱除均能至检出限20 mg/kg 以下,其它金属离子(铜、铁、锌)含量均低于检出限。钠离子的含量变化与其它金属离子相反,电渗析处理后含量反而上升,且超声功率越大,含量越高,可能是由于电渗析处理时,浓水为0.5% NaCl 溶液(为了增加离子迁移,对茶汤品质无影响),随着电渗析时间的延长,淡水室中阳离子含量不断减少,浓水室中离子含量不断增加,导致Na+从浓水室向淡水室中迁移造成的[38]。
2.2.4 电渗析处理对绿茶茶汤冷却处理后浊度及离心沉淀率的影响
2.2.4.1 冷却处理后不同绿茶茶汤浊度及离心沉淀率变化 将热水提取、不同超声功率辅助热水提取的茶汤及所对应的电渗析处理后的样品,置于4 ℃条件下冷藏18 h,测定浊度、离心沉淀率以及离心后上清液浊度,计算冷却后的茶汤浊度较冷却前增加倍数,结果如图8、图9。
4 ℃冷却18 h 后,所有茶汤样品均变浑浊,浊度较冷却前显著(P<0.05)增加。由图8 及图9 可以看出,对于未经电渗析处理的绿茶茶汤,冷却后浊度均增加至600 NTU 以上,虽然超声辅助提取的绿茶茶汤浊度高于热水提取,但冷却后,390、520 W 超声提取绿茶茶汤的浊度显著(P<0.05)低于热水提取及其他低功率超声提取的茶汤;与冷却前浊度相比,热水提取的绿茶茶汤冷却后浊度增加倍数最高,增加至冷却前的8.11 倍,超声辅助提取的绿茶茶汤冷却后浊度增加倍数相对较低,浊度增加倍数与超声提取功率呈负相关,即最大超声功率520 W 提取时,茶汤冷却前后浊度增加倍数最小,为冷却前的4.04 倍。
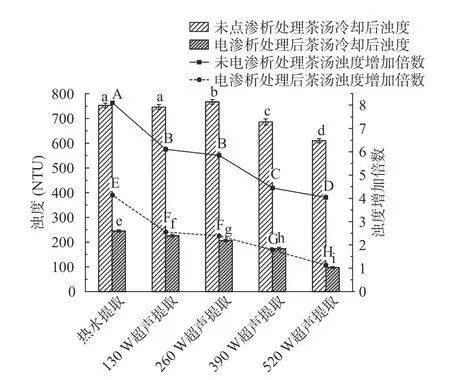
图8 电渗析处理不同茶汤样品冷却后浊度的变化Fig.8 Turbidity change of cooled green tea infusions after electrodialysis treatment
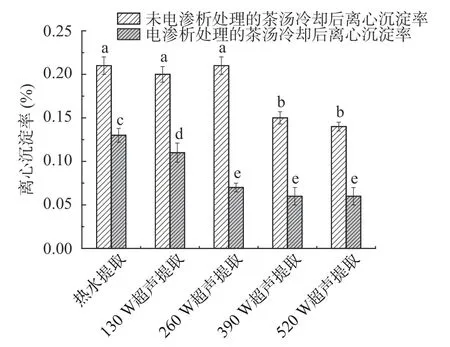
图9 电渗析处理不同茶汤样品冷却后离心沉淀率Fig.9 Centrifugal precipitation rate of cooled green tea infusions after electrodialysis treatment
电渗析处理后的绿茶茶汤冷却后浊度范围为97.4~245 NTU,均显著(P<0.05)低于未经电渗析处理的茶汤;超声辅助提取并经电渗析处理的绿茶茶汤,冷却后浊度显著(P<0.05)低于相同处理的热水提取的茶汤,且浊度随超声功率的增加显著(P<0.05)降低。与冷却前浊度相比,超声辅助提取并经电渗析处理的绿茶茶汤,冷却后浊度增加倍数变化趋势与未经电渗析处理的茶汤样品一致,但增加倍数显著(P<0.05)低于未经电渗析处理的样品。热水提取并经电渗析处理的茶汤冷却后浊度增加倍数最高,为冷却前的4.14 倍,520 W 超声辅助提取并经电渗析处理的茶汤冷却后浊度增加倍数最低,为冷却前的1.13 倍,与冷却前差异不大,且基本保持澄清,未见沉淀。
对于未经电渗析处理的绿茶茶汤,不同样品冷却后离心沉淀率变化与浊度变化趋势一致,390及520 W 超声提取的绿茶茶汤冷却后离心沉淀率显著(P<0.05)低于热水提取及其它低超声功率提取的绿茶茶汤;电渗析处理后,绿茶茶汤冷却后离心沉淀率显著(P<0.05)低于未经电渗析处理的茶汤;且经电渗析处理后,超声辅助提取的绿茶茶汤经冷却处理后,离心沉淀率显著(P<0.05)低于热水提取的茶汤。
由此可见,超声提取功率达到390 W 以上时,对于绿茶茶汤的“冷后浑”具有一定的抑制效果,这可能与超声提取的绿茶茶汤中蛋白质及果胶含量有关,有研究表明,超声波辅助提取的绿茶茶汤中蛋白质和果胶含量均低于常规提取茶汤,即超声波提取对茶汤中的蛋白质和果胶的提取具有抑制作用,能够减少茶凝乳的形成[31],故超声辅助提取的茶汤冷却后,浊度增加倍数及离心沉淀率均低于热水提取的茶汤。
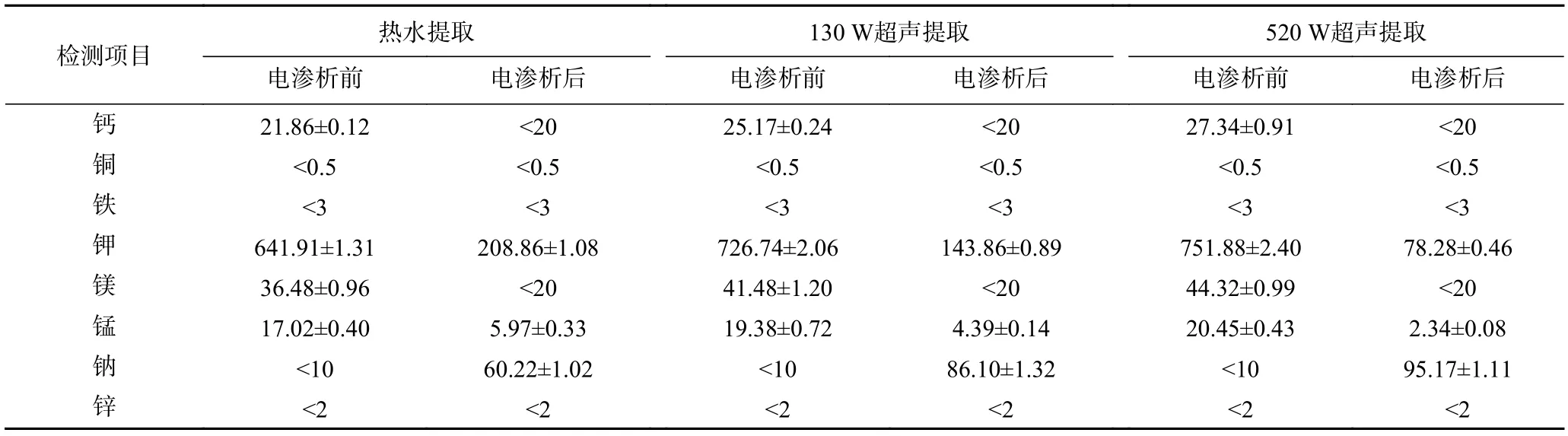
表2 电渗析前后绿茶茶汤中金属离子含量(mg/kg)Table 2 Metallon concentration change of green tea infusions after electrodialysis treatment (mg/kg)
电渗析处理对于绿茶茶汤的“冷后浑”具有明显的抑制效果,且随着超声提取功率的增加,抑制效果越显著,这可能是由于超声提取过程中,细胞破碎导致更多的处于螯合状态的金属离子解离,通过电渗析过程除去,减少了茶汤中的金属离子,从而减少了金属离子与茶汤中蛋白质、茶多酚等成分结合形成茶凝乳[39],这一现象与绿茶茶汤电渗析处理前后金属离子含量变化相吻合,电渗析处理后,绿茶茶汤中的大部分金属离子含量均显著降低。相关研究表明,Ca+、Mg+、Mn+、K+、Al+等金属离子会加速茶汤中沉淀的形成[40−42],Xu 等研究发现,绿茶浓缩液在低温条件下贮藏形成的不可逆沉淀主要是Ca2+、Mg2+、Ga3+和Mn2+与草酸结合形成的,四种金属离子在不可逆沉淀中的含量均占1%以上[11],故降低茶汤中金属离子的含量,能够抑制茶汤中沉淀的生成。
2.2.4.2 不同茶汤样品二次冷却处理后浊度变化 将2.2.4.1 中不同茶汤样品冷却处理并离心后的上清液在4 ℃条件下二次冷却处理18 h,测定浊度,结果如表3 所示。
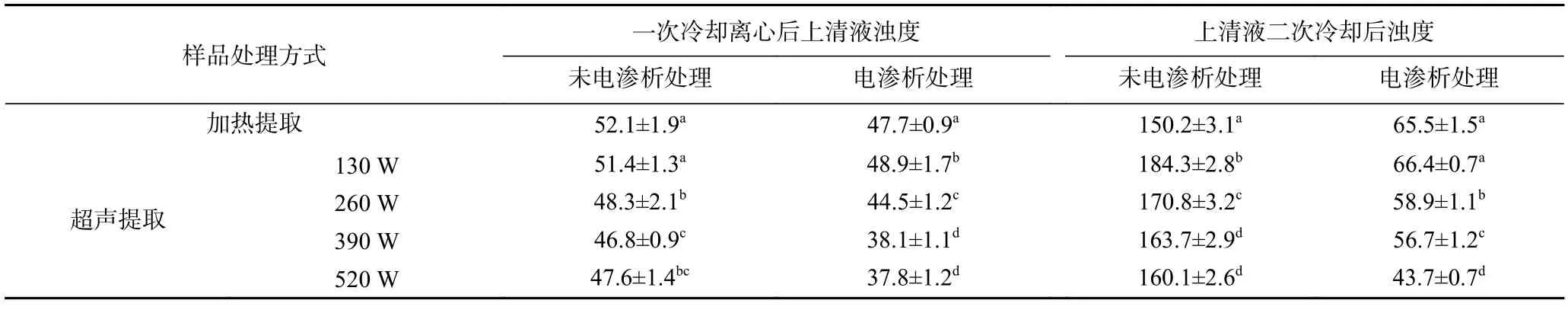
表3 不同茶汤样品冷却离心后上清液及上清液二次冷却后浊度(NTU)Table 3 Turbidity of clear green tea infusions after recooled(NTU)
热水提取、不同超声功率提取的绿茶茶汤及对应电渗析处理后的茶汤,经冷却离心后,上清液浊度降低至60 NTU 以下,超声辅助提取的茶汤浊度低于热水提取的茶汤,且随超声功率的增加,浊度显著降低,同时经电渗析处理的茶汤浊度低于对应的未经电渗析处理的茶汤;将上清液在4 ℃条件下存放18 h进行二次冷却后,未经电渗析处理后的茶汤重新变浑浊,浊度增加至150 NTU 以上,经过电渗析处理的茶汤的浊度虽有所增加,但增幅不明显,仍能保持澄清,浊度显著低于未电渗析处理的茶汤,且无沉淀产生,这是由于电渗析过程中,金属离子的脱除减少其与茶汤中蛋白质、茶多酚等形成络合物的机率,因此贮藏过程中浊度无显著增加。
3 结论
本文探明了超声辅助提取的绿茶茶汤品质优于热水提取的茶汤,其可溶性固形物、茶多酚含量、咖啡碱含量均高于热水提取,最佳超声提取功率为390 W,茶汤中茶多酚及咖啡碱含量达到最大值,分别为5903.14、1091.87 mg/kg,且未出现降解。对热水提取及不同超声功率提取的绿茶茶汤进行电渗析处理,发现电渗析处理能够显著降低茶汤浊度,且能够有效脱除茶汤中金属离子(520 W 超声提取的茶汤中钾脱除率高达89.59%,锰脱除率高达88.56%),由此抑制金属离子与茶多酚、蛋白质形成“茶凝乳”,减少茶汤沉淀产生,对绿茶茶汤的“冷后浑”具有明显的抑制效果。电渗析处理对超声辅助提取的绿茶茶汤“冷后浑”抑制效果较热水提取的绿茶茶汤效果好,其中对520 W 超声功率提取的茶汤“冷后浑”的抑制效果最好,茶汤在4 ℃冷却18 h 后,浊度仅增加至冷却前1.13 倍。
综上所述,超声辅助热水提取及电渗析处理对绿茶茶汤品质的改善及“冷后浑”的抑制具有较好的效果,经进一步放大试验后应用于茶饮料的生产,对于改善目前茶饮料品质及抑制“冷后浑”产生具有重要的现实意义。

