β-环糊精对中性红包合及应用的研究
*刘长远
(贵州省有色金属和核工业地质勘查局二总队 贵州 553000)
中性红是应用十分广泛的指示剂[1],当其接触到酸性溶液时,能够观察到荧光现象。考虑到β-环糊精能够发挥增敏的功效。故本实验采用β-环糊精包合中性红,并研究了β-环糊精包合中性红反应的最佳条件,最后运用β-环糊精-中性红包合物荧光猝灭法测定NO2-,确定制备的最佳条件,提出了能够测量NO2-的方法,最低能够检测出2.11×10-3mg/L的NO2-。利用这一方法测量样品含量,获得较好的结果[2]。
1.实验部分
(1)仪器
EL204电子天平(梅特勒-托利多仪器(上海)有限公司);
CARY50紫外-可见分光光度计(美国 VARIAN);
B3200S超声仪(必能信超声(上海)有限公司);
RF-5301PC荧光分光光度计(日本岛津)。
(2)试剂
0.067mol/L KH2PO4溶液:取4.54g的KH2PO4固体溶于500mL的容量瓶中,稀释至刻度配成0.067mol/L KH2PO4溶液;
0.067mol/L Na2HPO4溶液:取9.46gNa2HPO4固体溶于1000mL的容量瓶中,稀释至刻度配成0.067mol/L Na2HPO4溶液;
1.0×10-3mol/L中性红溶液:取0.2888g的中性红固体溶于100mL的容量瓶中,稀释至刻度配成1×10-2mol/L的母液,取上述母液10mL置于100mL的容量瓶中,稀释至刻度配成1×10-3mol/L的溶液;
5.0×10-3mol/Lβ-环糊精溶液:取1.419g的β-环糊精固体于250mL的容量瓶中,稀释至刻度配成5×10-3mol/L的溶液;3.0mol/LHCl溶液:取25mL12mol/L的浓盐酸于100mL的容量瓶中,稀释至刻度配成3mol/L HCl溶液;
10mg/L NaNO2溶液:取1g的NaNO2固体溶于1000mL容量瓶中,稀释至刻度配成1g/L的NaNO2溶液母液,取上述母液10mg置于1000mL容量瓶,稀释至刻度配成10mg/L的溶液。
所有试剂均为分析纯,实验过程中使用的水均为超纯水。
(3)实验部分
①包合物的制备
精准量取2.0mL缓冲溶液(pH值7.6)、1.0mL中性红溶液(1.0×10-3mol/L),以及适量的β-CD溶液(5.0×10-3mol/L),依次掺入10mL比色管里面,不断添水,直至总体积达到10mL,混合直至均匀,超声5min,静置15min,利用荧光分光光度计,在波长470nm位置测量荧光强度并记录下来。
②NO2
-的测定在25mL比色管中依次添加1.0mL的NO2-,0.50mL的β-CD-中性红包合物溶液,不断添水,直至总体积达到10.0mL,然后添加0.50mL的3mol/L的HCl溶液,混合直至均匀,25min后,继续加水,定容到25mL,在λex为470nm的激发下,在λem为590nm位置测量试剂以及空白的荧光强度,分别用F和F0表示。
2.结果与讨论
(1)包合物的制备
①包合物的形成
量取2.0mL缓冲溶液(pH7.6)、1.0mL中性红溶液(1.0×10-3mol/L)、依次取1.0mL,2.0mL,3.0mL,4.0mL,5.0mL的β-CD溶液(5.0×10-3mol/L),添加到10mL比色管中,继续加水,直至总体积达到10mL,混匀,超声5min,在实验室中放置15min,然后利用荧光分光光度计在波长470nm位置对溶液进行测量。在450~700nm范围内测定体系的荧光强度,见图1。
对图1进行分析能够确定,在470nm波长位置,反应产生的产物包合物的发射上限值出现在590nm位置,在随着β-环糊精加入量的增加,荧光增强,证明环糊精具备荧光增敏的功能。

图1 中性红包合物的形成
1:5.0×10-3mol/Lβ-CD;2:1.0×10-3mol/L的中性红;3:1mLβ-CD与中性红;4:2mLβ-CD与中性红;5:3mL β-CD与中性红;6:4mLβ-CD与中性红;7:5mLβ-CD与中性红。
②酸度的选择
移取相同体积而pH值分别为6.8、7.0、7.2、7.4、7.6、7.8、8.0的KH2PO4-Na2HPO4缓冲液、1.0mL中性红(1.0×10-3mol/L、以及适量的β-CD溶液(5.0×10-3mol/L),依次倒入10mL比色管中,不断加水,直至体系的体积达到刻度位置,混合达到均匀状态后,超声5min,在实验室中放置15min,于荧光分光光度计上,在470nm位置进行测量。结果表明,在缓冲液pH值持续增大的过程中,体系的ΔF先是不断增大,达到顶点时,pH值为7.6,然后不断降低。由此确定最终的pH值为7.6。
③反应稳定时间
准确移取2.0mL缓冲溶液(pH为7.6)、1.0mL中性红溶液(1.0×10-3mol/L)、少量β-CD溶液(5.0×10-3mol/L),依次倒入10mL比色管里面,不断加水,直至体系的体积达到刻度位置,混合达到均匀状态后,超声5min,分别静置5min、10min、15min、20min、30min、35min、60min、90m in,利用荧光分光光度计在470nm波长位置进行测量。最后可知,在15min以内,体系的荧光强度和室温放置时间之间为正相关关系,15min时体系的荧光强度达到峰值,且较为稳定,而15min之后的荧光强度减弱,因此选择反应稳定时间为15min。
④试剂加入顺序的影响
为了揭示出试剂添加顺序和β-CD包合中性红之间的关系,需要以添加顺序为唯一变量进行实验:A.缓冲液+中性红+β-CD;B.缓冲液+β-CD+中性红;C.中性红+缓冲液+β-CD;D.中性红+β-CD+缓冲液;E.β-CD+缓冲液+中性红;F.β-CD+中性红+缓冲液。按包合物形成的实验方法配制溶液,将溶液放在超声仪中超声5min,在实验室环境下放置15min,然后进行测量。结果发现:荧光强度和试剂添加顺序之间存在关联,上述第A组的荧光强度超过其他组,由此确定应该按照缓冲液、中性红、β-CD的顺序添加。
(2)包合物的表征
①中性红包合前后的荧光强度比较
量取2.0mL缓冲溶液(pH7.6)、1.0mL中性红溶液(1.0×10-3mol/L)、2.0mL的β-CD溶液(5.0×10-3mol/L),依次倒入10mL比色管里面,然后加水,直至体系的体积达到刻度位置,混合达到均匀状态后,超声5min,在实验室中放置15min,于荧光分光光度计上,在470nm波长位置进行测量。如下图2。
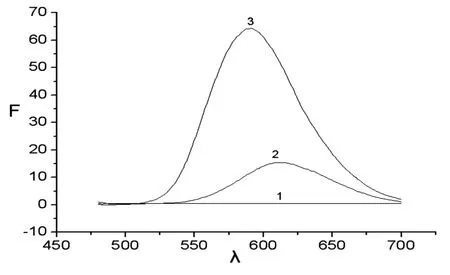
图2 中性红包合前后的荧光光强的比较
1:5.0×10-3mol/L的β-CD;2:1.0×10-3mol/L中性红;3:5.0×10-3mol/L的β-CD与1.0×10-3mol/L中性红。
由图2可知,1为β-CD溶液没有荧光强度;2为中性红溶液有较强的荧光强度;3为β-CD与中性红,其荧光强度远超过中性红,且发射波长偏移,由此证明产物包合物和β-CD具备荧光增敏的功能。
②中性红包合前后的吸收曲线比较
准确移取2.0mL缓冲溶液(pH7.6)、1.0mL中性红溶液(1.0×10-3mol/L)、2.0mL的β-CD溶液(5.0×10-3mol/L),依次倒入10mL比色管里面,然后加水,直至体系的体积达到刻度位置,混合达到均匀状态后,超声5min,在实验室中放置15min,通过紫外分光光度计测量吸光度,如下图3。
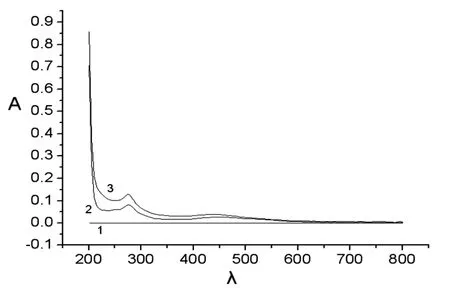
图3 中性红包合前后的吸收曲线
1:5.0×10-3mol/L的β-CD;2:1.0×10-3mol/L中性红;3:5.0×10-3mol/L的β-CD与1.0×10-3mol/L中性红。
由图3可知,1为β-CD没有吸光度;2为中性红有较强的吸光度;3为β-CD与中性红,其吸光度比中性红大,说明了β-CD有增敏作用。
(3)NO2-的测定
①盐酸用量的影响
分别量取1.0mL的NO2-和0.50mL的β-CD-中性红包合物溶液,先后添加到25mL比色管里面,接着不断添水,直至体系体积达到10.0mL,分别加入3mol/L的盐酸0.10L、0.30L、0.50L、0.70L、0.90L、1.10L,摇晃达到均匀状态,反应25min后,定容,整体放置在λex为470nm的条件下,在λem为590nm位置进行测量。在不断掺入盐酸的过程中,体系的ΔF值增大;当盐酸用量为0.5mL时,ΔF值最大;之后的ΔF值随着盐酸用量的增大而急剧减小,所以选盐酸用量为0.5mL作为体系的反应环境。
②反应时间的影响
分别量取1.0mL的NO2-和0.50mL的β-CD-中性红包合物溶液,先后添加到25mL比色管里面,接着不断添水,直至体系体积达到10.0mL,接着掺入0.50mL的3mol/L的HCl溶液,摇晃直至均匀状态,将溶液放置2min、6min、10min、15min、20min、25min、30min、35min、60min,定容,在λex为470nm的条件下,于λem为590nm处进行测量。结果表明,在25min以内,体系的ΔF值和反应时间之间为正相关关系;在25min时,ΔF值最大;之后的ΔF值随着时间的增长而减小,所以选择25min为反应时间。
③试剂加入顺序的影响A.NO2-+中性红包合物+HCl,B.NO2-+HCl+中性红包合物,基于上述两种添加顺序进行配制,轻微摇晃直至达到均匀状态,25min后,用水定容,在λex为470nm的条件下,于λem为590nm位置进行测量。结果发现,试剂加入顺序是影响ΔF值的因素之一。按照A顺序添加,能够实现更大的ΔF值,因此在实验中确定采用先中性红包合物后HCl的顺序添加。
(4)标准曲线的绘制
在确定的盐酸用量为0.5mL,反应时间为10min,按照NO2-+中性红包合物+HCl顺序掺入时,量取10mg/L的NO2-0.0mL、1.0mL、2.0mL、4.0mL、6.0mL、8.0mL、10.0mL,按1.2.2的实验方法配制溶液,25min后,不断掺水,定容,接着进行测量。如下图4。
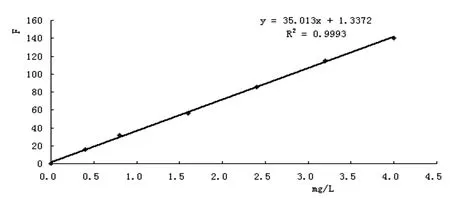
图4 标准曲线
由图4可知,当NO2-不超过4.5mg/L时,其和F之间为线在同等条件下测量12次空白,计算平均值,根据s2={(x1-x)2+(x2-x)2+…+(xn-x)2}/(n-1)计算得到的标准偏差为9.76×10-3,用3S除以工作曲线的斜率K,此时得到的检测限为2.11×10-3mg/L。也就是说,该方法具有良好的精密度。
(5)样品分析
分别取适量自来水和水城河水样,于25mL的比色管中先后添加1.0mL的NO2-,0.50mL的β-CD-中性红包合物溶液,不断添水,直至体系的总体积为10.0mL,接着倒入0.50mL的3mol/L的HCl溶液,轻微摇晃直至达到均匀状态,10min后加水定容,在λex为470nm的条件下,于λem为590nm位置,测量出试剂和空白的荧光强度,分别为F和F0,见表1。
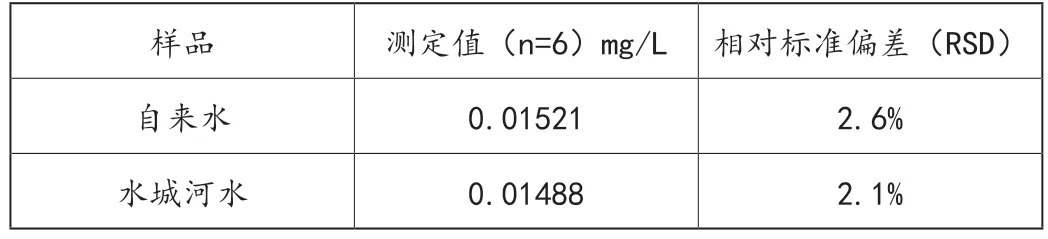
表1 水样中NO2-的测定
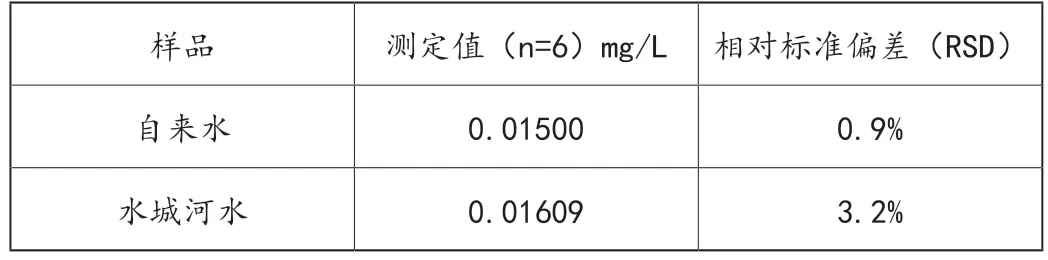
表2 水样中NO2-的测定
3.结论
中性红、β-环糊精在pH值为7.6的Na2HPO4-KH2PO4缓冲液中,放置时间为15min时,可以合成β-CD-中性红包合物,包合物的荧光强度比中性红的荧光强度高,通过本文提出的方法,测量水含有的NO2-是完全可行的,具有较大的应用潜力[3-4]。

