香菇液体菌种培养基及摇瓶培养条件优化
谢 婷 何 娟 张顺凯 焦海涛 边银丙 肖 扬*
香菇液体菌种培养基及摇瓶培养条件优化
谢 婷1何 娟1张顺凯2焦海涛2边银丙1肖 扬1*
(1. 华中农业大学应用真菌研究所,武汉 430070;2. 湖北森源生态股份有限公司,湖北 宜昌 444200)
建立液体菌种优质高效生产技术体系是香菇工厂化生产的重要保障。以香菇‘森源16’为试验菌株,选择菌丝生物量、菌丝球密度和直径为主要评价指标,采用单因素和正交试验L9(34)优化香菇摇瓶液体发酵工艺。结果:棉秆粉为最佳碳源,麸皮为最佳氮源;优化培养基配方为葡萄糖3 g/100mL,棉秆粉1.5 g/100mL,木屑粉1.5 g/100mL,麸皮0.6 g/100mL,KH2PO40.1 g/100mL,MgSO4·7H2O 0.05 g/100mL;最优摇瓶发酵条件为装液量100 mL/250mL,摇床转速170 r/min,初始pH 5.5,羧甲基纤维素钠0.20 g/100mL,漆酶0.05 g/100mL。
香菇;液体菌种;培养基优化;摇瓶发酵;条件优化
香菇()营养丰富,味道鲜美,被誉为“山珍之上品”,且具有抗病毒、免疫调节、健胃、助消化、抗炎症、抗菌和抗肿瘤等活性[1, 2]。2018年我国香菇产量为1 043.12万吨,居世界首位[3]。传统的生产模式已无法满足香菇产业快速发展的要求[4],香菇生长周期较长,菌龄不一致,生产成本高,生产过程易染菌、出菇期长且整齐度低、投入劳动强度大等缺点,成为制约产业规模化、周年化和机械化发展的主要因素[5]。菌种生产是食用菌生产的第一道工序,菌种的优劣关系到产业的成败[6]。成熟的液体菌种生产技术是食用菌产业工厂化、周年化和规模化生产的关键。目前液体菌种越来越受到食用菌生产企业的青睐,已成为食用菌制种产业的发展趋势[6-8]。香菇液体菌种与固体菌种相比具有以下优点:一是生产工艺简便;二是菌种纯度高,菌龄一致;三是污染率较低;四是标准化程度和管理效率高,能进行周年工厂化生产;五是成本降低,利润提高[9]。
成熟的液体菌种生产技术是食用菌产业工厂化、周年化和规模化生产的关键。香菇液体菌种的研究在20世纪80年代就有报道,但至今仍未应用于大规模栽培。液体培养发酵工艺是获取优质香菇液体菌种的关键,培养基组成成分、摇床转速、培养温度和通气量等则是其中重要的影响因素[9]。香菇液体培养基组分为氮源、碳源、微量元素、无机盐和生长因子等[10]。本研究对‘森源16’菌株的液体培养基配方及培养条件进行优化,以促成香菇液体菌种的规模化生产与应用。
1 材料与方法
1.1 供试菌株
菌株‘森源16’由湖北森源生态科技股份有限公司提供。
1.2 培养基配方
母种培养基:PDA培养基。对照液体培养基(CK):葡萄糖2 g/100mL,玉米粉0.3 g/100mL,麸皮0.4 g/100mL,豆粕0.3 g/100mL,磷酸二氢钾0.1%,硫酸镁0.05%,pH自然。
选取新鲜无霉变的木屑粉、豆粕、麸皮、玉米和棉秆等天然基质置于电热恒温烘箱中烘干,使用粉碎机粉碎后过120目筛(孔径0.125 mm),按配方称取相应重量至对应的对照液体培养基或优化培养基中。
1.3 试验方法
1.3.1 液体菌种的制备
将大小约0.5 cm2的菌块接入装有100 mL培养基的250 mL三角瓶中,每瓶接5块,接种完毕后置于恒温摇床中,在170 r/min、25 ℃条件下震荡培养10天。
1.3.2 培养基配方的优化
(1)单因素筛选。培养基碳源选择葡萄糖、玉米芯粉、棉秆粉、木屑粉,氮源为豆粕粉和麸皮,试验共设计9个配方(表1)。将配方1作为氮源与碳源试验的对照组;配方1、2和3分别以葡萄糖、棉秆粉、玉米芯粉作为单一碳源;配方8和9分别以麸皮和豆粕作单一氮源,比较两者之间的差异。每处理3次重复。
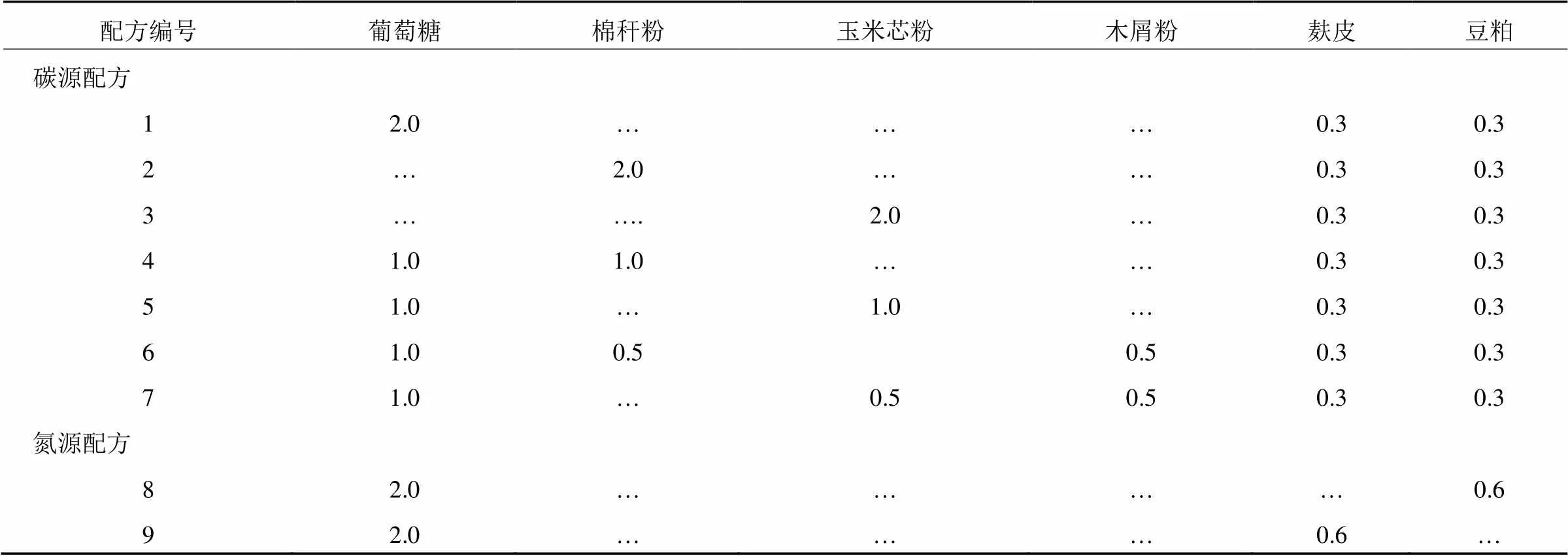
表1 液体菌种培养基碳氮源的单因素配方(g/100mL)
以菌丝生物量(以菌丝干重计)、菌丝球直径和密度为评价指标,确定适宜的碳源和氮源组成。菌丝生物量、密度和直径测量方法参考实验室前期工作[11]。所有处理均添加0.05%的MgSO4和0.1%的KH2PO4;摇瓶培养条件为:150 r/min,25 ℃连续培养10天。
(2)正交试验筛选最佳配方。通过单因素筛选出各碳源和氮源的浓度(表2)。进一步应用SPSS22.0软件设计L9(34)正交试验,以菌丝生物量为衡量指标,确定液体菌种发酵的最优配方(表3),每组试验重复3次。
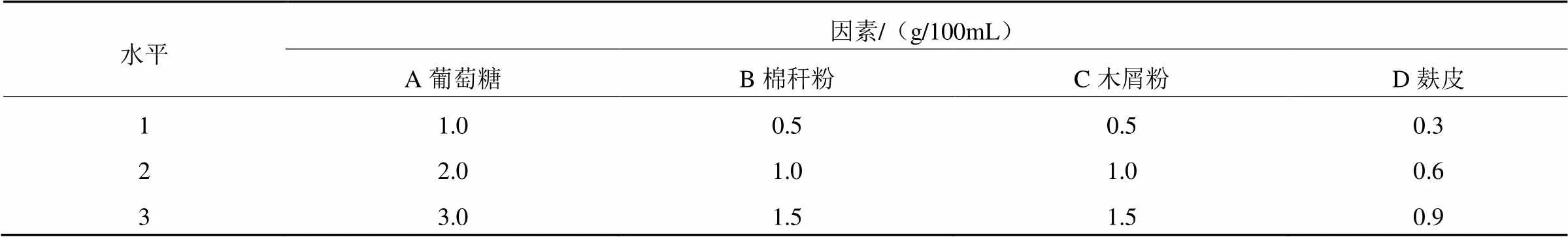
表2 液体菌种培养基正交优化试验的碳氮源水平

表3 液体菌种培养基配方正交优化试验设计
1.3.3 摇瓶发酵工艺的优化
(1)使用优化的培养基配方对发酵工艺进行单因素筛选。各因素分别为:①羧甲基纤维素钠,分别设置0.1、0.2、0.3、0.4、0.5 g/100mL等5个浓度,在25 ℃,150 r/min,装液量100 mL,pH自然条件下培养10天。②外源添加漆酶,分别设置0、0.01、0.03、0.05、0.07 g/100mL等5个浓度,在45 ℃下处理24 h。在25 ℃,150 r/min,装液量100 mL,pH自然条件下培养10天。③摇瓶装液量,设置60、80、100、120、140 mL等5 档,在25 ℃,150 r/min,pH自然条件下分别培养10天。④培养基初始pH,分别调节至4、5、6、7、8和pH自然,在25 ℃,150 r/min,装液量100 mL条件下培养10天。⑤摇瓶转速,设置140、150、160、170、180 r/min等5个水平,在25 ℃,装液量100 mL,pH自然条件下培养10天。以上参数的最优值,均通过测定菌丝生物量、菌丝球密度和直径加以判定。
(2)通过正交试验确定最佳发酵工艺。单因素试验确定的各参数水平如表4所示。进一步应用SPSS 22.0软件设计L9(34)正交试验,以菌丝生物量为主要衡量指标,确定香菇液体菌种发酵的最优配方(表5),每组试验重复3次。

表4 液体菌种发酵工艺正交优化试验的因素水平

表5 液体菌种培养基配方正交优化试验设计
2 结果与分析
2.1 不同碳、氮源与菌丝生长的关系
由图1-A,B,C可知,配方2的菌丝生物量最大,配方4的菌丝球密度最大、直径最小,说明棉秆粉与香菇的菌丝体生物量、菌丝球的密度和直径有密切关系。前期实验室研究结果表明,添加少量的木屑粉可以促进香菇菌丝生长[11]。因此选择棉秆粉、木屑粉和葡萄糖作为最佳碳源应用。
不同氮源的菌丝体生物量差异不显著(图1-D)。以麸皮为氮源时,菌丝球的密度和直径显著高于豆粕(图1-E,F),且其悬浮性好。综合比较3个指标结果,选择麸皮作为培养基氮源组分。
2.2 培养基正交优化试验
根据单因素试验得到的合适碳、氮源,用L9(34)型正交试验表设计正交试验,对培养基进行优化的结果(表6),极差最大的是因素B,然后依次为因素C、A和D。说明棉秆粉是对香菇液体发酵菌丝体干重影响最大的培养基组分,其次是木屑粉、葡萄糖和麸皮。极差分析结果表明,最优培养基配方为A3B3C3D2,即葡萄糖3 g/100mL,棉秆粉1.5 g/100mL,木屑粉1.5 g/100mL,豆粕0.6 g/100mL。葡萄糖、棉秆粉、木屑粉和麸皮与菌丝体干重的相关性均达到显著水平(<0.05)。
由于极差分析得到的最优配方A3B3C3D2,并未出现在正交试验表中,对该配方进行试验验证。按此配方培养10天后,测得菌丝体干重为1.165 g/100mL,高于正交表中的所有处理。
2.3 不同培养条件对菌丝生长的影响
2.3.1 羧甲基纤维素钠浓度
粘度影响发酵过程中的溶氧浓度,同时也影响搅拌对菌丝机械剪切的作用。调节液体发酵环境的粘度,能调节菌球的大小和数量,从而制备出适合生产的最佳液体菌种[11]。从图2-A,B,C可以看出,随着羧甲基纤维素钠浓度的增加,各配方的菌丝体生物量和菌丝球直径都没有显著差异;菌丝球密度则呈先增高后降低趋势,其中羧甲基纤维素钠浓度为0.2 g/100mL时,菌丝球密度最大。该浓度下菌丝体生物量也较大,而菌丝球直径小,因此可选其为最佳浓度。
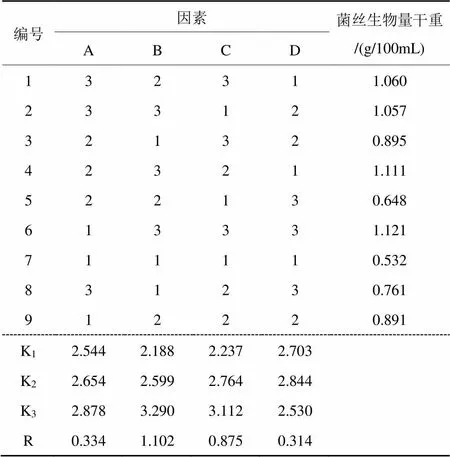
表6 液体菌种培养基优化正交试验结果
注:A为葡萄糖,B为棉秆粉,C为木屑粉,D为麸皮,Ki为各因素同一水平试验指标的平均数。R为各因素的极差。
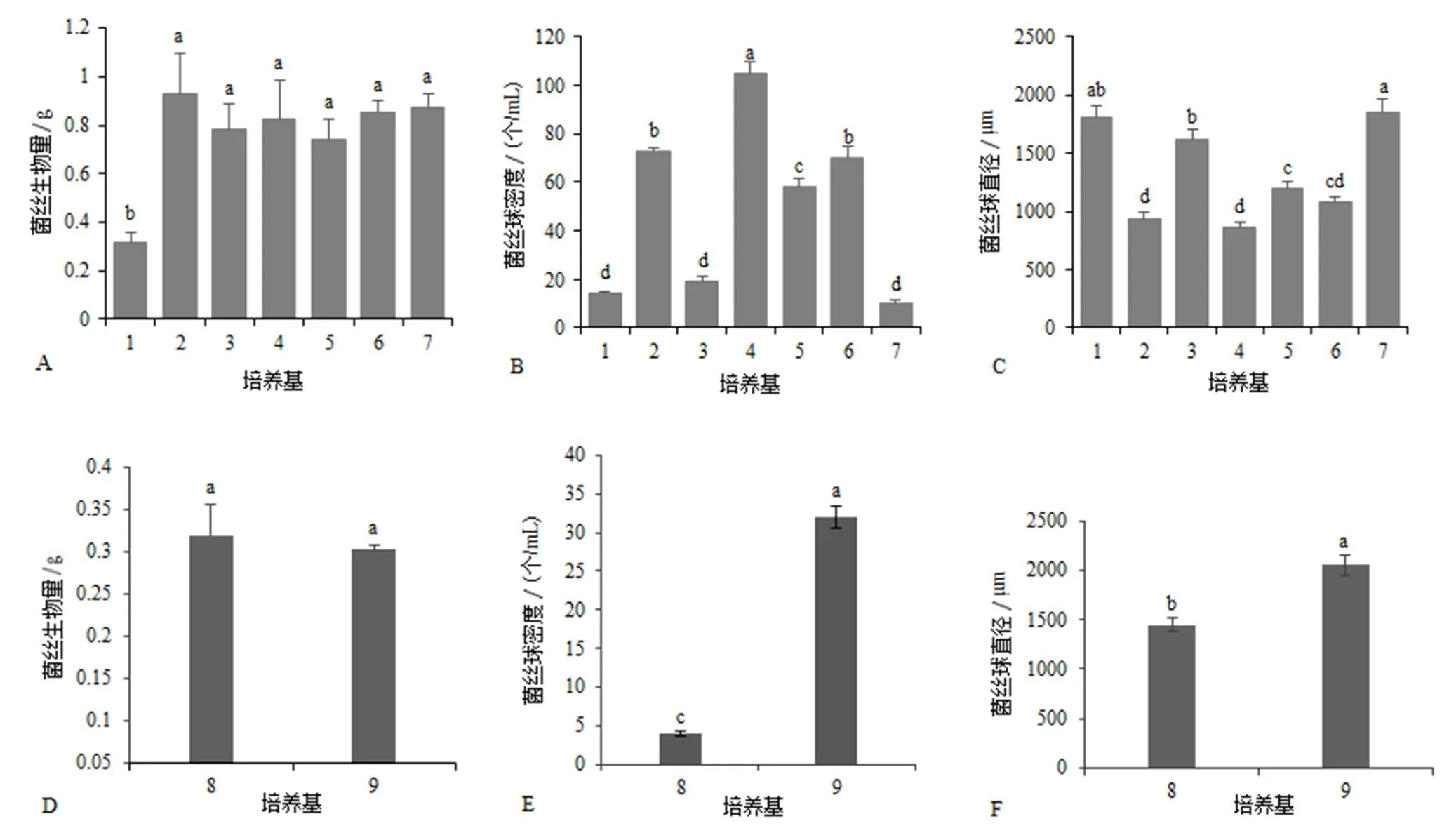
A~C:碳源筛选;D~F:氮源筛选。培养基编号见表1。不同小写字母表示处理间差异显著(P<0.05)。
2.3.2 漆酶浓度
由图2-D、E、F可知,随着漆酶添加量的增加,菌丝体生物量逐渐增大,菌丝球密度和直径则呈先上升后下降。漆酶添加量≥0.05 g/100mL,菌丝体生物量与对照相比有显著性差异。其中漆酶添加量为0.05 g/100mL时,菌丝体生物量达到最大,为1.0876 g/100mL,菌丝球密度也为最大,为113个/mL。故选择漆酶浓度为0.05 g/100mL作为最优添加浓度。
2.3.3 装液量
随着装液量的增加,菌丝体生物量整体呈显著上升态势,菌丝球直径逐渐增大,而密度显著降低(图2-G、H、I)。兼顾菌丝体干重、菌丝球密度和直径3个指标,选择100 mL为最优装液量。
2.3.4 摇瓶转速
摇瓶转速影响培养基内溶氧,转速过高,产生的剪切力影响菌丝体生长;转速过低,空气与培养基氧气交换不足,影响溶氧水平[9]。随着转速的提高,菌丝体生物量逐渐降低,菌丝球直径逐渐减小,菌丝球密度显著增加(图2-J、K、L)。说明转速越大,液体培养基的溶氧量越大,菌丝所受的剪切力也越大。综合菌丝生物量、菌丝球密度和直径3个指标,选择170 r/min为最佳转速。
2.3.5 初始pH
pH对菌丝体生长和代谢产物生成有重要的作用[12]。随着初始pH升高,菌丝体生物量先升高后降低,在pH为6时,达到最大值,为1.274 g/100 mL,菌丝球密度也最大,达171个/mL;菌丝球直径则较小(图2-M、N、O)。故筛选出最佳pH为6.0。
2.3.6 发酵工艺正交优化
根据单因素试验筛选得到的合适发酵工艺及相对应的浓度和条件,用L9(34)型正交试验表设计正交试验,对发酵工艺进行优化。从表7可以看出,极差最大的因素为B,其次分别为D、C、A。可见,对香菇液体发酵菌丝生物量影响最大的因素是外源添加漆酶,其次为初始pH、摇瓶转速和增稠剂羧甲基纤维素钠。极差分析结果,最优的发酵工艺为A3B2C1D1,即羧甲基纤维素钠0.25 g/100mL,漆酶0.05 g/100mL,转速170 r/min,pH 5.5。方差分析结果,外源添加漆酶浓度与菌丝体生物量之间的相关性达显著水平(<0.05),而其他3项发酵条件对菌丝体干重的影响均未达到显著水准。
由于得到的最优发酵条件A3B2C1D1,依然没有出现在正交试验表中,所以对该发酵条件进行验证试验,测得培养第10天的菌丝干重为0.853 g/100mL,高于正交表中的所有处理。
3 讨 论
3.1 香菇液体菌种培养基配方的优化
培养基配方直接影响菌种质量,它既要提供微生物生长繁殖所需的营养物质,又要防止营养过剩、渗透压过高而抑制菌体的生长。本实验室前期研究发现,香菇菌丝在棉秆替代部分木屑的栽培料中生长较快,且出菇周期明显缩短、出菇潮次集中[13]。在液体配方中添加部分木屑粉可以促进香菇菌丝的生长[11],本研究首次引进了棉秆粉、玉米芯粉等栽培基质作为香菇液体培养基的碳源,以期获得既能在液体培养中快速生长又能在栽培料中迅速定植的液体菌种。林刚等[14]对黄孢原毛平革菌()的液体培养配方进行优化发现,添加木材浸出液的菌丝球产量是未添加浸出液的5倍,且不易感染杂菌;在生长初期产量增加不明显,随着培养时间的增加,菌丝球产量差别加大,因此,木材浸出液对菌丝球的生长具有刺激作用。对秀珍菇、平菇和香菇的培养基优化试验发现,在纯液体培养基中加入适量的固体成分可以完善营养成分,并且可以给菌种的菌球形成提供“寄生核”,对菌丝球的形成与发育有明显的促进作用[15]。
目前在液体培养基中加入棉秆粉的研究尚未报道,因此,棉秆粉对香菇菌丝的作用还需进一步研究。香菇对小分子的有机碳源利用效果很好,本研究中优化配方的葡萄糖含量为3%。溶液中的葡萄糖含量适当降低,不仅能节约成本,溶液中的渗透压也能相应减小。香菇液体培养基的配方优化试验显示,在培养基中加入2%葡萄糖、4%木屑和4%黄豆粉,香菇菌丝的产量最高[16];也有显示,添加2%麸皮和1%酵母粉时香菇菌丝生物量较[17]高。郭兴等[18]优化元蘑液体培养基,发现酵母膏比蛋白胨、尿素、硫酸铵等氮源更好。本研究只使用了一种氮源,氮源的多样性对香菇菌丝的生长是否存在交互作用,还需作进一步的研究。
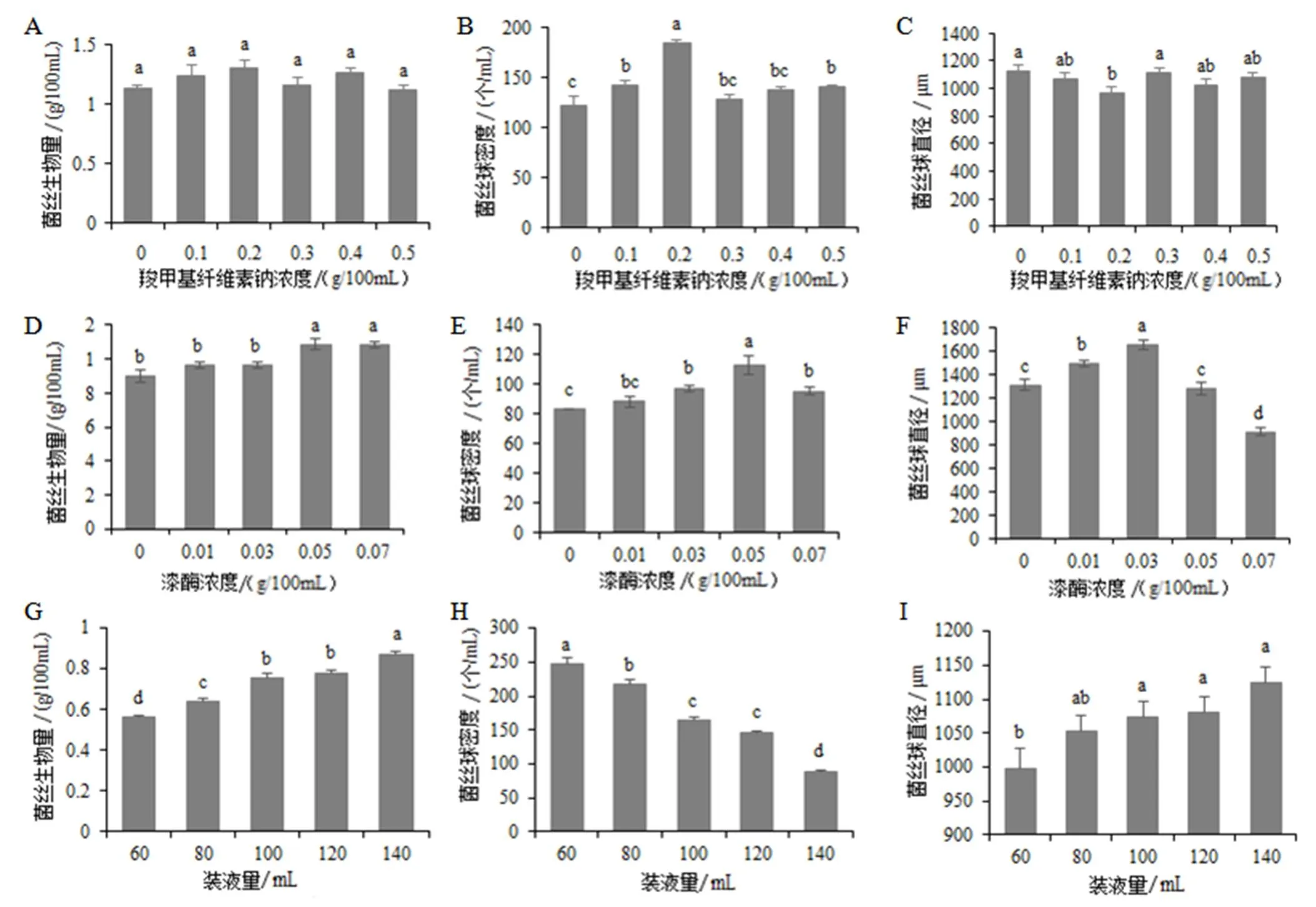
A~C:羧甲基纤维素钠浓度筛选;D~F:漆酶浓度筛选;G~I:装液量筛选;J~L:摇瓶转速筛选;M~O:初始pH筛选。培养基编号如表1所示。不同小写字母表示处理间差异显著(P<0.05)。
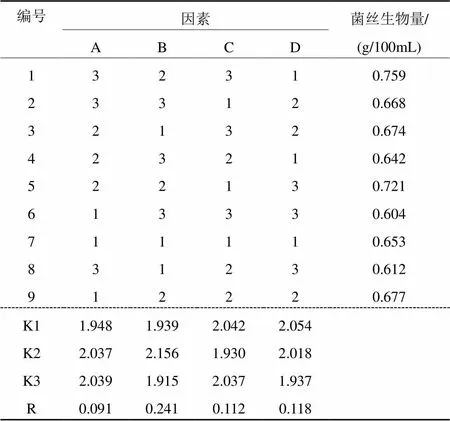
表7 香菇液体菌种发酵工艺优化正交试验结果
注:A为羧甲基纤维素钠,B为漆酶,C为转速,D为pH,Ki为各因素同一水平试验指标的平均数。R为各因素的极差。
3.2 香菇液体菌种发酵工艺参数的优化
前人对于香菇液体菌种发酵工艺的研究较少,许多培养参数没有系统优化。本研究优化了初始pH、摇床转速、摇瓶装液量、培养基的粘度(增稠剂)、外源添加漆酶浓度等参数,选取菌丝生物量、菌丝球直径和密度3个指标,对其进行单因素筛选。
香菇为好气性菌类,想要使菌丝又快又好地生长,需要在培养时给予足够的氧气。朱家骝等[19]对金针菇液体菌种的培养条件进行研究,发现在250 mL三角瓶中,装液量在50~100 mL以内,菌丝球干重增加,而装液量在100~150 mL之间,菌丝生物量则开始降低。这与本研究结果一致。徐思炜等[20]发现装液量和转速对香菇菌丝生长的影响较大,其中最优转速为180 r/min,最优装液量为100 mL/250mL。本研究得到的最优转速为170 r/min。摇床转速越快,培养液中的溶氧量越大,剪切力也随之增加。因此,适当的转速会促进香菇菌丝的生长。培养液的粘度对溶氧量也有较大的影响,在培养液中加入增稠剂可以增加培养液的浓度,增大剪切力。赵萍[21]对灵芝深层发酵过程中的发酵液粘度研究发现,增稠剂浓度为0.15%时,菌丝球密度大、重量较大且菌丝体大小均匀。本研究中添加0.25%的羧甲基纤维素钠,让香菇菌丝在适当的粘度下快速生长。
pH影响酶的活性及细胞膜活性,从而影响代谢。胡雯[22]研究发现,初始pH为5.5,香菇菌丝体生物量及胞外多糖产量最高,与本研究选出的最适初始pH相一致。一般木腐菌较喜欢在偏酸的环境中生长,且液体培养过程中培养基初始pH都会比终止pH高。原因是高温灭菌时pH会下降,菌丝在分解基质的过程中分泌有机酸也会导致pH降低。漆酶不仅分布于动、植物体内,也存在于多种真菌中参与生物化学反应,具有重要生理功能。漆酶参与木质素的降解,为菌体的生长发育提供营养。本研究首次在液体培养基中添加漆酶,发现其能显著提高香菇菌丝生物量。
[1] 常明昌. 食用菌栽培学[M]. 北京: 中国农业出版社, 2003: 138.
[2] Kües U, Liu Y. Fruiting body production in basidiomy- cetes[J]. Applied Microbiology & Biotechnology, 2000, 54(2): 141-152.
[3] 产业信息网. 2020—2026年中国香菇行业市场专项调查及市场发展前景报告[EB/OL]. https://www. chyxx.com/ research/202002/835998.html. 2020-2-21.
[4] 陆建明, 张锡凤. 食用菌液体菌种制备的研究进展[J].中国食用菌, 2003(06): 15-17.
[5] 李春霞, 吴建金, 黄亮, 等. 香菇0912液体菌种培养基及摇瓶发酵条件的筛选[J]. 天津农业科学, 2019, 25(02): 1-6.
[6] 戴建清, 曾志恒. 食用菌液体菌种研究现状及发展趋势[J]. 中国食用菌, 2012, 31(05): 1-3.
[7] Xiao J H, Chen D X, Xiao Y, et al. Optimization of submerged culture conditions for mycelial polysaccharide production in[J]. Process Biochemistry, 2004, 39: 2241-2247.
[8] 郭静利, 刘旭. 食用菌液体和固体制种技术比较经济效益分析[J]. 中国农业科学, 2011, 44(04): 835-841.
[9] 白秀峰. 发酵工艺学[M]. 北京: 中国医药科技出版社, 2003: 134-136.
[10] 吕作舟. 食用菌无害化栽培与加工[M]. 北京: 化学工业出版社, 2008: 109.
[11] 周韬. 香菇液体菌种培养基优化及其菌种质量评价体系的建立[D]. 武汉: 华中农业大学图书馆, 2017.
[12] Fang Q H, Zhong J J. Effect of initial pH on production of ganoderic acid and polysaccharide by submerged fermentation of[J]. Process Biochemistry, 2002, 37: 769-774.
[13] 陈黄曌, 蔡英丽边银丙. 棉秆屑代料栽培秋季香菇初探[J]. 食用菌学报, 2013, 20(02): 20-24.
[14] 林刚, 文湘华, 钱易. 液体培养基中添加天然成分对白腐真菌Phanerochaete chrysosporium生长的促进作用[J]. 环境科学, 2003(04): 41-47.
[15] 周信华, 王扬军, 陈若霞, 等. 秀珍菇、平菇、香菇液体菌种培养基与培养方式试验[J]. 当代蔬菜, 2006(12): 38.
[16] 沈维铎, 姚志伟, 杨群. 香菇液体培养的工艺优化[J].武汉生物工程学院学报, 2012, 8(02): 86-89.
[17] 韩冰, 陈顺, 于广峰, 等. 香菇液体深层发酵优化研究[J]. 食用菌, 2019, 41(04): 19-21.
[18] 郭兴, 刘继云, 李占君, 等. 元蘑液体培养基配方筛选[J]. 食用菌, 2019, 41(04): 40-42, 44.
[19] 朱家骝, 张琪晓, 李元梅. 金针菇液体菌种培养基及培养条件试验[J]. 浙江食用菌, 2009, 17(04): 26-27.
[20] 徐思炜, 张君胜, 周雯. 香菇液体菌种培养条件优化[J]. 江苏农业科学, 2014, 42(12): 290-292.
[21] 赵萍. 影响灵芝深层发酵因素的探讨[J]. 食品科学, 2002(11): 88-92.
[22] 胡雯. 香菇胞外多糖高产菌株筛选、发酵条件优化及抗氧化性抑菌作用的研究[D]. 南京: 南京农业大学, 2014.
Optimization of liquid spawn media and shake flask culture conditions of
Xie Ting1He Juan1Zhang ShunKai2Jiao Haitao2Bian Yinbing1Xiao Yang1*
(1. Institute of Applied Mycology,Huazhong Agricultural University,Wuhan, Hubei 430070, China; 2. Hubei Senyuan Ecological Co., Ltd., Yichang, Hubei 444200, China)
The establishment of a high-quality and high-efficiency production technology system for liquid spawn is an important guarantee for the factory production ofs. In this study,Senyuan No.16 was used as the test strain, and the mycelial biomass, mycelial ball density and diameter were used as the main evaluation indicators. Single factor test and orthogonal test L9(34) were used to optimize the liquid culture process ofin shaking flasks. Results showed that cotton stalk powder is the best carbon source and wheat bran is the best nitrogen source. The optimized medium formula is glucose 3 g/100mL, cotton stalk powder 1.5 g/100mL, wood chip powder 1.5 g/100mL, wheat bran 0.6 g/100mL, KH2PO40.1 g/100mL and MgSO4· 7H2O 0.05 g/100mL. The optimal culture conditions for shake flasks are 100 mL/250 mL of liquid volume, 170 r/min of shaker speed, initial pH of 5.5, sodium carboxymethyl cellulose 0.25 g/100mL, laccase 0.05 g/100mL.
s; liquid spawn; medium optimization; shake flask culture
S646
B
2095-0934(2021)03-242-08
湖北省技术创新专项重大项目(2018ABA095)
谢婷(1995—),硕士,主要从事食用菌栽培方面的研究。
肖扬(1979—),副教授,主要从事应用真菌生物技术和食用菌栽培研究工作。E-mail:xiaoyang@mail.hzau.edu.cn。

