新生牛睾丸未成熟支持细胞的分离培养与鉴定
高 振,刘 娟,孙 豪,姜 平*,赵志辉 *
(1.广东海洋大学 滨海农业学院,广东 湛江 524008;2.吉林大学 动物科学学院,吉林 长春 130062)
支持细胞(Sertoli cells,SCs)是由意大利学者Enricol Sertoli于1865年首先提出并加以概述的。SCs由早期胚胎生殖脊细胞发育而来,显微镜下细胞形态呈不规则圆锥状,与间质细胞等一起参与睾丸曲细精管的形成。研究表明,在雄性动物睾丸内,每个SCs只能支持有限数量的生殖细胞进入精子发生过程,每日精子产量与SCs的数量存在正相关[1]。因此,睾丸中SCs的数量决定了睾丸的最终大小和每天的精子产量[2]。睾丸中的SCs在生长发育过程中,可被分为未成熟型和成熟型2种。在大多数物种中,未成熟SCs的增殖在出生后有2个高峰期,其中第1个高峰期在胎儿或新生儿时期,另一个高峰期在初情期,此时的SCs为未成熟SCs[3-4]。随着动物个体的性成熟,睾丸中曲细精管管腔出现,未成熟SCs逐渐分化为成熟SCs,同时,细胞发生一系列的形态和结构变化,包括芳香化酶逐渐减少、FSH受体逐渐增多,并且开始具有合成转铁蛋白的能力[5]。研究表明,未成熟SCs的数量和功能将影响动物个体的生精效率和繁殖性能,而成熟SCs会丧失增殖分化的能力,因此,未成熟SCs的体外分离培养在生殖细胞的研究中是必不可少的。目前,从睾丸组织中分离SCs的方法包括机械分离法和酶消化法,但是现有方法普遍存在着分离步骤繁琐、细胞纯度较低、无法连续传代等问题。为了进一步深入研究睾丸未成熟SCs的各种功能和发生机制,建立一套稳定的分离纯化和原代培养体系是必要的。本试验通过优化现有的新生牛睾丸未成熟SCs体外分离纯化及鉴定方法,以期建立一种简单、快捷且高效地获得高纯度睾丸未成熟SCs的原代培养方法。
1 材料与方法
1.1 试验动物及材料中国西门塔尔牛睾丸组织,由吉林省农业科学院提供;胶原蛋白酶Ⅳ、胰蛋白酶、DMEM/F12、DPBS购自美国HyClone公司;福尔根DNA染色液购自上海源叶生物科技有限公司;兔源一抗(GATA4,FASL,KRT-18)购自北京博奥森生物技术有限公司;山羊抗兔FITC标记二抗购自北京全式金生物技术有限公司。
1.2 未成熟SCs的分离与单细胞悬液制备牛场采集的新生牛新鲜睾丸组织用含有青霉素、链霉素和庆大霉素的PBS冲洗,用75%酒精浸泡10 min后,转移至无菌培养皿中,在超净工作台中用眼科剪剪开表面被膜以及白膜,用异物针小心剥离曲细精管,再将其转移至盛有5×双抗PBS清洗3~4次;充分剪碎后转移至15 mL离心管中,加入5倍体积1.0 g/L的Ⅳ型胶原酶,于37℃水浴中消化30 min,期间每3 min取出振荡1次。消化结束后1 500 r/min 离心10 min,弃去上清液;采用相同条件将上一步取得的悬浊液用0.25%胰蛋白酶消化15 min并用培养液终止,将未成熟SCs-生殖细胞团悬液转移到15 mL无菌离心管中,1 500 r/min离心10 min,弃掉上清液,加入含2×双抗的PBS冲洗;200目尼龙网过滤掉其他物质,滤液1 500 r/min离心5 min;细胞沉淀用含10%血清的DMEM/F-12重悬,调整密度接种至培养皿中,并置于37℃、5% CO2条件下培养箱中培养。
1.3 未成熟SCs的纯化及传代培养采用差速贴壁法纯化所分离的细胞。培养4 h后,弃去上清,加入新的完全培养基培养24 h,待细胞贴壁后,加入0.25%的胰酶进行消化,细胞稍有脱落即刻加入新的完全培养基终止消化,待细胞长满底壁,重复上述操作3~4次。由于睾丸曲细精管中只有精原细胞和SCs,在差速贴壁过程中,4 h内精原细胞无法贴壁生长,因此可以保证分离纯化到的细胞多为睾丸未成熟SCs。
1.4 SCs形态学鉴定
1.4.1SCs的福尔根染色 待二代SCs长满后,吸去培养液,用PBS清洗3次后,按试剂盒所附说明书对所分离细胞进行福尔根染色。操作程序为:用Carnoy液固定细胞20 min;弃去固定液;用蒸馏水摇床浸洗1 min;将细胞与弱酸工作液(预热)放置于60℃水浴中孵育8 min;弃去工作液并用蒸馏水摇床浸洗2 min;加入Schiff Reagent,室温避光染色45 min;用现配的SO2水工作液摇床浸洗3次,每次90 s;经梯度乙醇(乙醇含量:70%,80%,95%,100%)依次脱水后,在显微镜下观察并拍照。
1.4.2SCs标志性基因的RT-PCR鉴定 待SCs长满后,吸去培养液,用PBS清洗2次后,加入细胞裂解液,提取细胞总RNA,并利用PrimeScript RT试剂盒将其反转录成cDNA,聚合酶链式反应扩增SCs标志基因SCF、GDNF和BMP4;引物由Primer premier 5.0软件设计,由生工生物工程(上海)股份有限公司合成。引物序列见表1。

表1 RT-PCR各基因引物序列、产物长度及基因ID
RT-PCR体系(20 μL):2×PCR mix 10 μL、上、下游引物(10 mol/L)各0.5 μL,cDNA模板1 μL,ddH2O 8 μL。反应条件:95℃预变性5 min,95℃变性30 s;60℃退火30 s;72℃延伸30 s,40个循环,72℃延伸10 min,4℃保存。RT-PCR产物进行1.5%琼脂糖凝胶电泳。
1.5 未成熟SCs的免疫荧光染色将细胞融合度为85%的原代细胞以50%细胞融合度传至6孔板,培养24 h后,吸去培养液,并用PBS清洗2次,按试剂盒所附说明书对所分离的细胞进行免疫荧光染色,染色程序为:加入提前预冷(―20℃)的冰甲醇固定细胞25 min,弃去液体;加入0.1% Triton X-100溶液室温避光处理10 min,弃去液体;加入5%脱脂奶粉封闭30 min,弃去封闭液;分别在孔中加入已稀释的GATA4、FASL和KRT-18的一抗,4℃孵育过夜;弃去液体;加入已稀释的FITC标记二抗,37℃恒温箱孵育2 h;加入0.5% PI避光处理5 min。以上步骤更换溶液时均在摇床上用PBS洗涤3次,每次5 min。染色完毕后,置荧光显微镜下观察并拍照。
2 结果
2.1 未成熟SCs体外培养特性经差速贴壁法纯化后,此时绝大部分细胞为未成熟SCs。刚接种的未成熟SCs体积较小,呈圆形或椭圆形,折光性强,直径约10 μm。约2 h后,所分离细胞开始发生极化,4 h后可观察到部分未成熟SCs胞体伸展,细胞四周伸出突起,形态不规则,此后胞质逐渐增大。培养 48 h后,细胞成膜状平铺于培养皿底,胞质中可见颗粒状物质或空泡,相邻细胞发生交错连接。随着培养时间的延长,睾丸未成熟SCs的折光性逐渐降低。高倍镜下观察可见,所分离的未成熟SCs核仁明显,呈圆形或椭圆形,位于细胞中间或稍偏位。镜下观察结果表明,分离培养得到的细胞基本符合睾丸SCs的形态学特征(图1)。

A.经差速贴壁法纯化后的未成熟SCs体外培养48 h(×400); B.体外培养1周后的未成熟SCs(×200)
2.2 未成熟SCs的福尔根染色相差显微镜下观察福尔根染色后的未成熟SCs发现,胞质不着色,细胞核淡染,核仁形态明显,卫星核小体位于核仁两侧,呈紫红色(图2)。试验结果表明,分离培养得到的细胞符合SCs的生物学特征。
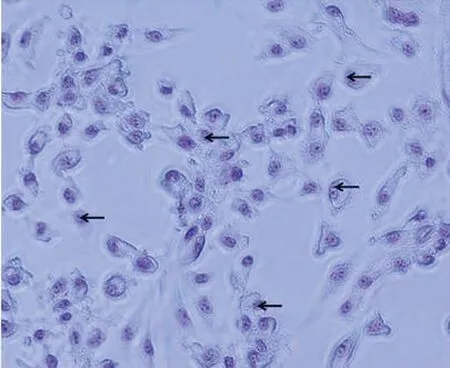
图中箭头所指为卫星核小体
2.3 SCs特异性表达基因的RT-PCR骨形态发生蛋白4 (bone morphogenetic protein 4,BMP4)、干细胞因子(KIT ligand,KITLG/SCF)、胶质细胞源性神经营养因子(glial cell derived neurotrophic factor,GDNF),是未成熟SCs特异性分泌的生长因子[6],在未成熟SCs参与维持精子发生过程中发挥着重要作用。RNA产物电泳结果显示,提取的RNA有明显的18S和28S条带,D260/D280在1.8~2.1,无DNA和蛋白质污染,可用于下一步试验(图3)。反转录后,利用RT-PCR法检测SCs的标志性基因,结果显示,所分离细胞显著表达SCs特异性基因SCF、GDNF和BMP4(图4)。说明分离的细胞是SCs。

1~4.为二代未成熟支持细胞RNA

M.DL2000 DNA Marker;1.BMP4;2.SCF;3.GDNF
2.4 SCs特异性表达基因的免疫荧光染色为了进一步鉴定所分离细胞的类型及纯度,选择SCs特异性表达的基因GATA结合蛋白4(GATA binding protein 4,GATA4)和FAS配体(fas ligand,FASL)进行细胞免疫荧光染色。GATA4是影响生殖功能的转录因子之一。研究表明,GATA4可参与哺乳动物组织生长、发育、分化和基因表达过程[7],如雄性性别分化、类固醇激素合成和细胞存活等多个生殖轴的生理活动,其在SCs中高表达[8]。FASL是结合到死亡受体TNFRSF6/FAS的细胞因子,对精子的发生起重要作用,能够抑制淋巴细胞侵入生精小管,避免生殖细胞诱发自身免疫反应[9]。在睾丸组织中,仅SCs表达FASL。免疫荧光染色法结果显示,所分离的细胞均表达SCs特异性蛋白FASL和GATA4,说明所分离的细胞是SCs且纯度较高。

A.基因染色(绿色);B.PI(核标记物)染色(红色);C.合并图(×100)
2.5 未成熟SCs特异性标志基因的免疫荧光染色为了鉴定所分离SCs成熟度,选择未成熟SCs特异性稳定标志物KRT-18进行细胞免疫荧光染色。角蛋白18(keratin 18,KRT-18)是中间丝的标志物,在人的睾丸中,它被用来识别生精小管中的未成熟SCs[9]。在鼠、猪等物种中,曾被作为未成熟SCs鉴定的标志物之一[10-11]。未成熟SCs特异性表达基因KRT-18的免疫荧光染色结果显示,几乎所有的细胞均呈KRT-18阳性(图6)。上述结果表明,所分离的SCs为未成熟SCs且纯度很高,可用于后续研究。
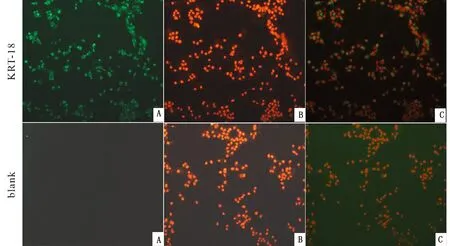
A.基因染色(绿色);B.PI(核标记物)染色(红色);C.合并图(×200)
3 讨论
随着对影响雄性繁殖性能因素研究的加深,SCs也越来越受到关注。众多研究表明,睾丸SCs是维持睾丸代谢和精子发生的重要细胞之一。在精子发生过程中,SCs不但为生殖细胞提供特殊的结构支持和免疫保护空间(血睾屏障),以维持曲细精管内环境的稳态并促进生殖细胞成熟,还能提供精子发生所必需的营养物质和激素信号等物质,以保障精子发生过程的高效稳定[12-14]。不仅如此,SCs具有很强的吞噬能力,能够吞噬退化的生精细胞[15]。由于其在精子发生过程中的这些特殊支持保护作用,SCs又被称为“保姆”细胞。没有SCs的物理和代谢上的支持,生殖细胞的分化、减数分裂和转化为精子的过程就不会发生。研究表明,成熟SCs在增殖分化的过程中会逐渐丧失增殖分化的能力,而未成熟SCs的数量和功能将影响动物个体的生精效率和繁殖性能,因此未成熟SCs在动物生殖研究中作为一种必要的试验材料具有重要的研究价值。
未成熟SCs是一种适应性很强的细胞,国内外关于未成熟SCs分离和培养的报道很多[16-19]。研究表明,不同的分离纯化方法对未成熟SCs的获得量及最终状态影响很大。孙秀娟[20]通过对比分别消化犊牛的睾丸组织与曲细精管后未成熟SCs有效细胞数的不同,发现消化曲细精管能更好地满足未成熟SCs的分离试验。王雪等[21]通过优化未成熟SCs的纯化方式,发现未成熟SCs体外培养至第10代即进入平台生长期,而于磊等[22]通过优化两步酶法消化睾丸组织,最终将未成熟SCs体外培养至20代。本试验结合前人的分离纯化方法,选取曲细精管进行第一步分离,同时缩短两步酶消化的时间,既保证了未成熟SCs的获得量,也减少了酶对于细胞的损害,增加了未成熟SCs的存活率,实验室分离的未成熟SCs体外培养至8代左右增殖进入平台期。本试验中,原代未成熟SCs传代时,经含0.25% EDTA的胰酶消化2 min即可消化完全。刚传代的未成熟SCs生长速度快,以50%密度传代,24 h即可铺满整个细胞培养板,低密度传代的原代未成熟SCs仍保持原来的生物活性,但形态会发生一定改变,这可能与低密度的未成熟SCs间不能快速的构成交错连接有关,因此,建议牛原代未成熟SCs传代稀释比例为1∶4~1∶2。原代未成熟SCs传至5代后逐渐发生纤维化,细胞生长速度减缓,细胞质边缘开始出现拉丝状,且细胞质空泡增多,这一结果与姚玲等[23]的研究结果一致。于磊等[22]通过对未成熟SCs长期培养,发现未成熟SCs体外培养第15代时仍具有完整的二倍体核型。但就细胞状态而言,随着传代次数的增加,细胞纤维化程度逐渐增加,传代时间间隔也逐渐延长,因此,5代以内的细胞是相对良好的试验研究材料。
未成熟SCs的鉴定方法有很多种,如根据未成熟SCs特殊形态结构的有无进行鉴定的HE染色、油红O染色、细胞核型分析、福尔根染色和透射电镜观察,以及根据睾丸内不同细胞标志性基因表达的有无进行鉴定的RT-PCR及免疫荧光染色等。福尔根染色法、标志性基因的RT-PCR和免疫荧光染色是较常用的未成熟SCs鉴定方法[24-25]。本试验通过对所分离细胞进行福尔根染色、标志性基因RT-PCR以及免疫荧光染色,证明所分离细胞为未成熟SCs,且纯度较高,可满足下一步试验需求。
综上所述,本试验成功分离了新生中国西门塔尔牛未成熟SCs,分离方法简单易行,所得细胞形态均匀,生长状态良好,纯度较高,对新生牛睾丸未成熟SCs的相关研究有良好的借鉴意义,可为其他物种的未成熟SCs的分离培养鉴定提供参考,也为丰富中国西门塔尔牛精子生成相关基因的功能验证提供了依据。

