山羊支原体山羊肺炎亚种在2种培养基上的生长特性比较
张晓亮,马水燕,郝华芳,陈胜利,颜新敏,马丽娜,刘永生,储岳峰
(中国农业科学院 兰州兽医研究所 家畜疫病病原生物学国家重点实验室,甘肃 兰州 730046)
山羊支原体山羊肺炎亚种(Mycoplasmacapricolumsubsp.capripneumoniae, Mccp)是引起山羊传染性胸膜肺炎(contagious caprine pleuropneumonia, CCPP)的病原体[1],于1976年首次在肯尼亚成功分离得到[2],我国于2007年分离出1株[3]。CCPP是世界动物卫生组织(OIE)所列必须法定报告的疫病之一[4],对山羊养殖业危害严重,山羊感染该病无年龄和性别差异,以发热、咳嗽、呼吸困难、纤维素性肺炎和胸膜炎为主要特征[5]。近年来,该病的报道逐渐增多,流行范围扩大,对畜牧业造成严重影响[6-7],特别是近年来有Mccp感染藏羚羊和阿拉伯羚羊等野生有蹄类动物传播的报道[8-9],该病对无病地区和野生动物的威胁越来越值得关注,因此有效预防控制Mccp感染成为亟需解决的问题。
疫苗免疫是预防控制CCPP发生的一个重要手段[10]。自1976年证实Mccp是CCPP病原以来,Mccp菌体灭活疫苗的研究已在多个国家和地区研制成功并商品化使用[10]。但Mccp培养时营养要求苛刻,除基础所需的营养物质外,还需加入一定量的动物血清从而提供支原体生长代谢过程中必需的胆固醇物质。目前常用的培养基中血清含量普遍在20%,且Mccp存在生长时间长、活菌滴度低等问题,不仅使疫苗生产成本高、生产工艺复杂,也增加了异源血清对羊体过敏反应的风险,严重限制了CCPP疫苗的推广应用。因此开发生长快、产量高、成本低的适合Mccp制苗用的培养基成为CCPP疫苗研究和生产中急需解决的问题。本试验针对目前常用培养基中的不足,研制了一种低血清培养基,测定了Mccp 2个疫苗用菌株在2种不同支原体培养基中的活菌滴度曲线和蛋白浓度,为下一步改进CCPP灭活疫苗生产工艺、降低生产成本、提高安全性和有效性奠定基础。
1 材料与方法
1.1 主要试剂PPLO Broth(购自BD公司)、丙酮酸钠(购自Macklin公司)、灭活马血清(购自Gibco)、酚红(购自Sigma公司)、青霉素、葡萄糖、酵母浸出液等均为国产分析纯试剂。BCA蛋白定量试剂盒(购自Thermo公司)。
1.2 菌株和培养基山羊支原体山羊肺炎亚种M1801株与M1601株由中国农业科学院兰州兽医研究所国家重点试验室保存。
改良Thiaucourt’s肉汤培养基(MTB)配方:PPLO Broth(21 g/L)、25%酵母浸出液(100 mL/L)、丙酮酸钠(2 g/L)、葡萄糖(2 g/L)、1% 酚红(2.5 mL/L)、马血清(200 mL/L)、青霉素(10万IU/L),用1mol/L NaOH将pH调至7.4左右。
5%马血清HF3培养基含马血清(50 mL/L)、1% 酚红(2.5 mL/L)、青霉素(5万IU/L)等成分,用1 mol/L NaOH将p H调至7.4左右,由中国农业科学院兰州兽医研究所国家重点试验室配制保存。
1.3 菌液的培养将冻存的Mccp M1801和M1601菌株与培养基以1∶9的比例无菌操作接种于4.5 mL上述2种不同的液体培养基,置37℃培养箱复苏。待培养基变黄后,分别连续传代3次,待其生长稳定之后,将菌液与2种培养基按照相同的比例再传代,作为待测菌液,置37℃培养箱静置培养。
1.4 颜色变化和pH值测定在待测菌液0,6,12,18,24,36,48,72,96和120 h取样,取每个时间点的菌液1 mL于15 mL离心管内,用pH计测定菌液的pH值,并观察颜色变化。
1.5 CCU的测定对待测菌液的0,6,12,18,24,36,48,72,96和120 h样品进行CCU测定。取96孔细胞培养板,分别将2种培养基以每孔180 μL的量分装,第1孔加入待测菌液20 μL,吹打均匀后,吸取20 μL加入第2孔,依次重复以上操作至第10孔,吹打混匀后吸取20弃去,由此,待测菌液被稀释成10-10~10-1不同的稀释倍数,隔开第11孔,第12孔为空白培养基对照。每个时间点分别做8个平行孔,将细胞培养板置于湿盒内,37℃温箱培养,每天观察细胞培养板中培养基的颜色变化,直至颜色不发生变化为止,根据MPN表确定待测菌液的生长滴度,用CCU表示,最后以取样时间点为横坐标,logCCU为纵坐标,绘制生长曲线。
1.6 蛋白浓度的测定取每个时间点的菌液1 mL于EP管内,―40℃冻存。待所有CCU测定完成后,取出菌液后12 000 r/min离心10 min,将上清弃去,吸取适量0.85%生理盐水吹打沉淀使其悬浮混匀,12 000 r/min离心10 min后以同样的方法洗涤4次,离心后弃去上清,用200 μL PBS悬浮沉淀,最后用BCA蛋白定量分析试剂盒测定相应时间点的蛋白浓度。以取样时间点为横坐标,菌液蛋白浓度为纵坐标,绘制蛋白浓度曲线。
2 结果与分析
2.1 培养基颜色及pH值变化结果用1 mol/L的NaOH将配制的2种液体培养基的pH值调至7.4左右,发现HF3的颜色要比MTB的偏黄一些(图1)。待2种培养基上的菌液在37℃培养箱培养2~3 d,颜色不再变化时,比较发现MTB培养基颜色变化更为明显(图2)。待传代到F4代后,测定以上10个时间点的pH值变化(图3),发现2个菌株在MTB培养基中培养时pH值下降速度比在HF3培养基更快。

图1 2种培养基颜色比较

图2 2种培养基培养Mccp后颜色变化
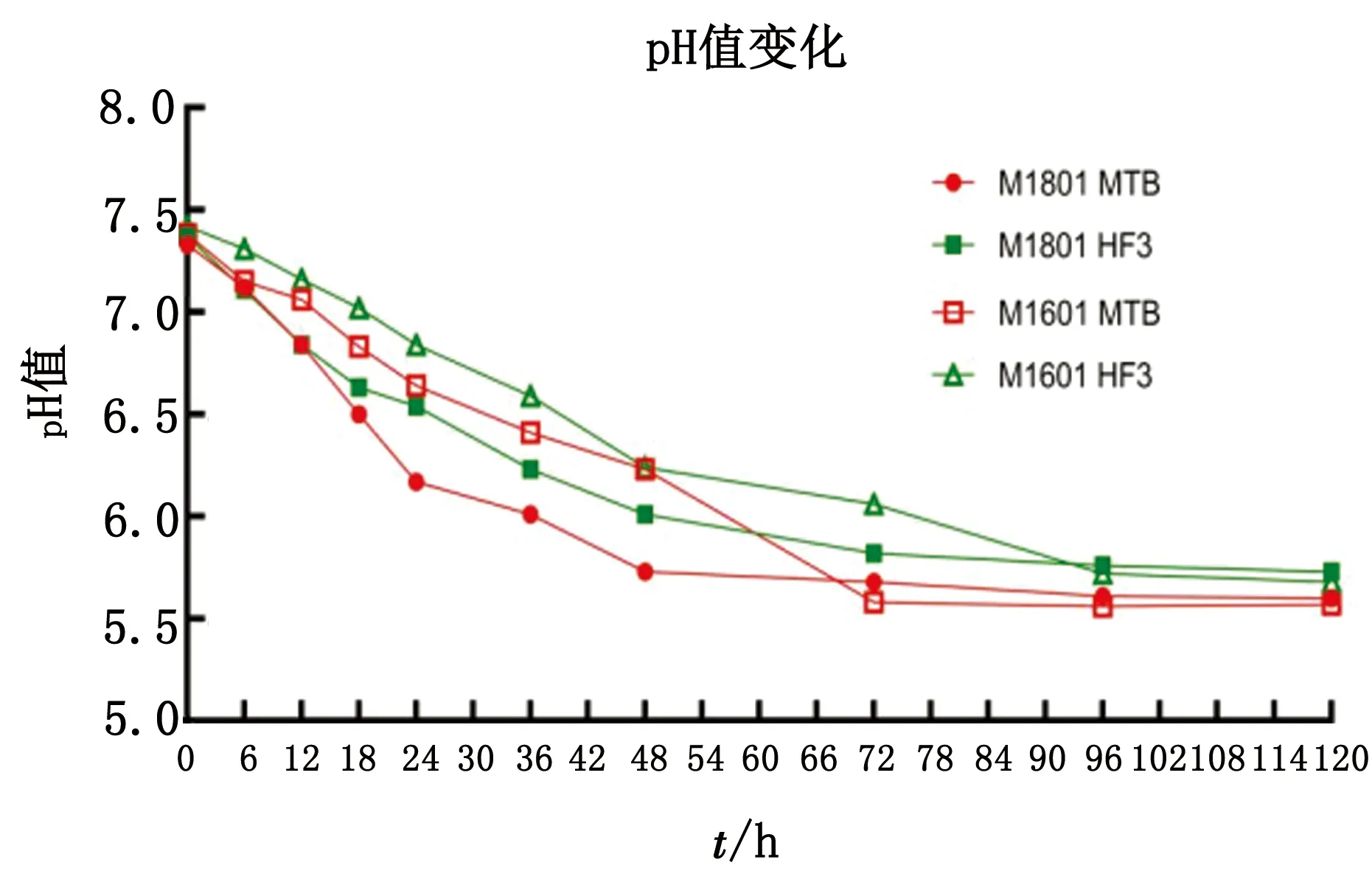
图3 M1801与M1601在2种培养基中pH值变化曲线
2.2 CCU的测定结果根据支原体CCU测定标准操作规范,测定10个时间点的CCU,发现M1801在MTB中0~48 h CCU基本维持在1.40×109~1.42×1010CCU/mL,之后逐渐下降,而在HF3中0~72 h CCU都能维持在1.40×109~2.14×1010CCU/mL,之后才逐渐下降;同时,观测发现M1601在MTB中0 ~72 h CCU基本维持在2.91×109~1.26×1010CCU/mL,然后逐渐下降,而在HF3中0 ~96 h CCU基本维持在1.06×109~1.42×1010CCU/mL,之后才出现下降趋势。可见在HF3中,Mccp维持较高滴度的时间更长。
2.3 蛋白质量浓度的测定结果测定10个时间点的蛋白质量浓度,发现M1801在MTB中0~96 h蛋白质量浓度从18.03 mg/L一直增长到103.64 mg/L,之后呈现下降趋势,在HF3中0~72 h蛋白质量浓度从22.37 mg/L一直增长到172.16 mg/L;同样,M1601在MTB中0~72 h蛋白质量浓度从23.60 mg/L 一直增长到138.64 mg/L,之后逐渐下降,在HF3中0~96 h蛋白质量浓度从31.21 mg/L一直增长到184.21 mg/L,随后开始下降。初步说明,在HF3中,Mccp2种菌株的菌体蛋白质量浓度均有所提高。
图4 M1801与M1601在2种培养基中log CCU变化曲线
图5 M1801与M1601在2种培养基中蛋白浓度变化曲线
3 讨论
目前,预防 Mccp 感染的主要措施是使用灭活疫苗进行免疫[11],又因为疫苗中抗原的含量是决定灭活疫苗免疫效力的主要因素之一,准确掌握制苗菌株的生长曲线是疫苗生产工艺的重要环节,据此才能获得最高的抗原产量[12-13]。菌体蛋白含量是CCPP灭活疫苗研制过程中常用的抗原定量技术,但培养时间过长,活菌滴度又会下降,导致抗原中死细胞过多,影响抗原质量。因此活菌滴度和菌体蛋白含量综合评价才能获得最佳的抗原收获时间。另一方面,由于Mccp营养要求高且生长缓慢,导致CCPP灭活疫苗生产重存在抗原产量低、生产工艺复杂、成本高等缺陷,使得CCPP灭活疫苗难以得到推广。因此,急需研发CCPP产量高且成本低的制苗用培养基。
为验证Mccp菌株新改良培养基上的生长情况,测评其效果,从而筛选出适合大批量制作灭活疫苗的培养基。本试验以酚红作为指示剂,利用Mccp在生长代谢过程中分解葡萄糖产酸,使得培养基颜色变黄,据此比较Mccp菌株在MTB和HF32种液体培养基上的生长情况。结果表明,Mccp M1801和M1601在HF3培养基中pH下降更慢,活菌滴度也高于MTB培养基,且平台期维持时间更长,在培养120 h后仍有较多活菌数。HF3培养基培养的蛋白浓度也略高于MTB,在本次试验中,M1801在HF3中培养时的收获时间应控制在72 h之前,72 h 后菌体进入衰亡期,并且由于pH过低,蛋白含量也急剧下降。同理,M1601在HF3中培养时应控制在96 h之前收获菌体由此可初步说明HF3培养基更有利于Mccp的生长,可用于灭活疫苗生产过程中菌体的培养,从而使成本更为低廉。
支原体在体外培养时营养条件较其他细菌要求更高,除了供给所必需的胆固醇和酵母等营养物质外,还要添加一定的马血清或小牛血清,所以培养基成本较为昂贵,这使得大批量制苗的成本大大提高。目前常用的Mccp培养基血清含量普遍在20%,本试验根据Mccp的生长特性,对不同的碳源、氮源等营养成分进行优化筛选,新研制的培养基HF3仅含5%马血清,同时添加了一些促进支原体代谢、促进蛋白质、脂类等合成的成分和一些生长所需氨基酸,不仅使培养基成本降低50%左右,活菌滴度和抗原产量还有所提高,且减少了异源血清引起的免疫干扰因素,为降低Mccp培养基成本,改进Mccp疫苗质量奠定基础。
当然,本试验在测定生长曲线时,由于初始菌液未稀释,0 h时接种的菌液浓度过高,所以绘制的曲线没有明显的迟缓期和对数期,不能明确体现Mccp的生长曲线特征。但在目前CCPP灭活疫苗生产过程中培养菌液的接种量为10%,所以本次试验在接种量上是符合实际情况的。另一方面,本次试验所测得的生长曲线是在实验室阶段通过小批量培养测得的数据,可作为规模山羊支原体山羊肺炎亚种的培养或发酵罐生产的参考依据,但扩大培养规模后的生长情况尚待进行进一步研究,从而获得更准确直接的数据和结论。另外,本次试验是验证HF3改良培养基培养效果的初步试验,试验方案中未进行菌株免疫原性检测,在后续试验中,将进一步研究培养基成分的变化是否导致了菌体免疫原性的变化,对改良培养基的有效性进行检验。

