表达猪圆环病毒2型Cap蛋白重组耐热新城疫病毒的构建及免疫原性
李 丽,赵 康,张 媛,王红琳,罗青平,邵华斌,2,潘兹书,温国元,2*
(1.湖北省农业科学院 畜牧兽医研究所,湖北 武汉 430064;2.农业部畜禽细菌病防治制剂创制重点实验室,湖北 武汉 430064;3.武汉大学 生命科学学院,湖北 武汉 430074)
猪圆环病毒2型(porcine circovirus type 2,PCV2)属于圆环病毒科,为单股负链闭合环状DNA病毒,是目前所发现最小的动物病毒[1]。PCV2是引起断奶仔猪多系统衰竭综合征(postweaning multisystemic wasting syndrome,PMWS)的重要病原[2-4],发生PMWS疾病的猪群死亡率达5%~30%[5]。PCV2的感染会导致猪群免疫力下降,造成严重的免疫抑制。其和细小病毒、猪肺炎支原体、猪呼吸与繁殖障碍综合征病毒等病原共同感染使猪群产生圆环病毒相关疾病[6-8],给全球养猪业造成了巨大的经济损失[ 2,9-10]。PCV2在PK-15细胞上增殖滴度较低,且不引起细胞病变,给常规灭活疫苗的研发与生产带来很大的困难[11],因此,PCV2基因工程疫苗的研发是当前研究的热点之一。
PCV2基因组全长约1.7 kb,有2个主要的功能性开放阅读框(opening reading frame,ORF)。ORF1编码2个滚环复制相关蛋白(Rep和Rep′)[12],ORF2编码大小约为28 kDa的PCV2 衣壳蛋白Cap[13]。研究表明Cap蛋白是PCV2的主要免疫原蛋白,包含高度保守的抗原表位,能刺激机体产生PCV2特异性中和抗体[7-8]。Cap蛋白是用于研发PCV2基因工程疫苗的首选蛋白[14]。
新城疫病毒(Newcastle disease virus,NDV)属于副黏病毒科腮腺炎病毒属,为单股负链RNA病毒。随着反向遗传操作系统的发展,重组NDV已成为一类研究深入且应用前景广阔的基因工程载体疫苗。目前已经有多种病毒的保护性抗原基因在NDV中得到高效表达[15-17]。在哺乳动物体内存在的免疫力和母源抗体不会影响NDV的复制,NDV在许多动物模型中具有较高的安全性[18]。由于常规低毒力活疫苗热稳定性差,在使用过程中冷冻保藏活疫苗的成本投入较高,且常常因为保存不当影响疫苗使用效果。以V4、HB92、TS09-C等为代表的NDV毒株具有独特的耐热特性,以其制备的耐热活疫苗应用前景广阔[19]。本研究以NDV TS09-C耐热株为载体,构建了表达PCV2 Cap 蛋白的重组病毒,并对其生物学特性和免疫原性进行了研究。
1 材料与方法
1.1 毒株、细胞及实验动物PCV2 HBZX株、NDV-全长克隆质粒pTS09-C、辅助质粒pVAX-NP、pVAX-P和pVAX-L、表达T7 RNA聚合酶的重组痘病毒vTF7-3、BHK-21细胞及猪圆环病毒阳性血清(兔源)由湖北省农科院畜牧兽医研究所保存;鸡源NDV阳性血清购自中国农业科学院哈尔滨兽医研究所;9~11日龄SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。
1.2 主要试剂PfuUltra Ⅱ Fusion HS DNA Polymerase购自Agilent公司;In-fusion Clone Kit购自Clontech公司;TPCK-胰酶购自Sigma公司;血清辣根过氧化物酶(HRP)标记的羊抗兔IgG、FITC标记的羊抗鸡IgG抗体和FITC标记的羊抗兔IgG抗体均购自北京博奥森生物技术有限公司;SDS-PAGE凝胶试剂盒、DAB显色试剂盒购自康为世纪生物科技有限公司;PCV2灭活疫苗和ELISA抗体检测试剂盒均购自武汉科前生物股份有限公司。
1.3 重组质粒的构建提取PCV2 HBZX株的基因组DNA,PCR扩增(Cap-F,Cap-R)删除核定位信号(nuclear localization signal,NLS)序列的基因片段Cap/N。通过引物自延伸的方法扩增(TPA-F,TPA-R)组织纤溶酶原激活物信号肽序列(the tissue plasminogen activator signal peptide,tPAs),将Cap/N和tPAs基因产物进行重叠延伸PCR,得到基因序列tPAs-Cap/N。为了将tPAs-Cap/N以单独编码框的方式插入rTS09-C载体中,通过PCR扩增(TS-Cap-F,TPA-R)将TS09-C的基因终止序列(GE)和基因起始(GS)序列分别添加到tPAs-Cap/N序列的两端。以质粒pTS09-C为PCR模板,PCR扩增(TS-F,TS-R)出载体大片段,通过In-fusion酶同源重组将包含有GE和GS序列的tPAs-Cap/N片段和载体大片段相连接[20]。连接产物转化DH5α感受态细胞,挑取单菌落进行酶切鉴定及测序分析,重组质粒命名为pTS-tPAs-Cap/N(用于质粒构建的引物序列见表1)。
表1 用于构建重组质粒pTS-tPAs-Cap/N的引物序列
1.4 病毒的拯救采用脂质体转染法,将重组质粒pTS-tPAs-Cap/N和3个辅助质粒按照5.00,2.50,1.25,1.25 μg的比例共转染至已感染vTF7-3的BHK-21细胞[19,21]。转染后6 h,PBS洗涤细胞2次,加入含有1%双抗和0.2 mg/L TPCK-胰酶的DMEM-培养基。37℃培养3 d后,收获细胞培养物,反复冻融3次,将其按照100 μL/枚的剂量接种SPF鸡胚。37℃孵育5 d后,收取尿囊液,测定其血凝(hemagglutinin,HA)效价[22],对HA阳性样品进行RT-PCR检测及测序鉴定。鉴定正确的病毒尿囊液经过0.22 μm孔径滤器过滤2次以除去痘病毒,在SPF鸡胚上传3代后,分装保存于-80℃。
1.5 Western blot检测重组NDV以0.1个感染复数(MOI)的剂量接种BHK-21细胞,37℃培养至少量细胞出现轻微病变时,用细胞刮收集细胞,进行SDS-PAGE,电转至硝酸纤维素滤膜,3% BSA封闭过夜,以兔抗PCV2血清为一抗,HRP标记羊抗兔抗体为二抗先后进行孵育,最后以DAB显色,观察目的条带。
1.6 间接免疫荧光染色重组NDV以0.1 MOI的剂量接种BHK-21细胞,37℃培养至少量细胞出现轻微病变时,用PBS洗涤3次,以预冷的固定液(丙酮∶甲醇=1∶1)于-20℃固定细胞30 min。弃去固定液,用3% BSA封闭细胞1 h。封闭结束后先后以鸡抗NDV阳性血清和兔抗PCV2血清为一抗,以FITC标记的羊抗鸡抗体和PE标记的羊抗兔IgG抗体为二抗,最后以DAPI进行细胞核染色,在激光共聚焦显微镜下观察拍照分析。
1.7 重组病毒的生长曲线测定将重组病毒进行10倍梯度稀释,感染培养于96孔板的单层BHK-21细胞(100 μL/孔),记录细胞病变情况,按照Reed-Muench公式计算病毒的TCID50。将重组病毒以0.1 MOI 感染BHK-21细胞,分别于感染后24,48,72,96 h收集细胞培养上清液,测定其TCID50值,绘制重组病毒的生长动力学曲线。
1.8 病毒的耐热特性将重组NDV尿囊液分装于EP管中,100 μL/管,置于56℃进行热处理,分别在5,15,30,60,90,120 min时间段取出尿囊液,迅速置于冰上。将热处理后的重组病毒分别接种SPF鸡胚3枚,37℃孵育5 d,收获尿囊液测定其HA效价。若鸡胚尿囊液HA效价≥24,判定NDV具有鸡胚感染性,反之则无鸡胚感染性。
1.9 致病性分析将重组NDV做10倍梯度稀释,分别接种SPF鸡胚4枚,弃去24 h内死亡的鸡胚,记录鸡胚的死亡时间,计算重组病毒的鸡胚最小致死量的平均死亡时间(MDT/MLD)。
2.0 重组病毒的免疫原性测定选取5周龄健康雌性BALB/c小鼠20只,分为4组即A、B、C、D组,每组5只。A组5只小鼠通过腹腔注射的方式免疫rTS-tPAs-Cap/N,注射剂量0.2 mL/只(107.0EID50/mL);B组5只小鼠通过肌肉注射的方式免疫rTS-tPAs-Cap/N,剂量同于A组;C组5只小鼠通过肌肉注射方式免疫PCV2灭活疫苗,剂量为0.2 mL/头份;D组为未免疫组。首免2周后,对每组小鼠断尾取血,并分离血清。同时对4组小鼠进行第2次免疫,途径和接种剂量不变。二免后2周,断尾采集各组小鼠的血液,分离血清。使用PCV2 ELISA抗体检测试剂盒检测血清抗体,在酶标仪读取D450 nm的吸光值,参考试剂盒说明判定被检样品的抗体水平。
2 结果
2.1 重组全长质粒的构建与鉴定通过设计特异性引物分别扩增tPAs和Cap/N基因(删除Cap基因的NLS序列,即N端的123个碱基),将2个基因片段经过重叠延伸PCR扩增得到tPAs-Cap/N片段。将tPAs-Cap/N克隆于全长质粒pTS09-C中,获得重组全长质粒pTS-tPAs-Cap/N(图1)。对重组质粒进行XbaⅠ酶切鉴定,结果如图2。将鉴定正确的重组质粒进行全长序列测定,测序结果完全正确,表明重组全长质粒pTS-tPAs-Cap/N构建成功。
图1 重组NDV rTS-tPAs-Cap/N的基因组结构示意图
M.DL15000 DNA Marker;1.对照质粒pTS09-C的XbaⅠ酶切鉴定;2.重组质粒pTS- tPAs-Cap/N的XbaⅠ 酶切鉴定
2.2 重组病毒的拯救通过脂质体法将重组全长质粒pTS-tPAs-Cap/N和3个辅助质粒共转染预感染vTF7-3的BHK-21细胞,待细胞出现病变后,收获细胞液,反复冻融3次,接种SPF鸡胚。对收获的鸡胚尿囊液进行HA效价测定,将HA阳性的尿囊液进行NDV RT-PCR扩增,电泳结果如图3所示,被检尿囊液均为NDV阳性。对PCR产物进行序列测定,结果与预期一致,表明重组病毒rTS-tPAs-Cap/N构建成功。
M.DL2000 DNA Marker;1~3.3个重组病毒rTS-tPAs-Cap/N的PCR条带
2.3 重组病毒表达Cap蛋白的鉴定重组病毒rTS-tPAs-Cap/N感染BHK-21细胞后,分别以Western blot法和间接免疫荧光法鉴定Cap蛋白的表达。Western blot检测结果如图4所示,以PCⅦ阳性血清为一抗,重组病毒感染的BHK-21细胞显示出特异性条带,与预期大小(21 kDa)基本一致。间接免疫荧光检测结果如图5所示,rTS-tPAs-Cap/N感染的细胞内同时检测到了NDV蛋白和Cap蛋白的表达,对照空白细胞均未检测到阳性信号。结果证实重组病毒rTS-tPAs-Cap/N可在BHK-21细胞内高效表达Cap蛋白。
M.蛋白质Marker;1.重组病毒pTS-tPAs-Cap/N感染的BHK-21细胞;2.BHK-21细胞
图5 重组病毒rTS-tPAs-Cap/N感染BHK-21细胞后的Cap蛋白表达(400×)
2.4 重组病毒的生物学特性为研究在NDV TS09-C株的P和M基因之间插入Cap基因是否改变其生物学特性,测定了重组病毒的鸡胚增殖滴度、细胞生长曲线、耐热特性和致病性,并与亲本rTS09-C株进行了比较。结果显示,重组病毒rTS-tPAs-Cap/N与亲本株有相近的增殖特性,其鸡胚增殖滴度为108.25EID50/mL,感染BHK-21细胞后于48~72 h达到平台期,滴度为106.75TCID50/mL(图6)。重组病毒rTS-tPAs-Cap/N经过56℃处理150 min后仍具有鸡胚感染性,保持了亲本株耐热的特性,而LaSota株经56℃处理60 min已经失去鸡胚感染性(表2)。重组病毒rTS-tPAs-Cap/N的MDT/MLD值大于120 h,保持了其弱毒特性。上述结果表明,Cap基因的插入未显著改变TS09-C株的耐热、弱毒和高增殖滴度的特性。
表2 病毒鸡胚耐热特性测定
图6 重组病毒rTS-tPAs-Cap/N在BHK-21细胞的生长曲线
2.5 重组病毒的免疫原性为评估重组病毒rTS-tPAs-Cap/N诱导机体产生针对PCV2的免疫反应,以小鼠为动物模型,分别通过肌肉(i.m)和腹腔(i.p)注射2种途径进行重组病毒免疫,同时设置灭活疫苗(inactivated vaccine)和空白(control)2个对照组。分别在首免和二免2周后采集血清,以ELISA法测定PCV2抗体水平。除对照组外,其余3组均为PCV2抗体阳性。具体抗体水平如图7所示,与对照组相比,免疫重组病毒rTS-tPAs-Cap/N诱导小鼠产生了较高的PCV2抗体反应,但略低于灭活疫苗组。腹腔途径的免疫效果优于肌肉途径。二免并未显著增强各试验组的抗体反应。因此,重组病毒rTS-tPAs-Cap/N免疫小鼠可诱导较强的PCV2抗体反应。
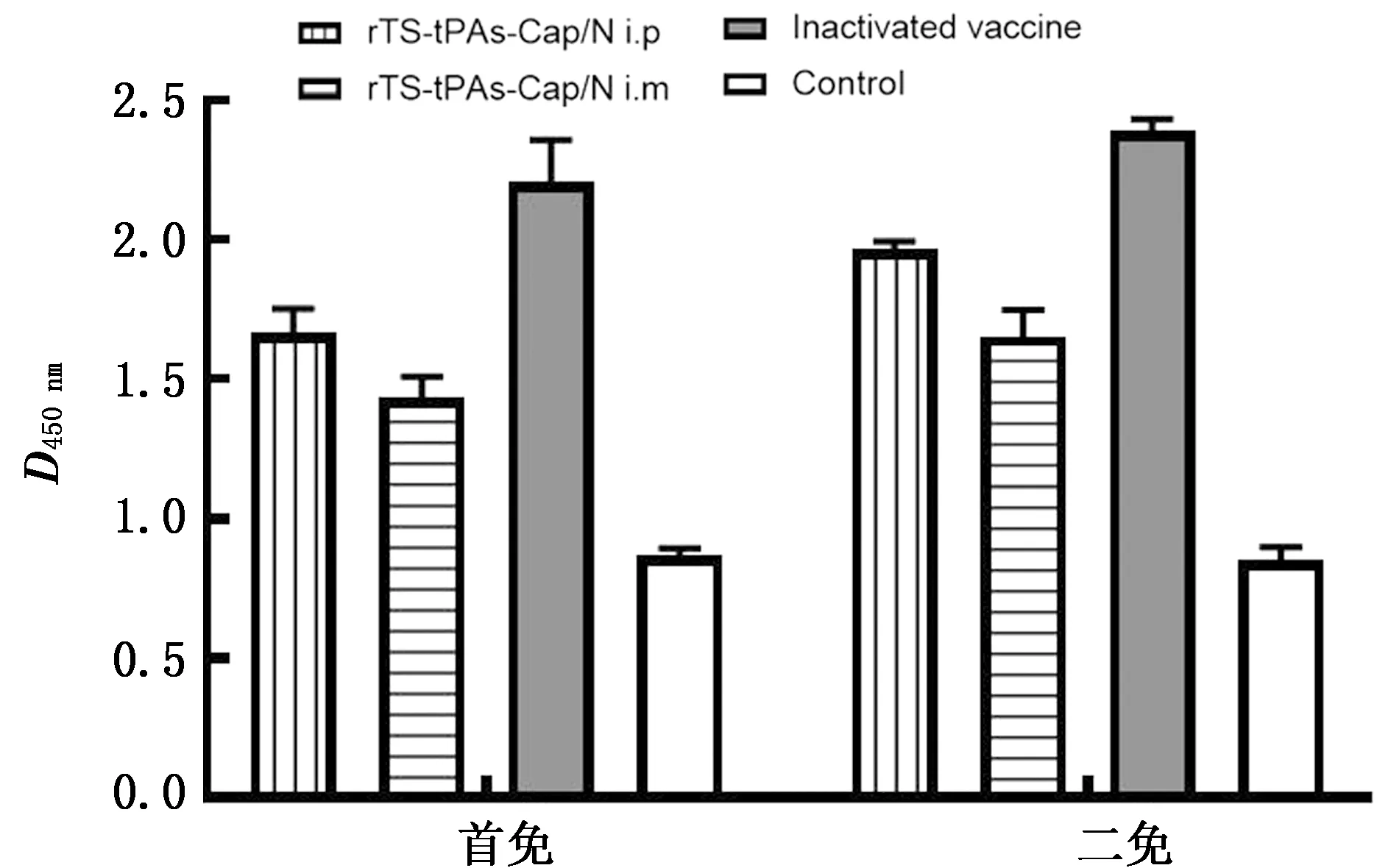
图7 重组病毒免疫小鼠血清的PCV2抗体检测
3 讨论
国内上市的PCV2疫苗以全病毒灭活疫苗为主[5],但是PCV2在细胞上的增殖效价不高,且不引起细胞病变,给灭活疫苗的研发和生产造成很大困难。长期以来,各国学者都致力于研发表达PCV2 Cap蛋白的重组腺病毒、伪狂犬病病毒和猪圆环病毒1型等活载体疫苗[23-25],已展现出良好的应用前景。
NDV作为疫苗载体有巨大的潜力,其稳定性好,在多次传代后依然稳定地表达外源基因,对动物可产生良好的保护效果。由于NDV弱毒株在哺乳动物细胞中的复制能力受到限制,NDV活载体疫苗具有较好的安全性[26]。外源基因在NDV基因组的插入位置会显著影响其表达水平。WEN等[21]研究表明,在P和M基因之间插入GFP基因的重组TS09-C株既保持了亲本病毒的高细胞增殖特性,也能高效表达GFP[27]。
tPA信号肽可高效引导重组蛋白在哺乳动物细胞内的分泌表达,是应用较为广泛的外源信号肽之一。LUO等[28]研究表明,当将禽流感病毒NP蛋白的信号肽序列替换为tPAs后,重组质粒在293细胞中的NP表达量得到了显著提升,且分泌型NP蛋白的表达量也显著增加。免疫小鼠后,重组NP质粒可诱导高水平的NP特异性抗体和CD8+T 细胞免疫反应。Cap蛋白是PCV2唯一的结构蛋白,在表达后不定位于细胞膜上,而是由其NLS高效地引导至细胞核中[29],参与病毒衣壳化。为了促进Cap蛋白的分泌型表达,本研究用 tPAs信号肽替换了Cap蛋白自身的NLS[30]。
以NDV耐热弱毒株制备的NDV活疫苗具有耐热、低毒力、可同群感染、免疫方式简便(拌料、饮水等)等优点,在发展中国家,特别是适合气温较高地区或冷链系统不完备的农村地区的广泛应用。本研究以NDV耐热弱毒株为载体,构建获得了表达PVC2 Cap蛋白的重组NDV rTS-tPAs-Cap/N株,该重组病毒保持了亲本株的耐热、弱毒、高细胞增殖滴度等优点,且可诱导小鼠产生较高的PCV2抗体反应,具有良好的免疫原性。下一步将开展其猪体动物实验,研究其对PCV2的攻毒保护效力。为研发高效、安全、热稳定性强的新型PCV2活载体疫苗打下了良好的前期工作基础。

