影像组学为基础的列线图模型对子宫内膜癌淋巴血管间隙浸润的诊断价值
崔玉杰,郑涛,杨林沙,石清磊,刘兰祥,刘德丰
1.秦皇岛市第一医院 医学影像中心,河北 秦皇岛 066000;2.西门子有限公司 磁共振产品事业部,北京 100000
引言
子宫内膜癌(Endometrial Cancer,EC)是最为常见的女性生殖系统恶性肿瘤之一,具有较高的致死率,近年来其发病趋于年轻化[1-2]。除了国际妇产科协会(FIGO)分级、肌层侵犯深度(Myometrial Invasion,MI)、病理学分级及转移与否等因素以外,近期研究表明是否存在淋巴血管间隙浸润(Lymph Vascular Space Invasion,LVSI)是影响预后的另一独立危险因素[3]。LVSI可以用于预测患者的生存时间,其阳性患者预后较差。尽管FIGO分级、MI等因素可以通过术前宫腔镜或MRI检查等手段进行评估,但目前为止LVSI必须依赖于子宫切除术后的病理检查结果。是否存在LVSI对EC治疗方案的选择具有重要影响,对于Ⅰ期存在LVSI的EC患者,手术之前进行辅助治疗能够改善其预后[4]。除此之外,尽管对于早期EC是否进行淋巴结清扫仍然存在争议,但对于存在LVSI的早期患者,FIGO指南建议必须进行主动脉旁的淋巴结清扫[1]。因此,术前应用无创的影像学手段对其进行预测具有重要的意义。然而,常规的MRI图像评估依赖于肉眼观察,具有主观性,且与观察者诊断水平关系密切。近十年来,影像组学技术的迅猛发展为深入发掘医学图像信息,客观准确进行评估肿瘤LVSI情况提供了技术基础[5-6]。本研究拟以表观扩散系数加权图像(Apparent Diffusion Coefficient,ADC)为基础,建立影像组学为基础的列线图模型,并对子宫内膜癌LVSI情况进行预测。
1 材料和方法
1.1 研究对象
本研究收集了2015年6月至2020年6月在我院就诊并经手术切除后病理确诊的295例子宫内膜癌病例。本研究为回顾性研究,经我院伦理委员会审批同意,且所有临床和影像信息均为匿名,因此无须签署知情同意书。所有患者在手术前均行MR平扫及动态增强扫描,所有的子宫内膜癌患者在术后均进行LVSI情况的评估。本研究的纳入标准为: ① 患者在MR检查前未进行放化疗或者靶向治疗;② 所有患者在肿瘤切除前两周内行MR检查。排除标准:① 患者患有子宫内膜异位症或黏膜下肌瘤;② 患者患有其他组织恶性肿瘤;③MR检查图像伪影严重,影响参数测量。最终,有225例患者被纳入了本研究,按照0.7:0.3的比例,将其随机分入训练集(n=157)和测试集(n=68)(图1)。
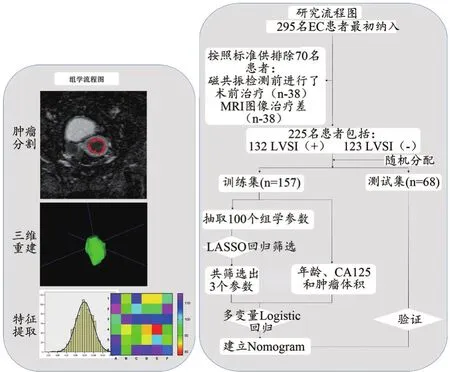
图1 组学和研究流程图
1.2 MR检查
使用配有8通道体部相控阵线圈的1.5T西门子Avanto磁共振系统(Siemens, Germany)采集MR图像。患者在扫描前4 h禁食水,减少膀胱和直肠的运动伪影。受检者取仰卧位、头先进。扫描范围包括髂前上棘至耻骨联合,方位包括斜横轴位、斜冠状位和斜矢状位,三个方位均应以子宫体部形态为标准进行定位。扫描序列包括:① 横轴位平面回波(EPI)-DWI:TR=4600 ms,TE=63 ms,反转角=150°,层数=24,层厚=6 mm,层间距=0.6 mm,FOV=380 mm×380 mm,体素大小=2 mm×2 mm×6 mm,b值=0,1000 s/mm2。ADC图由DWI计算得来;② 横轴位压脂快速自旋回波(TSE)-T2WI:TR=2000 ms,TE=96 ms,反转角=70°,层数=24,层厚=6mm,层间距=0.6 mm,FOV=380 mm×380 mm,体素大小=1 mm×1 mm×6 mm;③ 横轴位梯度回波(opp-in phase)-T1WI:TR=75ms,TE=2.38/4.79 ms,反转角=70°,层数=24,层厚=6 mm,层间距=0.6 mm,FOV=380 mm×380 mm,体素大小=0.7 mm×0.7 mm×6 mm。
1.3 三维分割和组学特征提取
首先在我院PACS系统中下载分析所需ADC图像。随后由两名具有5年盆腔MR诊断经验且对肿瘤病理分级和临床资料并不知情的影像医师,应用ITK-SNAP软件,在各个图像上逐层勾勒肿瘤的范围,勾勒时注意包括肿瘤内部的坏死、囊变和出血区域,最终获取肿瘤3D分割图像。将分割图像保存,导入Python环境下运行的Pyradiomics工具包进行参数提取。提取的组学特征参数共计100个,包括:一阶参数18个,灰度共生矩阵22个,灰度依赖矩阵参数14个,灰度游程长度矩阵(Grey Level Run Length Matrix,GLRLM)参数16个,灰度区域大小矩阵参数16个以及形态学参数14个。图1显示了组学参数的提取过程,更多关于组学参数提取的方法学信息见补充材料。
1.4 血清糖类抗原125和肿瘤体积测量
血清糖类抗原125(Carbohydrate Antigen,CA125)水平应用化学发光法微粒免疫检测技术检测,仪器采用罗氏电化学发光Cobas 8000 e602全自动生化免疫分析仪。肿瘤体积是通过ITK-SNAP软件完整勾勒肿瘤边界后,软件自动显示。
1.5 统计分析
本研究数据主要通过R软件(版本:3.4.3)进行分析。应用Student-t检验和卡方检验比较LVSI(+)和LVSI(-)患者CA125水平、肿瘤体积和年龄。将CA125、肿瘤体积和患者年龄三个参数纳入,利用逻辑回归(Logistic Regression)建立模型(ModelC)。计算两名测量者所抽取的组学参数的组内相关系数(ICC),以评估数据抽取结果的一致性,大于0.75认为一致性良好。通过LASSO回归筛选与肿瘤LVSI相关性最强的影像组学参数,以回归方程系数为基础,计算每名EC患者的组学评分(Radscore)。随后,将组学评分、CA125水平、肿瘤体积和年龄联合,建立组学列线图模型(ModelN)。应用受试者工作特征(Receiver Operator Characteristic,ROC)曲线评估模型对EC是否存在LVSI的鉴别能力。应用校准曲线及Hosmer-Lemeshow检验评估列线图模型预测LVSI风险与其实际风险的一致性。应用Delong test比较两种模型ROC曲线下面积[7]。通过计算机模拟重采样的方法进行模型的内部验证[8]。
2 结果
2.1 临床特征比较结果
LVSI(+)EC在训练集和测试集中所占比例分别为41.4%和41.2%,二者之间无显著性差异。训练集和测试集内,LVSI(+)和LVSI(-)两组患者之间年龄、CA125水平和EC体积均存在统计学差异(均P<0.05),前者高于或大于后者。另外在两个数据集之间,两组患者年龄大小、CA125水平和肿瘤位置构成比较均无差异,说明了两组数据分配的随机性和均衡性,见表1。
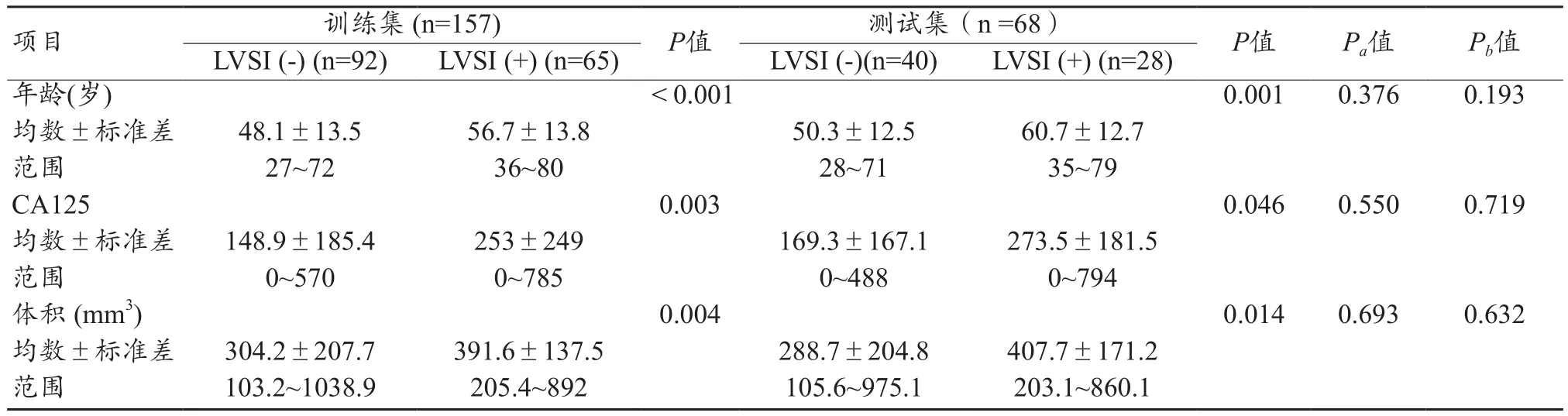
表1 训练集和测试集的基线特征
2.2 由年龄、CA125和肿瘤体积所构成的ModelC对LVSI的预测效能
通过绘制ROC曲线的方法来评估ModelC对EC是否存在LVSI的鉴别能力。训练集AUC、95%可信区间、敏感性和特异性分别为0.760、0.675~0.823、0.723、0.685。测试集AUC、95%可信区间、敏感性和特异性分别为0.825、0.718~0.904、0.929、0.625(图 2,表 2~3)。
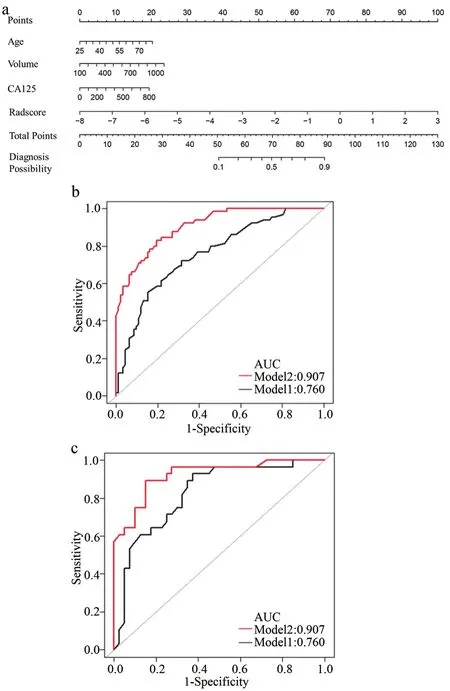
图2 列线图以及验证集和测试集ROC曲线图
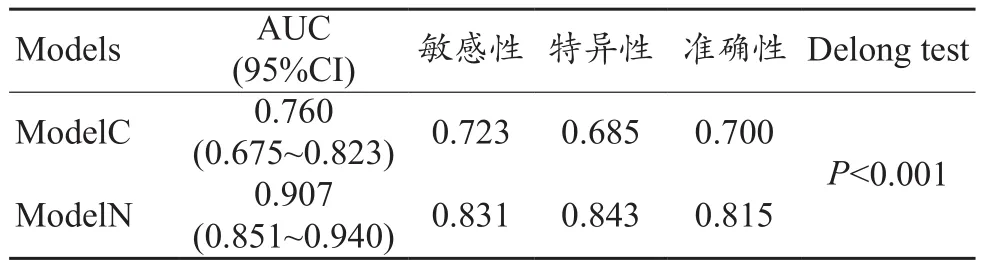
表2 训练集中两个模型的表现
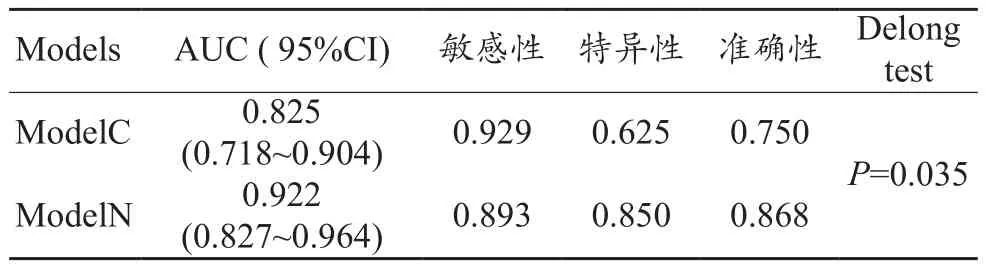
表3 测试集中两个模型的表现
2.3 影像组学模型的建立及预测能力
在225名EC患者肿瘤勾勒完毕后,我们从ADC图像中抽取组学参数,每名患者共抽取100个参数。计算两名测量者各自测量的每个组学参数的ICC值,该值小于等于0.75认为参数在两名测量者之间稳定性较差,不纳入LASSO回归方程分析。本研究中共排除了24个参数。在剩余的76个参数中,通过LASSO回归我们共筛选出三个组学参数,这三个参数与肿瘤LVSI与否具有较强的相关性(图3)。它们分别是:灰度级分布(Gray Level Non Uniformity,GLNN),标准化游程长度分布(Run Length Non Uniformity Normalized,RLNN),低灰度游程优势(Low Gray Level RunEmphasis,LGLRE)。根据回归方程的系数得到如下方程:Radscore=0.031*GLNN+2.395* RLNN-0.531* LGLRE。根据此方程,分别计算了验证集和测试集的Radsocre。
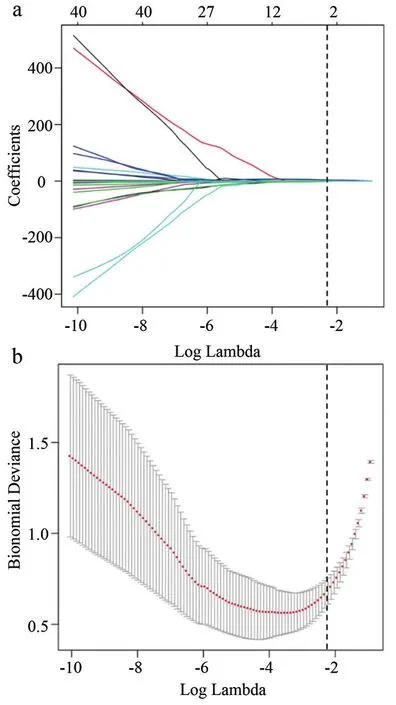
图3 影像组学参数LASSO回归曲线和二项偏差曲线图。
随后在训练集中将年龄、CA125、肿瘤体积和Radscore联合起来构建了列线图,以直观显示临床和影像综合指标的预测效果。训练集ModelN的AUC、95%CI、敏感性、特异性分别为0.907、0.851~0.940、0.831、0.843;测试集分别为 0.922、0.827~0.964、0.893、0.850。应用Delong方法与ModelC进行比较,发现该模型对LVSI预测具有更高的准确性。另外校准曲线表明ModelN同时具有良好的拟合优度 (Hosmer–Lemeshow test, 训练集和测试集P值分别为 0.673、0.804)(图4)。
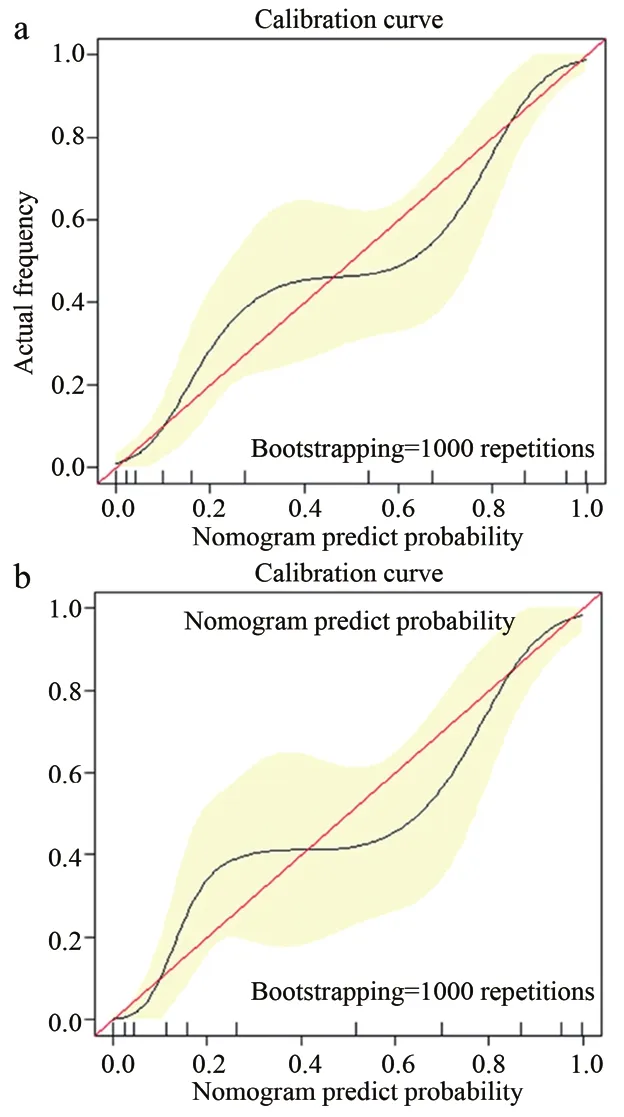
图4 训练集和测试集的校准曲线图
3 讨论
将影像组学参数与临床指标结合后建立预测模型,提高肿瘤的诊断或预测率是目前影像组学研究的热点问题之一[9-10]。本研究中,为了术前准确预测EC是否存在LVSI,我们建立并验证了一个基于放射组学特征的列线图模型。与临床模型相比,组学参数的加入能够明显提升模型的预测能力。将放射学特征和临床危险因素纳入列线图中,能够方便快捷的计算LVSI的可能性,有助于术前LVSI的个体化预测。
3.1 ModelC:年龄、肿瘤体积和CA125联合预测LVSI特异性不高
本研究首先将年龄、CA125和肿瘤体积这三个指标联合起来构建了方程。年龄是影响子宫内膜癌预后和复发的重要危险因素之一,对于60岁以上的EC患者术后复发概率明显上升[11]。尽管没有研究发现年龄可以作为LVSI的独立危险因素,但本研究中,LVSI(+)组患者平均年龄高于LVSI(-)组,因此本研究将年龄纳入了方程。另外,先前研究表明子宫内膜癌患者的CA125水平高于正常受试者,其原因可能是子宫内膜癌患者通常存在子宫内膜屏障破坏,滋养层细胞脱落、变形及坏死等情况,而滋养层细胞分泌会促使外周CA125水平升高[12]。研究表明CA125水平与EC淋巴结转移存在相关性,与影像组学联合可以较为准确的预测淋巴结转移情况[13]。也有研究者建议一旦CA125水平高于40 U/mL,则手术时必须进行盆腔淋巴结的清扫[14]。然而,CA125作为恶性肿瘤的筛选指标,特异性较低,在多种生殖系统肿瘤中均可能升高,因此仅用于肿瘤的筛查,必须和其他手段联合。另外肿瘤体积相关参数-肿瘤-子宫体积比(TVR),对预测EC的LVSI具有一定意义,以TVR≥25%为阈值预测LVSI,敏感性、特异性及准确性分别为77%、83%及81%[3]。但该方法除了需要测量肿瘤体积外,还需测量子宫体积,增加了工作量。也有研究者发现肿瘤体积与TVR法对LVSI的预测无统计学差异[15]。为了不影响结果准确性的前提下减少工作量,本研究中纳入了体积。尽管以上三个指标临床中较易获得,但所建立预测模型的特异性仅为0.685,原因可能是这三个指标都是间接指标,不能直接反应肿瘤内部的性质。
3.2 ModelN:组学模型能够显著提高LVSI预测的准确性
影像组学技术能够自动提取并分析医学影像的图像特征,获取灰度分布、体素间空间关系以及纹理不均质性等指标,深入反映肿瘤内部的异质性[16]。作为恶性肿瘤最为重要的特征之一,异质性决定了肿瘤的多种生物学行为,包括生长速度的加快、代谢活动的改变以及血管的新生[17-18]。先前研究表明肿瘤的血管异质性可能导致局部静水压的改变,最终增加肿瘤转移的风险[19]。先前研究者发现应用组学技术能够很好地对肿瘤的淋巴结和远处转移情况进行预测[20-21]。因此,应用影像组学技术对肿瘤本身异质性进行挖掘,不仅能够辅助评估分期、病理分型等原发肿瘤本身的情况,同时还能帮助预测肿瘤所常见的周围侵犯和转移等异常情况。
DWI是目前临床常用的反映组织内水分子扩散情况的功能成像指标,研究者多采用ADC值对多种肿瘤的病理分级、转移和预后进行预测[22-24]。先前有研究者将该技术与体积分析相结合,对EC的分级进行预测[25]。然而,ADC值仅能反映肿瘤平均扩散情况,对肿瘤组织内部复杂的信号信息利用不充分,不能全面反映肿瘤的异质性情况。因此为了从不同角度深入挖掘肿瘤内部大量影像信息,提高LVSI的预测能力,本研究采用影像组学的方法对ADC图像进行了分析。
本研究最后筛选出的参数包括:GLNN,RLNN,LGLRE。三者均为GLRLM二阶特征,与其他组学参数相比,GLRLM可能对EC的LVSI情况更加敏感。GLNN和RLNN分别反映了图像信号灰度强度值以及行程长度的相似性,这两个值越高表明图像灰度值及行程长度差异越大,图像信号越不均匀。研究表明肿瘤恶性程度越高,内部越容易出现出血、坏死、囊变等改变,因此信号的异质性越强。LGLRE测量了较低的灰度信号的分布,该值越高低灰度信号聚集性越低。先前研究表明,ADC值的高低可以作为判断肿瘤恶性程度的依据,恶性肿瘤实质部分的ADC值往往更低[26]。这也与本研究的结果相符。
本研究发现ModelN的鉴别诊断效能高于ModelC。将组学特征与临床资料相结合,对肿瘤的恶性程度及预后进行预测,是目前组学技术发展的趋势所在[20]。先前有多序列MR组学分析研究表明,MR纹理特征对EC病理分级和预测EC的LSVI具有较高的诊断价值,其准确率分别为80%、70%。但该研究仅仅考虑组学指标,未能对临床指标进行综合,且样本量较少[15]。本研究加大了样本量并综合了临床指标,对两种危险度肿瘤区分的准确性达到85%。另一项淋巴结转移的预测研究综合评价了临床模型、单一组学模型、组学临床混合模型对淋巴结转移的预测效果,最后经病理证实混合模型对淋巴结转移预测能力最强[20]。研究者通过MR纹理分析技术对子宫内膜癌病理风险分级及患者生存时间进行预测,但该模型仅仅应用了6个一阶参数,另外该研究模型由于采用2D的方式进行图像分割,因此操作简单、耗时短,但仅获得病变组织单层图像,难以全面反映肿瘤的信息[20]。本研究纳入了大量的形态学及二阶特征,参数数量和类型也更为多样,同时采用3D多层分割的方式,因此可能更能发现不同危险度肿瘤的差异。同时本研究在建立模型是加入了年龄、体积和CA125三个参数,综合模型Nomogram的训练集AUC约为0.907,表明该混合模型具有良好的预测能力。将测试集数据带入该混合模型,其AUC约为0.922,表明其兼具良好的泛化能力。
本研究存在以下不足:首先,本研究为回顾性研究,其结论的可靠性需要进行前瞻性研究以验证。其次,本研究所建立的模型基于单中心、单一MR扫描系统,模型还需要在多中心、多MR系统验证。
4 结论
通过与临床模型的比较,本研究发现以组学模型为基础的混合模型,能够很好地预测EC的LVSI。在组学分析中,GLRLM参数与肿瘤LVSI关系最为密切。对于肿瘤患者表现为高龄、CA125升高、肿瘤体积大,并且组学评分较高时,存在LVSI的风险增大。根据FIGO标准,LVSI的EC必须进行盆腔淋巴结的清扫。相反,对于高龄、患者多种并发疾病患者而言,由于分级错误所导致的不必要的淋巴结清扫,将导致患者术后康复时间的延长和回复效果的降低,从而使患者遭受更多的痛苦。
总而言之,采用以组学参数为基础的模型和列线图分析,能够为EC的术前无创分级提供重要指导,避免可能出现的治疗不足和过度治疗。

