成年树鼩睾丸维生素D 代谢酶CYP24A1 表达与生育力相关研究
阮蕾颖,施梅言,古文鹏,邱丹丹,陆彩霞,罕园园,王文广,代解杰,孙晓梅
(中国医学科学院/北京协和医学院医学生物学研究所, 昆明 650118)
维生素D(vitamin D, VD)是机体重要的信号分子,在骨骼发育、机体钙和磷稳态方面发挥重要作用[1]。 维生素D 本身没有活性,需要经过代谢转化,其代谢分为三个主要步骤:25-羟基化,1α-羟基化和24-羟基化,均由细胞色素P450 多功能氧化酶(CYPs)来完成[2]。 维生素D 代谢酶通过调节1,25(OH)2D 的细胞内浓度从而激活维生素 D 受体(vitamin D receptor, VDR),引发机体对VD 的应答反应[3]。 因此,VD 的利用很大程度上依赖于维生素D 代谢酶和VDR 的表达[2,4-5]。
雄性生殖系统是维生素D 重要的靶标,随着维生素D 代谢异常的不育男性增加,引发了人们对维生素D 代谢影响雄性生育的研究。 维生素D 代 谢 酶 CYP2R1 (cytochrome P450 family 2 subfamily R member 1, CYP2R1 )、 CYP27B1(cytochrome P450 family 27 subfamily B member 1,CYP27B1),CYP24A1(cytochrome P450 family 24 subfamily A member 1, CYP24A1)被发现广泛分布于雄性生殖系统中。 VDR 和维生素 D 代谢酶主要在成年男性睾丸的生殖细胞中表达,表明维生素D 的局部代谢对精子的活性或功能十分重要[6],同时也在分泌性激素的睾丸间质细胞中表达,证明VD 代谢与性激素有直接的联系[7]。提示VD 在睾丸中的代谢可能独立于全身VD 代谢,VD 可能通过自分泌和旁分泌来影响男性生育能力[8]。 值得关注的是CYP24A1 已经被证实可以用来检测男性精子质量,可很好的区分不育和可育男性[7]。 临床研究中,CYP24A1 的表达与精子的浓度、活力和形态呈正相关,且大于80%的CYP24A1 阳性精子在其颈部和头部区域表达VDR,不育男性的精子VDR 和CYP24A1 的表达水平显著低于可育男性[9]。 对大、小鼠的研究发现VDR 在睾丸组织中广泛表达。 维生素D代谢酶在实验动物中的研究较少。 Yao 等[10]通过对羊的生殖系统检测,发现这些蛋白在羊生殖系统的不同发育阶段和不同精子来源中表达各异。 在射精精子中检测到了CYP24A1 和VDR,表明VD 的调节与精子成熟有关。 高活动性精子中VDR 和CYP24A1 的显著高表达,这一结果与临床研究结果相符合[8]。 虽然多项研究都证明了VD 代谢对雄性生殖系统有重要的影响,但是其确切机制尚待进一步阐明[9,11]。
树鼩(Tree shrew,tupaia belangeri)作为一种实验动物新资源,从野外引种、驯化到人工饲养过程中虽已攻克了一系列繁殖关键技术,但较常规实验动物而言繁殖率还是有限,我们发现约有20%~30%的人工繁殖成年雄性树鼩,虽然发生交配行为,但不能使正常雌性树鼩成功受孕,对雄性种树鼩的选育和繁殖种群造成极大影响。 实验室曾开展过不育组和可育组血清VD 含量的检测,但结果显示无差异。 在排除饲养环境、营养、疾病等影响因素外,基于前人的报道,我们假设树鼩由于睾丸中VDR 或维生素D 代谢酶表达低或缺乏导致其低生育能力或不育。 因此本研究从VDR 与维生素D 代谢酶转录水平入手,重点评估CYP24A1 表达水平,与生育功能正常的树鼩作比较,分析雄性树鼩生育力低下的原因,为检测雄性树鼩生育能力、提高种群繁殖效率提供参考。
1 材料和方法
1.1 实验动物
人工饲养繁殖的普通级成年雄性树鼩10 只,年龄2~3 岁,均具有清晰个体繁殖档案。 将育龄期雄性树鼩与正常分娩史的雌性按1 ∶1合笼饲养至少两个月,并观察。 对有交配行为的动物定期进行孕检。 如该雄性树鼩未能使与其交配的雌性树鼩受孕,并在接下来以同样方式更换交配伴侣4 次及以上,均未能使雌性受孕的雄性设为生殖障碍组。 能使雌性树鼩受孕,并产下健康幼崽的雄性树鼩设为正常组,每组各5 只。 动物由中国医学科学院医学生物学研究所树鼩种质资源中心提供[SCXK(滇)K2018-0002],体重120 ~160 g,在中国医学科学院医学生物学研究所树鼩种质资源中心饲养[SYXK(滇)K2018-0002]。 本研究中涉及动物的实验操作已经得到本所实验动物使用与管理委员会(IACUC)的批准(DWSP202008002),所有动物按照3R 原则予以关怀。
1.2 主要试剂与仪器
RNAzol、 one step QPCR 试 剂 盒 购 自 日 本TaKaRa 公司;蛋白浓度测定试剂盒购自上海碧云天生物技术研究所;Western blot 电泳凝胶试剂盒购自美国BIO-RAD 公司;CYP24A1 抗体为免疫荧光和Western blot 通用抗体,购自武汉爱博泰克生物科技有限公司;DMEM/F12 培养基购自美国BI;免疫荧光二抗Donkey anti rabbit 购自Abcam 公司。
荧光定量 PCR 仪(美国 BIO-RAD,型号 CFx-96);超速离心机(德国Sartorius,型号L8-80 M);梯度PCR 仪(日本TaKaRa,型号TP600);倒置荧光显微镜(日本Nikon,型号尼康Ti;电泳仪和电泳槽(美国BIO-RED)。
1.3 实验方法
1.3.1 动物采样
腹腔注射0.3 mL 3%戊巴比妥钠进行麻醉,手术取出一侧睾丸,去除表面附着的膜及附睾,每份样品分为3 份,其中2 份迅速置于冰上,用于核酸和蛋白提取;1 份甲醛固定进行病理切片。
1.3.2 睾丸组织病理观察
取睾丸中间部分的组织块放入多聚甲醛中固定。 将固定好的睾丸组织依次放入80%、90%、95%和100%浓度的乙醇中2 h,进行脱水。 将组织浸入石蜡中包埋。 用切片机对包埋好的组织切片,厚度控制在4~6 μm。 将切片放入60℃~65℃恒温箱中15~30 min 脱蜡。 对样品进行 HE 染色。
1.3.3 QPCR 检测 VDR 及 VD 代谢酶 mRNA 表达水平
将准备好的睾丸组织剪碎,每份样品加入1 mL RNAzol 快速研磨至匀浆状态,13000 r/min 离心5 min 取上清,后按照RNAzol 说明书指导提取组织RNA,用紫外分光光度计测定总RNA 浓度,A260/A280 ≥1.80 视为合格,-80℃ 保存样品。 使用Takara one step QPCR 试剂盒进行 PCR 反应,反应条件为95℃ 30 s,退火58℃ 30 s, 延伸72℃ 30 s,40 个循环。 采用双标准曲线法计算相对表达量。引物序列见表1。
1.3.4 蛋白印迹法检测CYP24A1 蛋白表达水平
取各组睾丸样本剪碎后置于冰上按照比例每10 mg 加入200 mL 裂解液,快速研磨至匀浆状态。冰上裂解15~20 min,12000 r/min 离心10 min 取上清。 按照碧云天蛋白浓度测定试剂盒说明进行蛋白浓度测定。 使用10%聚丙烯酰胺凝胶进行电泳,电泳完毕将蛋白转移至PVDF 膜上,使用封闭液摇床上封闭样品1 h,TBST 洗涤,加一抗孵育过夜用TBST 洗涤,加二抗在摇床上孵育2 h, 洗涤后用化学发光法成像。
1.3.5 免疫荧光检测精子CYP24A1 表达情况
在超净台上将睾丸剪成小块,加入配制好的培养基中,放置细胞培养箱5%CO2,37℃孵育30 min,使精子爬出。 培养基配方:DMEM/F12、10%FBS、1%双抗、1%L-谷氨酰胺、1%丙酮酸钠、1 mmol/L 非必须氨基酸。
去除组织块,取细胞悬液 2000 r/min 4℃离心5 min,弃上清,加入 2 mL 多聚甲醛室温下固定10 min,2000 r/min 离心5 min,弃上清,根据底部沉淀量加入PBS 重悬。 用组化笔在载玻片上画一个3 cm×2 cm 的椭圆,吸取一滴细胞悬液滴加在载玻片上,用接种环将液滴均匀涂满圆圈,悬液勿接触组化笔笔迹。 根据在光镜下观察细胞的密度,适当调节细胞悬液的浓度。 将制作好的样品放置1 h 自然风干。
将样品放置于湿盒中,滴加PBS 漂洗3 次,每次5 min。 滴加5%山羊血清封闭30 min,甩去多余的液体。 PBS 漂洗同上,滴加一抗,4℃过夜。 PBS漂洗滴加二抗,室温孵育2 h, PBS 漂洗三次,滴加甘油封片,荧光显微镜下观察。
1.4 统计学方法
采用SPSS 18.0 统计学软件进行数据处理。 数据用平均数±标准差()表示,采用两独立样本的t检验进行分析,P<0.05 为差异有统计学意义。
2 实验结果
2.1 睾丸组织病理结果
对两组树鼩睾丸组织进行HE 染色,病理结果(图1)所示,正常组曲细精管排列较紧密,管腔内生精细胞较多(图1A 和1B);生育障碍组曲细精管体积减小,排列疏松,形状不规则,管腔内生精细胞大量减少(黑色箭头),少量管腔内充满嗜酸性组织液(红色箭头),(图1C 和1D)。
2.2 睾丸VDR 和VD 代谢酶mRNA 表达情况及与生育情况的相关性分析
两组树鼩睾丸组织中 VDR 及 VD 代谢酶mRNA 表达情况如图2 所示,生殖障碍组与正常组相比 VDR、CYP2R1、CYP27B1 的 mRNA 表达无明显差异;CYP24A1 相比正常组明显降低,差异有统计学意义(P<0.05)。
2.3 睾丸CYP24A1 蛋白表达情况
根据mRNA 的结果,对表达差异显著的基因CYP24A1 进行蛋白表达量的测定和比较分析。 如图3 所示,正常组的CYP24A1 表达量明显高于生殖障碍组,差异有统计学意义(P<0.05)。
2.4 精子涂片CYP24A1 免疫荧光检测
正常组精子在头部颈部和中段高表达CYP24A1(图4A)。 生殖障碍组精子与生育组相比,生殖障碍组精子低表达或不表达CYP24A1(图4B)。
3 讨论
根据李涛等[12]的病理研究结果可知,与日本兔、大小鼠、比格犬等实验动物相比,成年雄性树鼩在生精管上皮细胞层数、精子数量都相对较少,曲细精管致密度相对较疏松,由此初步判断树鼩相对于其它实验动物生育力较弱,树鼩自身的这种生理特点使得其不能像常规实验动物一样高效率繁殖。本研究也显示了相同的病理特征。 但由于本研究中使用的树鼩为2 ~3 岁的动物,与李涛等[12]采集的1 岁以下树鼩的睾丸结构相比,显得较为疏松,生精细胞较少,是由于年龄造成的。 从病理结果来看,生殖障碍组相对正常组曲细精管数量更加稀少,分布不均,生精细胞数目大量减少,这些差异可能是造成其生育力低下的原因之一。
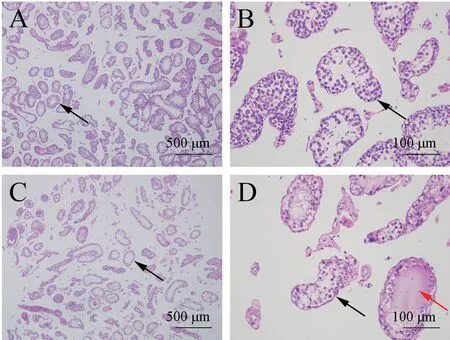
图1 树鼩睾丸组织病理学观察Note. A/B, Normal group. C/D, Reproductive disorders group.The black arrow points to the seminiferous tubules, and the red arrow points to the eosinophilic tissue fluid.Figure 1 Histopathological observation of testis of tree shrew
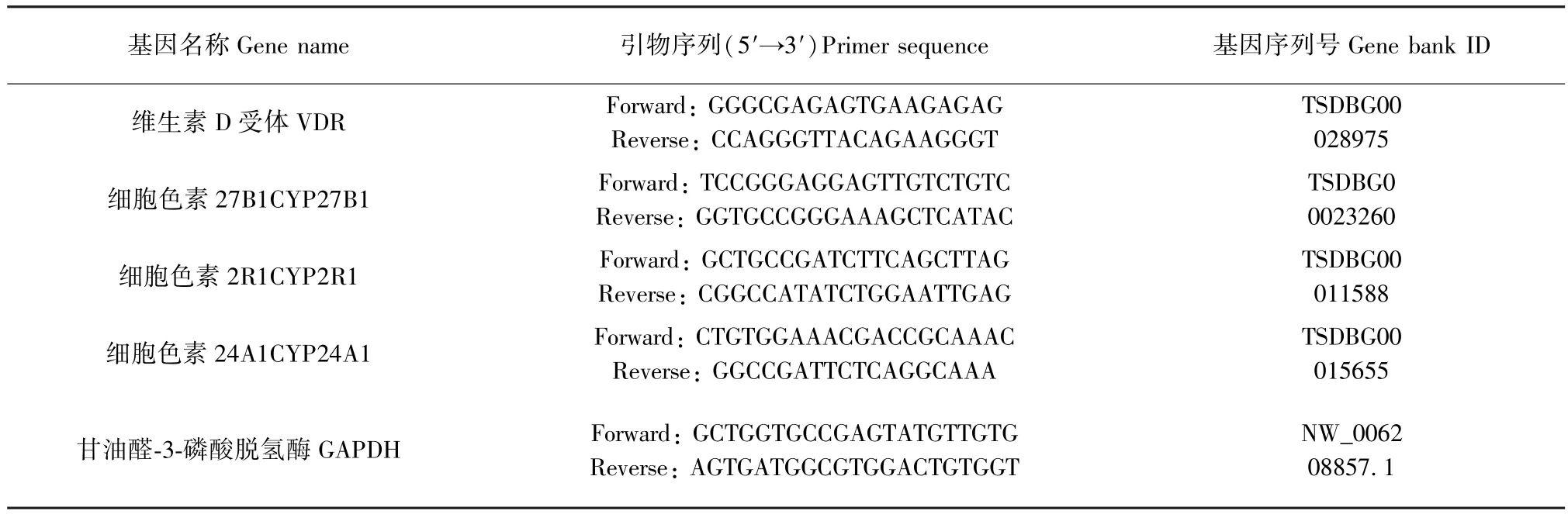
表1 PCR 引物序列Table 1 Primer sequence list
本研究对生育正常和生殖障碍两个组进行VDR 转录水平的检测,比较后发现两组间的VDR转录水平并没有显著差异,这与Yao 等[10]的实验结果相似,他们发现在不同年龄段的羊的睾丸中VDR mRNA 表达水平差异不显著,这可能是由于VDR 的转录水平在动物生长的早期阶段就已经趋于平稳。另外,该结果与临床研究发现不育男性精子VDR 表达水平明显下降的结果不一致,这可能是由于物种和取材部位差异导致的。 研究显示VDR 在生殖系统各组织中表达存在差异,可育男性主要在精子头部细胞核表达[13];而大鼠仅在睾丸精原细胞、Sertoli细胞和精母细胞中有表达,精子中却表达较弱[14]。小鼠中VDR 表达最强的是附睾头部上皮细胞,在附睾尾部的精子中不表达[15]。 研究不同品系VDR 基因敲除小鼠对其生育力的影响,得到截然相反的结果,说明物种差异性较大[9,16]。 本研究仅对树鼩睾丸组织的VDR 和维生素D 代谢酶开展了比较,导致了结果的局限性。 进一步开展VDR 在树鼩生殖系统各组织结构中的表达分布,将有助于对树鼩生殖障碍原因的深入分析。 从本研究的数据来看VDR 的mRNA 在睾丸中的表达水平不能作为判断雄性树鼩生育力的有力指标。
CYP2R1 的作用是对维生素D3 进行25-羟基化,将其转化成25-(OH)D 从而完成维生素D 向活性形式转化的第一步[17]。 我们的实验结果中两组睾丸样品CYP2R1 mRNA 表达量无统计学差异,且组内个体间的表达量差异较大,因此我们假设CYP2R1 的表达受自身其它因素的影响较大。 25-(OH)D 还需要通过CYP27B1 进行进一步的羟基化,最终生成有活性的骨化三醇1,25-(OH)2D[17]。本实验结果显示,CYP27B1 mRNA 在两组睾丸中的表达没有统计学差异,这可能是由于CYP27B1 作为VD 的几种激活酶之一参与维生素D 代谢,其表达量的变化并不会直接影响维生素D 利用转化的效率,因此受到维生素D 浓度变化的影响较小。 另一方面CYP27B1 转录水平可能在动物成年后达到稳态,使CYP27B1 转录基本保持稳态而不容易因机体反馈调节的作用产生大的变化。
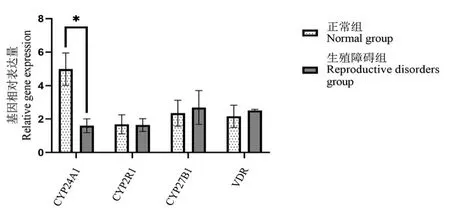
图2 树鼩睾丸VD 代谢酶及VDR 基因的相对表达量Note. Comparison of relative gene expression between normal group and reproductive disorder group, *P<0.05.Figure 2 Relative expression levels of VD metabolic enzymes and VDR in the testis of tree shrews
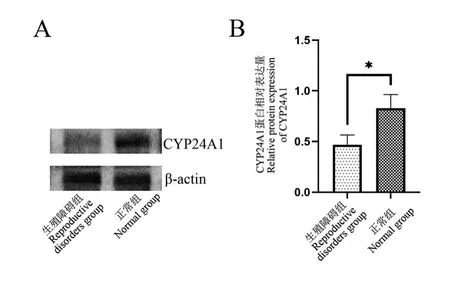
图3 正常组和生殖障碍组CYP24A1 蛋白表达比较Note. A, Western blot test results. B, Comparison of relative protein expression between groups, *P<0.05.Figure 3 Expression of CYP24A1 in control group and abnormal group
虽然以上几种蛋白都被认为是与雄性生殖密切相关的,但是目前只有CYP24A1 被认为是判断人类男性精子质量的金标准。 CYP24A1 在人精子环上表达,且与精子运动能力、浓度、数量呈正相关,通过检测CYP24A1 的阳性率和表达量可以很好的将健康和不育男性区分开[18];该结果在羊中也得到了验证[10]。 因此研究雄性生育能力时CYP24A1 是值得重点观察的指标。 从本实验结果可以看出,CYP24A1 的mRNA 和蛋白表达量在正常与生殖障碍组之间差异显著。 免疫荧光检测可以直观的看到正常组动物的精子在其头部、颈部和中段的位置高表达CYP24A1,而生殖障碍组低表达或不表达CYP24A1。 生育力强的组别高表达CYP24A1 这一结果与其他报道相一致[10,19]。 而CYP24A1 表达的位置似乎存在物种间的差异,如Jensen 等[7]的实验发现>80%的CYP24A1 在人精子的头部和颈部高表达,而在羊中发现CYP24A1 仅在精子的颈部和中段高表达[10,18],本研究结果与人精子的表达位置更接近。
Yao 等[10]的实验中还发现CYP24A1 在运动能力强的精子中高表达,因此推测高表达CYP24A1 的正常组树鼩产生的精子活力更强,大大增加了受孕的几率。 而对于精子运动能力弱、CYP24A1 表达低而引起不育的树鼩,单纯通过补充VD 可能并不能使其情况好转,这也被其他物种所证实[20],这是因为CYP2R1、CYP27B1 和CYP24A1 在睾丸中的水平决定了循环的维生素D 代谢产物对生殖功能的效力。 用胆钙化固醇或骨化三醇处理性腺,VD 的作用可能会因这些酶在性腺中的表达情况而异。 胆钙化固醇可以被逐步激活并产生反应,而骨化三醇已经处于有活性状态,会立即产生反应或被灭活[6]。
综上,CYP24A1 在树鼩睾丸中的表达高低与其生育力有直接联系,可以将睾丸组织和精子中CYP24A1 的表达情况作为评估树鼩生育力的指标。基于前期我们对两组树鼩血清检测,VD 含量无差异的信息提示,单纯补充VD 不能使这类树鼩恢复生育力,可能需要通过寻找调控维生素D 代谢酶的关键因子入手来解决。

