磷酸三正丁酯对蚯蚓的生态毒性效应
王倩,杨扬,2,李梅,3,*
1. 南京大学环境学院,污染控制与资源化研究国家重点实验室,南京 210023
2. 南京农业大学资源与环境科学学院,南京 210095
3. 南京大学环境学院,环境科学与工程国家级实验教学示范中心,南京 210023
自2009年联合国环境规划署召开会议以来,溴代阻燃剂已在全球范围内被禁用[1]。有机磷酸酯(OPEs)因具有低烟、低卤、低成本以及阻燃性能好等特点,逐渐成为溴系阻燃剂的替代品[2-3]。近年来,在家具、建筑材料、纺织品、塑料制品和电子产品等方面得到了广泛应用[4],其产量持续增长。由于OPEs主要以物理添加而非化学键合方式加入到材料中,因此在使用、处置和回收过程中极易通过挥发、浸出和磨蚀作用而迁移至周围环境[5],造成我国OPEs污染日益严重。OPEs普遍分布在水体[6-7]、大气[8]、室内灰尘[9]和沉积物[10]中,并可在生物体内积累到较高水平,最高可达15 000 ng·g-1脂质重量[11]。值得一提的是,有研究在北极的水体和沉积物中发现了OPEs的存在[12]。大量毒性试验结果表明,OPEs能引起包括发育毒性、生殖毒性、神经毒性、内分泌干扰和致癌性等一系列生态毒理学效应[13-14]。如磷酸三(2-氯乙基)酯(TCEP)和磷酸三(1,3-二氯异丙基)酯(TDCIPP)可轻易进入血液、肝脏、肾脏和睾丸,并诱发肿瘤[15],已被证明具有神经毒性和致癌性[16]。另有研究发现屋尘中的TDCIPP水平与男性甲状腺激素(THs)水平降低和催乳激素水平升高密切相关[17]。可见,OPEs可能对生态环境和人体健康造成危害,因此研究OPEs的毒性效应具有重要意义。
根据取代基的不同,OPEs可分为氯代类、烷基类和芳香类[18-19]。其中,烷基取代OPEs是主要类型,在世界范围内的野生动植物甚至人体内均有检出[20-21],在欧洲一些地区,鱼体内烷基类OPEs浓度与多溴二苯醚相当[22]。常见的烷基类OPEs包括磷酸三(2-丁氧基乙基)酯(TBOEP)、磷酸三乙基酯(TEP)、磷酸三(2-乙基己基)酯(TEHP)和磷酸三正丁酯(TnBP)[23]。TnBP是其中最常用的一种,被美国环境保护局(US EPA)划归为高产量(HPV)化学品[24]。据估计,全球TnBP的年产量为3 000~5 000 t,主要用作增塑剂、润滑剂和阻燃剂[25]。同样地,因使用广泛,TnBP也在多种环境介质中被大量检出。如从欧洲国家、菲律宾、加拿大和中国收集的海洋和淡水鱼体内均检测出TnBP,总含量范围为1.43~6 000 ng·g-1脂质重量[23]。有研究分析了24个从中国东北辽河收集到的地表沉积物样品,发现辽河TnBP污染严重[26]。此外,土壤作为陆地生态系统的基础,其TnBP污染同样不容忽视。有研究表明,土壤是疏水性有机化合物TnBP的重要贮存介质。邓旭等[27]在中国成都市区/郊区土壤中检测出较高水平的TnBP。Cui等[3]收集并分析了67份来自中国广州亚热带城市道路绿化带、稻田、公园、商业和居民区的土壤样品,发现广州市郊土壤中的OPEs浓度范围为0.041~1.37 mg·kg-1,且所有样品中均有TnBP检出。He等[28]检测了中国重庆市街道粉尘中OPEs的含量,发现其浓度范围为0.35~1.37 mg·kg-1。Wang等[29]在大连收集了49个表层土壤样品,并对其浓度和组成进行鉴定,发现土壤中TnBP较为丰富,占总OPEs的28.5%±15.6%。几项毒理学研究表明TnBP可能对动物和人体健康产生多种不利影响。如TnBP可降低亚洲淡水蛤(Corbiculafluminea)中抗氧化酶和热激蛋白相关基因的水平[30]。Hou等[31]研究发现,TnBP可在稀有鮈鲫(Gobiocyprisrarus)肾脏、卵巢和肝脏中蓄积。高丹等[32]考察了TnBP对斑马鱼胚胎的急性和慢性毒性,发现胚胎孵化率、存活率、心率和体长与受试物浓度呈负相关,而异常率则呈正相关。
鉴于TnBP分布广泛且具有一定毒性,可能对生态系统造成巨大威胁,因此其潜在风险值得关注。相较于水生生态系统,TnBP在土壤生态系统中的研究非常有限,目前仅局限于TnBP在土壤环境中的检测[3],而其造成的土壤环境风险尚未得到恰当评估,对土壤生物的毒性效应也知之甚少。蚯蚓作为“生态系统的工程师”,对维持土壤生态系统功能有着不可替代的作用,且处于食物链底端,已成为对陆地环境有毒物质进行生态风险评价的重要指示生物[33]。综上,本文选择用量大且应用范围广泛的TnBP为研究对象,选取土壤模式生物赤子爱胜蚓(Eiseniafetida)为受试生物,通过TnBP对蚯蚓的急性暴露实验,以蚯蚓的生长、抗氧化酶、乙酰胆碱酯酶活性和遗传毒性指标的响应变化,来探究TnBP对蚯蚓的毒性效应,进而为后续进行土壤生态风险评估提供科学依据。
1 材料与方法(Materials and methods)
1.1 试验材料
磷酸三正丁酯(tri-n-butyl phosphate, TnBP)为化学纯,CAS号为126-73-8,购自苏州泰普瑞精细化学品有限公司;石英砂(CAS No.14808-60-7)、高岭土(CAS No.1332-58-7),纯度均为99%,碳酸钙(CaCO3),为分析纯,均购于南京化学试剂有限公司;牛粪购自内蒙古锡林郭勒草原有限公司,经烘干过20目筛备用;生理盐水即0.9%的氯化钠(NaCl)溶液,NaCl(CAS No.7647-14-5)为分析纯,购自南京化学试剂有限公司。
赤子爱胜蚓(E.fetida)由江苏省句容蚯蚓养殖基地提供,挑选环带明显且无损伤,体重介于0.3~0.6 g的成蚓,试验前于清洁人工土壤中驯化24 h,供试验用。
1.2 试验方法
采用人工土壤法研究TnBP对蚯蚓的毒性效应。人工土壤配制参照经济合作与发展组织(OECD)推荐的标准方法[34],并做适当改进。具体配制过程如下:称取350 g石英砂,100 g高岭土以及50 g过20目筛的干牛粪于培养缸中,充分混匀。加入175 mL经蒸馏水稀释为不同浓度的TnBP溶液,混匀后使各处理组最终浓度分别为0、0.1、1和10 mg·kg-1,各培养缸中含水量为35%,并用CaCO3调节pH至6.0±0.5。每个处理6个平行,置于恒温恒湿培养箱稳定7 d,随后,每缸放入10条经清洁人工土壤驯化24 h后的蚯蚓培养14 d,用锡箔纸封口并扎小孔透气。培养箱温度设置为(20±2) ℃,湿度保持80%左右,光照条件设为12 h光照和12 h黑暗一个循环(光照强度为400~800 lux)。于第3天、第7天和第14天,分别记录蚯蚓体重、死亡数及中毒症状,并在每个玻璃培养瓶中随机取出3条用于后续分析。
1.3 体重变化率测定
在第3天、第7天和第14天时将不同处理组蚯蚓的平均体重与第0天进行比较,采用如下公式计算体重变化率:
体重变化率=(Wt-W0)/W0×100% (1)
式中:Wt为第t天蚯蚓的平均体重(mg),W0为第0天蚯蚓的平均体重(mg)。
1.4 生化指标测定
1.4.1 酶液制备
将经过染毒处理的蚯蚓清肠24 h,每组选择3条进行组织液制备。将蚯蚓洗净、称重,放入10 mL圆底离心管中,按重量(g)∶体积(mL)=1∶4比例加入生理盐水,冰浴条件下机械匀浆,3 000 r·min-14 ℃离心10 min,取上清液即为20%酶液,一部分用于丙二醛(MDA)含量测定,另一部分再分别稀释得到10%和5%组织匀浆,用于超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、乙酰胆碱酯酶(AChE)活性和8-羟基鸟苷(8-OHdG)含量测定。
1.4.2 酶活性测定方法
蛋白含量采用BCA(bicinchonininc acid)法蛋白定量测试盒(南京建成提供)进行测定。SOD、CAT和AChE活性均采用南京建成生物工程研究所提供的试剂盒,按说明进行测定。其中,SOD活性以450 nm下吸光值计算,酶活性单位定义为反应体系中SOD抑制率达50%的酶量;CAT活性以405 nm处吸光值计算,单位为U·mg-1prot;AChE活性以412 nm处吸光值计算,以水解反应体系中1 μmol基质为1个活力单位。测定时每个处理设3组平行,每个平行重复测定3次。
1.4.3 MDA含量和8-OHdG含量测定方法
MDA含量和8-OHdG含量按照试剂盒方法进行测定,试剂盒由南京建成生物工程研究所提供。MDA含量测定过程中,酶液直接用于测试,于波长532 nm处测定吸光度值;8-OHdG含量测定时将酶液稀释为10%的组织匀浆进行,于波长450 nm处测定吸光度值。
1.5 DNA损伤
在暴露的第3天、第7天和第14天,随机从各处理组取出3条蚯蚓,清肠24 h后洗净,参考Eyambe等[35]方法提取蚯蚓体腔细胞,制备单细胞凝胶电泳胶板,经裂解、解旋后,在电压25 V,电流300 mA条件下避光电泳20 min。中和碱性后,染色,置于荧光显微镜下观察,并用数码相机拍照。用Comet Assay Software Project (CASP)分析软件进行分析,选取尾DNA含量(Tail DNA%)和Olive尾矩(Olive tail moment, OTM)2个参数作为DNA损伤的指标,每张片子分析50个细胞。
1.6 数据分析
数据处理采用软件SPSS18.0进行统计分析,并用OriginPro 2015软件绘图。所有实验结果采用平均数±标准差(Means±SD)表示,利用Student’s t-test检验2组样品所测指标平均数的差异是否具有统计学显著性,以P<0.05作为显著性标志。
2 结果与讨论(Results and discussion)
2.1 TnBP暴露对蚯蚓死亡和体重的影响
赤子爱胜蚓暴露于TnBP后第3天、第7天和第14天的死亡与生长情况如表1所示。由表1可知,TnBP暴露期间,蚯蚓未观察到明显的死亡现象(死亡率均未超过5%),说明在人工土壤环境下,本实验设置浓度范围对蚯蚓不具有明显致死效应,TnBP急性毒性较弱。而不同浓度的TnBP处理组中,蚯蚓体重随暴露时间延长而持续增加,并在第14天达到试验周期体重的最大值,体重增长率变化范围为34.6%~81.1%(图1),表明人工土壤的营养条件满足蚯蚓的生长需求,且TnBP急性毒性较低,未对蚯蚓生长产生明显抑制。Yang等[36]的研究也有类似结果,暴露于TCEP和TCP的蚯蚓未出现明显死亡,且蚯蚓体重随时间的延长持续增加。

表1 磷酸三正丁酯(TnBP)暴露下蚯蚓死亡率
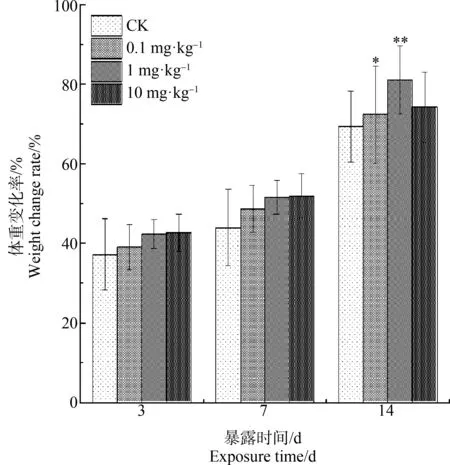
图1 不同暴露时间TnBP对蚯蚓体重变化率的影响
2.2 TnBP暴露对蚯蚓抗氧化酶活性的影响
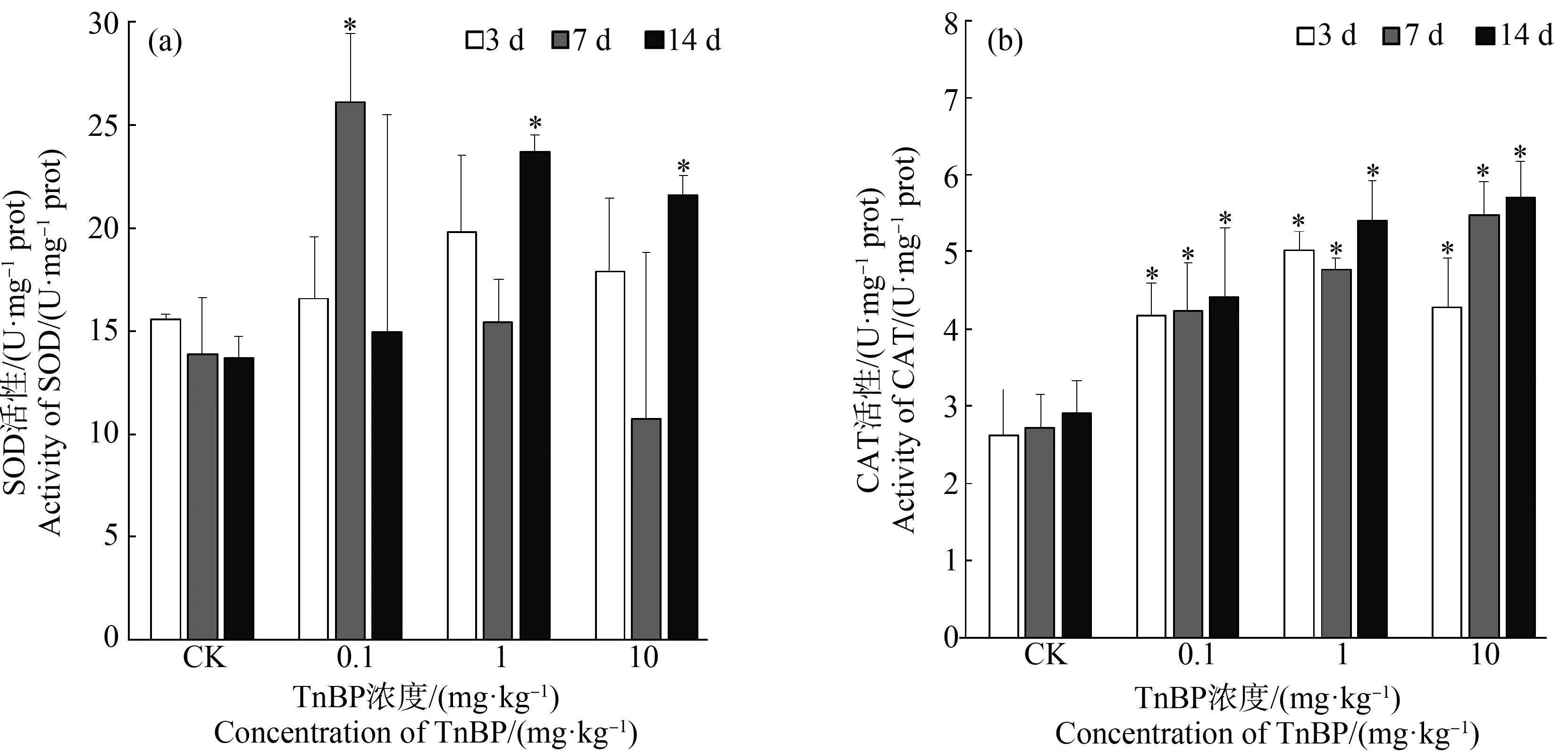
图2 TnBP暴露下蚯蚓组织中超氧化物歧化酶(SOD)活性(a)和过氧化氢酶(CAT)活性(b)
当遭受污染物胁迫时,蚯蚓体内抗氧化酶受到非常复杂的调控,往往不是单一的酶发挥作用,并且其活性变化与暴露剂量和时间均密切相关[44],SOD和CAT活性的上升是对TnBP暴露所产生ROS的直接响应,用于清除污染物产生氧化胁迫导致的过量自由基,以适应环境变化,保障机体各种生理功能有条不紊地进行。Chen等[2]研究了2种常见有机磷酸酯阻燃剂,磷酸三苯酯(TPP)和磷酸三(2-氯乙基)酯(TCEP)对5周龄雄性小鼠氧化应激的影响,发现经TPP和TCEP处理后,肝脏中SOD活性增强,CAT的活性则以剂量依赖性方式增加,与本实验结果一致。Meng等[45]也发现经TPP处理可以增强贻贝血细胞SOD和CAT的活性,以及它们各自基因的转录水平。
2.3 TnBP暴露对MDA含量的影响
氧化应激可能导致细胞膜损伤和其他毒性作用[46]。MDA作为一种由自由基引发的次级脂质氧化产物,其含量反应了生物机体脂质受氧化损伤的程度[47]。在正常生理状态下,蚯蚓体内MDA含量较低,而当外源污染物胁迫产生的氧自由基,在体内抗氧化防御系统清除不及时,会导致机体MDA含量明显升高。不同浓度TnBP暴露下,蚯蚓体内MDA含量变化如图3所示。由图3可知,随着暴露时间的增加,MDA含量逐渐累积,且在暴露的第7天和第14天,蚯蚓体内MDA含量较对照组显著上升(P<0.05),为对照组的1.44~1.67倍;而随着TnBP浓度升高,除在第3天高浓度组(10 mg·kg-1)MDA含量较前一浓度出现下降趋势外,其他各组MDA含量均随TnBP浓度的升高而上升,并与对照组相比差异显著,表明SOD和CAT活性虽在TnBP暴露下有所增强,但不能保护蚯蚓免受过氧化影响,蚯蚓受到一定程度的氧化损伤,导致体内次级脂质过氧化产物MDA含量上升。第3天MDA含量的下降可能是高浓度胁迫下短期内激发了多种抗氧化酶的防御,使得氧化损伤作用较低浓度组有所缓解。与此类似,Chen等[2]研究了TPP暴露对小鼠氧化应激状况的影响,结果显示,经TPP暴露后,小鼠肝脏MDA含量显著增加,并存在一定剂量依赖性,与本实验结果一致。在本试验中,TnBP暴露引起蚯蚓明显的脂质过氧化效应,且总体来说,随着浓度升高,蚯蚓受氧化损伤的程度加重。
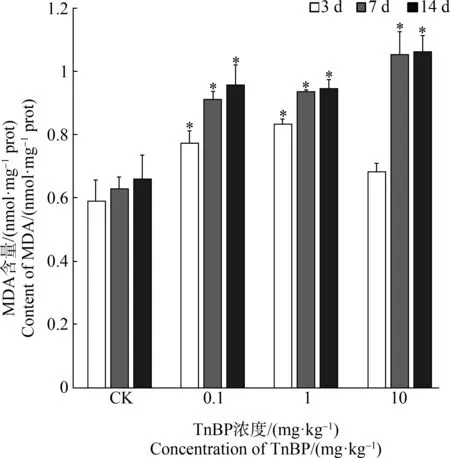
图3 TnBP暴露下蚯蚓组织中丙二醛(MDA)含量
2.4 TnBP暴露对蚯蚓DNA损伤的影响
彗星试验,又名单细胞凝胶电泳技术,是目前检测污染物对生物体遗传毒性常用方法之一[48]。已有研究证实OPEs暴露能引起蚯蚓体腔细胞的DNA损伤[36],表明OPEs具有遗传毒性[49]。3种不同浓度TnBP暴露下蚯蚓体腔细胞中Tail DNA含量和OTM的变化如图4所示。结果显示,在暴露的第3天和第7天,低浓度TnBP处理组(0.1 mg·kg-1)蚯蚓体腔细胞中Tail DNA含量和OTM较对照变化不显著(P>0.05),而在暴露的第14天,Tail DNA含量与对照组相比显著上升(P<0.05),提示体腔细胞中DNA受到损伤。当浓度升高至1 mg·kg-1和10 mg·kg-1时,在暴露第3天,Tail DNA含量和OTM出现显著上升并随浓度的增加呈现上升趋势,这可能是因为随着浓度的升高,TnBP胁迫下在蚯蚓体内产生的ROS及其他中间产物增加,造成细胞DNA损伤程度的加大。这些结果与Yan等[50]的一致,该研究报道了TnBP暴露会引起河蚬(Corbiculafluminea)DNA损伤,且由TnBP诱导的DNA损伤程度以剂量依赖性方式增加。相似地,Chen等[51]的研究也表明TDCIPP暴露会造成稀有鮈鲫肝脏中DNA的损伤,并呈剂量依赖性。随着暴露时间的增长,高浓度组(10 mg·kg-1) Tail DNA含量在第7天最高,为22.13%,在第14天呈下降趋势,其原因可能是在高浓度TnBP胁迫下,蚯蚓的自我修复机制发挥作用[52],OTM则在1 mg·kg-1暴露14天时达到最高值。

图4 TnBP暴露下蚯蚓脱氧核糖核酸(DNA)损伤:Tail DNA含量(a)和Olive尾矩(OTM) (b)
有研究表明ROS引起的氧化应激可导致DNA损伤[53],OPEs诱导的DNA损伤与氧化应激之间的关联已在流行病学[54]和动物实验[49]中有所报道。推测在本试验中,TnBP暴露造成蚯蚓体细胞DNA损伤可能也是通过氧化应激引起的。近年来,因鉴定了8-OHdG水平与氧化性DNA损伤和癌症发病率之间的相关性,8-OHdG已被广泛用作氧化应激和致癌的生物标记物,其含量变化通常作为描述ROS对DNA损伤程度的指标。本研究分析了不同浓度TnBP暴露下,蚯蚓体内8-OHdG含量的变化(图5)。由图5可知,在暴露的第3天,蚯蚓体内8-OHdG含量无明显积累,而到第7天和第14天时,即使在低浓度TnBP暴露条件下,8-OHdG的水平也显著上升,且其含量与TnBP暴露浓度存在明显的剂量-效应关系。由此可见,TnBP暴露虽会引起蚯蚓体内抗氧化酶系活性上升,但却不能完全清除ROS,从而造成DNA损伤。Chen等[51]在研究OPEs遗传毒性时发现,TDCIPP暴露会引起稀有鮈鲫肝脏细胞中8-OHdG含量显著上升,且TDCIPP诱导的DNA损伤归因于氧化性DNA损伤,与本研究结果一致。相同浓度各处理组在整个染毒周期8-OHdG含量呈现先减小后增加的趋势,可能是因为经14 d暴露虽然8-OHdG在蚯蚓体内有所累积,但其含量的增加并非是一个简单的线性曲线,机体自身对DNA损伤具有修复作用,因而在第7天含量有所下降,但却不能被完全修复,这导致在第14天继续增加[55]。
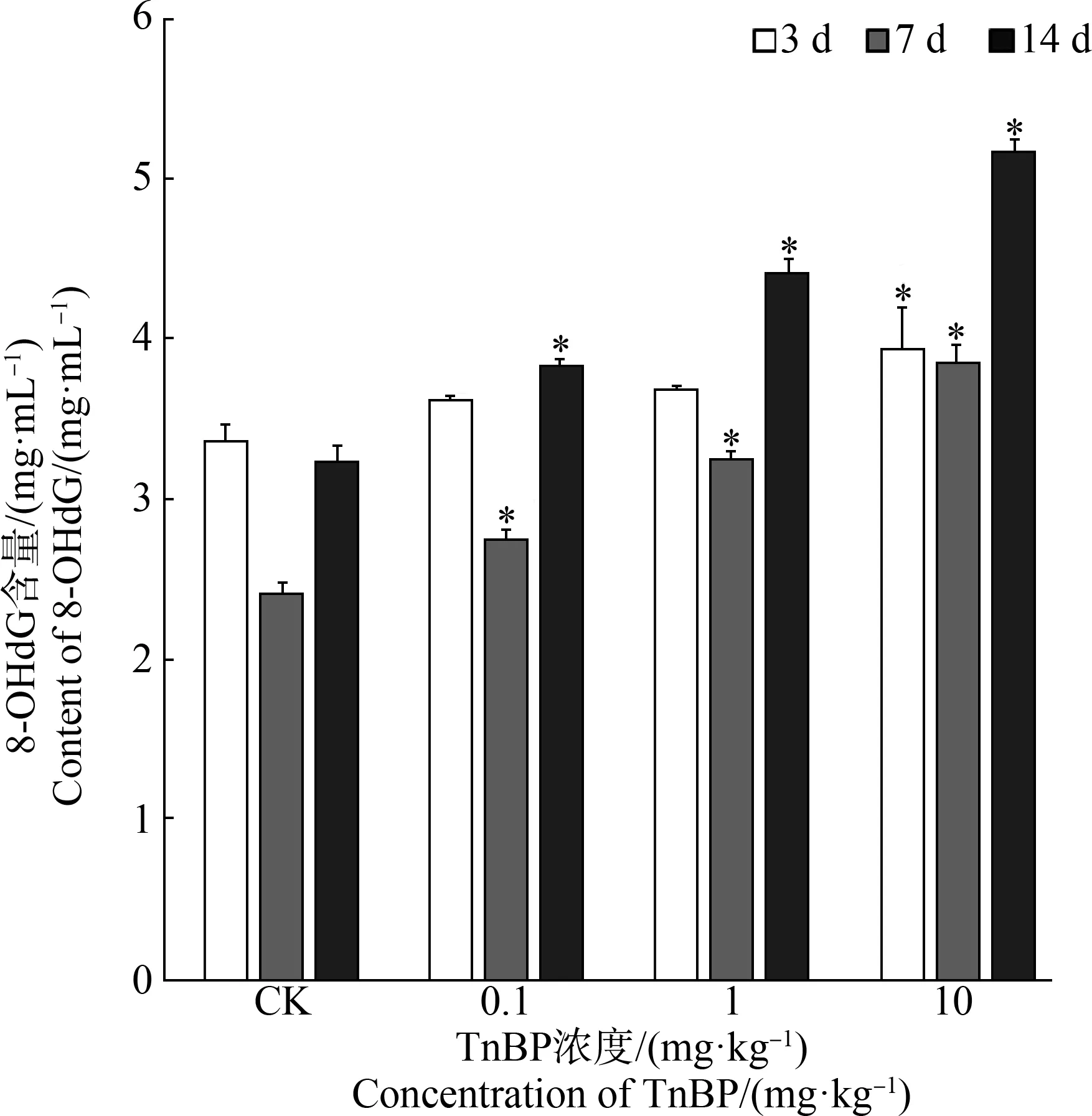
图5 TnBP暴露下蚯蚓组织中8-羟基脱氧鸟苷(8-OHdG)含量
2.5 TnBP暴露对蚯蚓AChE活性的影响
AChE是催化神经递质乙酰胆碱的一种关键酶[56],数十年来,其活性被广泛认为是神经毒性的生物标志物[57]。本研究发现TnBP暴露对蚯蚓AChE活性影响较为微弱,在第7天AChE活性似乎略有下降,但无统计学意义(图6)。Sun等[58]在研究TnBP对斑马鱼的神经毒性时,也未发现AChE活性变化,但TnBP可影响斑马鱼幼鱼行为,通过非乙酰胆碱途径使幼鱼游泳速度下降,产生神经毒性,并抑制幼鱼神经发育关键基因髓磷脂碱性蛋白基因(mbp)和突触蛋白基因(syn2a)的表达;类似地,顾杰等[59]研究发现,TPP、2-乙基己基二苯基磷酸酯(EHDPP)和TCEP暴露能显著抑制斑马鱼幼鱼mbp和syn2a的转录,通过氧化应激和下调神经发育关键基因的转录,从而导致神经毒性。Jiang等[60]的研究结果表明,TnBP能对蚯蚓产生神经毒性。在本研究中,TnBP暴露对蚯蚓AChE活性影响较为微弱,可能是因为TnBP也是通过非乙酰胆碱途径诱导神经毒性,其具体影响机制有待进一步探究。
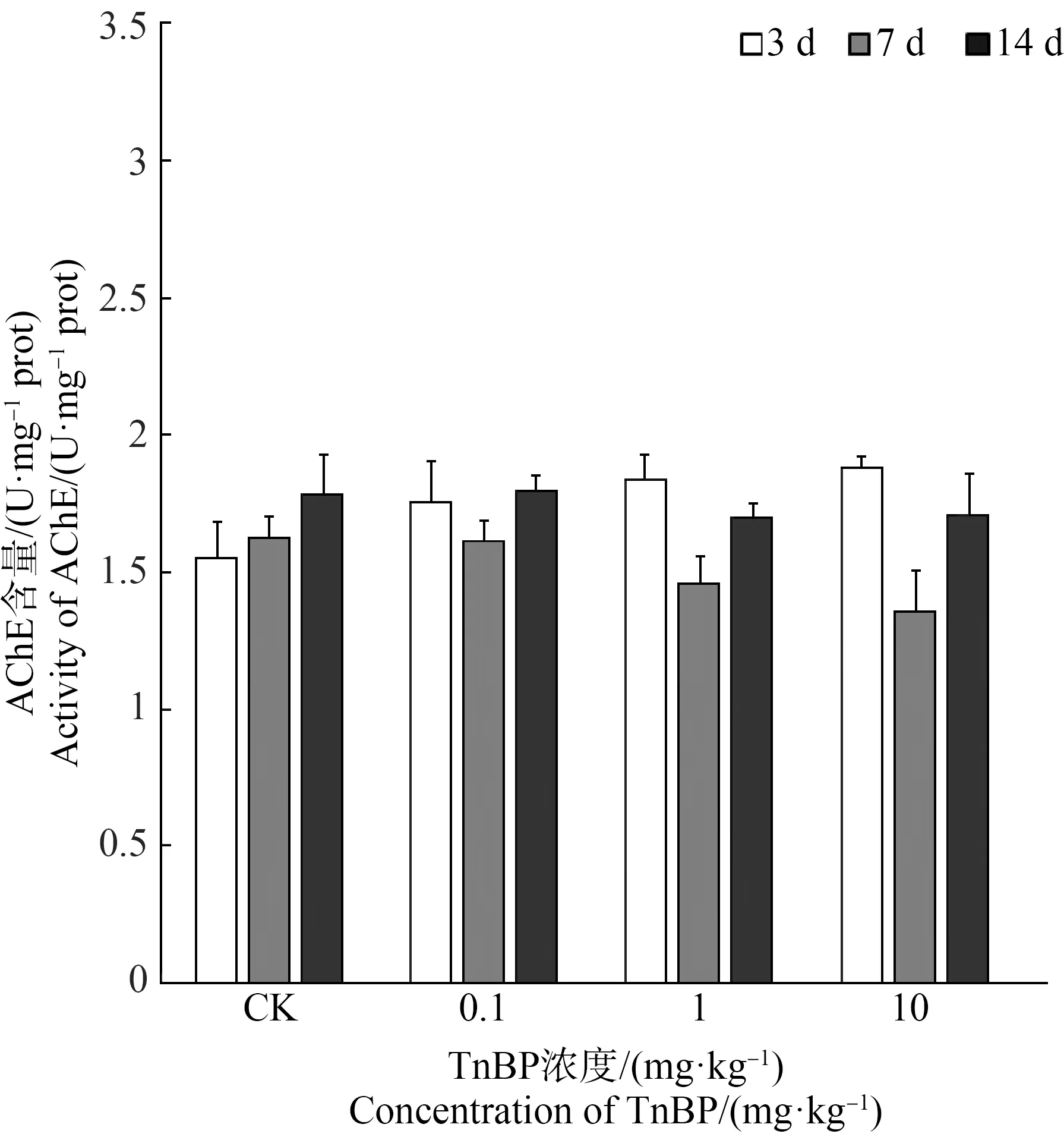
图6 TnBP暴露下蚯蚓组织中乙酰胆碱酯酶(AChE)活性
综上所述,不同浓度TnBP暴露对蚯蚓死亡与生长没有显著影响,但可诱导蚯蚓体内SOD酶活性和CAT酶活性增强,可能通过非乙酰胆碱途径诱导神经毒性,即使是低浓度TnBP暴露,也能导致蚯蚓体内MDA含量显著增加,引起蚯蚓脂质过氧化与DNA损伤。这些结果有助于了解TnBP暴露对蚯蚓的毒性效应及毒性作用机理,丰富了OPEs污染对土壤生物影响的认识,并为评估土壤生态系统中OPEs的风险提供了重要信息。

