基于高分子材料的降眼压药物递送系统
黄 畅, 赵玉瑾, 徐建江, 孙兴怀, 孙建国
(复旦大学附属眼耳鼻喉科医院,国家卫生健康委员会近视眼重点实验室,上海市视觉损害与重建重点实验室,上海200031)
青光眼是一种以眼压升高为特征的慢性视神经退行性疾病,持续高眼压是引发青光眼的最主要因素。健康人群的眼压为10~21 mmHg (1 mmHg=133.3 Pa,下文同),当眼压持续处于25 mmHg以上时,即认为高眼压;当眼压持续高于25 mmHg时,很有可能患有青光眼;大部分青光眼伴随着眼压持续升高,但仍存在一些正常眼压的青光眼患者。眼压升高是正常眼睛所不能忍受的,这会导致视神经的逐渐损伤,最终造成不可逆转的视力丧失。青光眼疾病治疗的关键是早发现、早干预,延缓疾病进展[1]。根据病情严重程度,青光眼治疗可分别采用降眼压滴眼液、激光修复小梁网、小梁切除手术、微创伤手术和房水引流装置植入术等方法,其中绝大部分青光眼患者是通过外用降眼压滴眼液进行治疗。
在临床应用中,降眼压滴眼液局部给药的方式,因其操作便捷,且患者可独立完成,在青光眼患者中的接受程度最高。但目前的降眼压治疗仍面临着严重的用药困境,主要为药物生物利用率低、眼部药物浓度呈现波动性,以及患者依从性差,简单的药物治疗不能很好地控制高眼压,很多轻症患者会快速发展成中重度青光眼,或者药物对眼局部的毒性作用造成难治性青光眼,直至完全失明[1]。此外,青光眼是一种需要终生用药治疗的慢性疾病,目前的用药方案,对很多发展中国家患者来讲,是不小的经济负担。
因此,研发高效药物递送系统成为新的发展方向。近年来,新型药物递送系统的开发,主要在于药物递送植入器件、药物递送凝胶、药物递送纳米缓释滴眼液等领域[2]。研究人员分别从降眼压的幅度、药物释放量、安全性能等方面,对相应的药物递送系统进行评估和总结。本文将就近年来基于高分子材料研发的降眼压药物递送系统进行简单的综述分析。
1 青光眼降眼压药物治疗现状
1.1 降眼压药物、给药方式及临床用药困境
1.1.1 眼局部降眼压药物主要包括前列腺素衍生物、肾上腺素能α受体激动剂、肾上腺素能β受体阻滞剂、碳酸酐酶抑制剂、拟胆碱类药物等。降眼压作用机制主要分为增加房水外流和减少房水生成,其中增加房水外流又可以分为小梁网途径和葡萄膜巩膜途径。目前绝大多数药物主要用于减少房水生成,以及增加葡萄膜巩膜途径的房水外流,作用于小梁网途径的药物相对较少[3]。
1.1.2 给药方式及临床用药困境全身用药治疗眼部疾病会遇到血-眼屏障,眼内药物浓度很难达到有效治疗浓度,增大用药会造成全身系统性副作用和药物首过代谢[4]。因此,青光眼降眼压药物治疗主要通过滴眼液局部给药,市场占比可达90%以上。滴眼液局部给药会遇到泪膜-角膜屏障,该屏障包括动态屏障(泪液稀释和结膜吸收转运等)和角膜静态屏障(角膜上皮层、基质层、内皮层)(图1)。动态屏障的泪液稀释转运作用是局部给药的第一道屏障,药物会刺激角膜反射性增加泪液分泌,最终使70%~80%的药物从鼻泪道排出或溢出眼外,结膜上皮细胞层中大量的血管和淋巴管会加速药物代谢[5],泪液中的蛋白还可结合药物,造成药物损失[6],能真正发挥治疗作用的药物不到5%[7]。角膜是局部给药的第二道物理屏障,角膜对药物的透过性与角膜上皮层完整性和药物自身理化性质有关。角膜上皮细胞层结构中的紧密连接包含缝隙连接和闭锁小带[8],该结构可阻止亲水药物从细胞间穿过,从而阻碍药物分子经细胞旁转运。眼部炎症反应导致的细胞性能异化可改变药物穿透性、药物利用率和药代动力学过程[9]。传统滴眼液常用的防腐剂可破坏角膜上皮细胞层的紧密连接,增加药物的角膜透过性,但也会造成泪膜功能障碍、结膜充血等不良反应[10]。在需要长期、频繁使用滴眼液治疗的慢性眼病案例中,绝大部分患者存在用药不规范等情况[11,12]。
1.2 新型药物治疗技术
降眼压滴眼液在实际临床应用中,单种药物长期使用会造成药物敏感度降低。另外,许多临床青光眼病例仅用一种降眼压药物难以达到预期效果,需要多种药物联合使用,如前列腺素衍生物和β受体阻滞剂的联合制剂[13]。联合制剂虽然能提高疗效,但其本质仍然是滴眼液,无法从根本上解决药物生物利用率低和患者依从性差等问题。因此,研究新型降眼压药物递送系统或给药方式具有重要临床意义。
近年来,新型药物递送系统被广泛研究,包括药物递送植入器件、药物递送凝胶、药物递送纳米缓释滴眼液等。药物递送系统主要是基于材料工程化技术构建的可持续输送药物的新型制剂,使用最多的载体材料是生物医用高分子材料,以及基于高分子材料的复合材料。本文主要回顾并分析了近年来用于降眼压药物递送系统的高分子材料,以及由此制备的降眼压药物递送系统。

图1 眼球结构及眼部给药屏障Fig. 1 Eye structure and ocular barriers for drug delivery
2 用于降眼压药物递送系统的高分子材料
可用于降眼压药物递送系统的高分子材料可分为天然与合成两大类。天然高分子材料包括壳聚糖(CS)、透明质酸(HA)、海藻酸(SA)、纤维素(Cellulose)、环糊精(CD)、胶原(Collagen)和明胶(Gelatin)等;合成高分子材料包括聚酯类的聚乳酸(PLA)、聚己内酯(PCL)、聚乳酸羟基乙酸共聚物(PLGA),聚醚类的聚乙二醇(PEG)、聚苯醚(PPO)和聚酰胺-胺类(PAMAM)等。用于眼部给药的载体材料需要具备良好的生物相容性,最好具有生物可降解性。基于此制备的递送系统应该具有适当的外形尺寸、稳定的理化性质和良好的组织穿透性。表1简要列举了可用于制备降眼压药物递送系统的高分子材料。

表1 可用于制备降眼压药物递送系统的高分子材料Table 1 Polymer materials used to develop drug delivery systems for lowering intraocular pressure
3 新型降眼压药物递送系统
3.1 药物递送植入器件
眼用药物递送植入器件是一类具有特定外形(如片状、柱状、环状等)的固体或半固体的高分子材料载药复合物,用于角膜表面、结膜囊或眼内前房等位置[41],直接递送降眼压药物。图2汇总了几种常见的降眼压药物递送植入器件和用药位置。

图2 降眼压药物递送植入器件和用药位置[42-44]Fig. 2 Basic shape and location of the solid implants for intraocular pressure-lowering treatments[42-44]
3.1.1 角膜接触镜角膜接触镜药物递送系统是将药物负载在角膜接触镜表面或内部,使患者在佩戴角膜接触镜的同时,治疗眼部疾病(图2(a))。载药方式主要包括浸泡法、分子印迹法和胶体纳米粒子负载法[45]。与普通滴眼液相比,角膜接触镜可增加药物与角膜表面的接触时间,显著提高药物生物利用率[46]。其中浸泡法在角膜接触镜药物递送系统中应用较为广泛,如缓释递送噻吗洛尔[47]、毛果芸香碱[48]和酒石酸溴莫尼定[49]等。
Li团队[47]将噻吗洛尔负载于聚甲基丙烯酸-2-羟乙酯( pHEMA)隐形眼镜后,建立了一个基于角膜接触镜的药物转运和角膜吸收模型。通过改变聚合物分子量以及药物与聚合物的比例,来控制药物释放性能。结果表明至少有20%的噻吗洛尔进入了角膜。为了进一步调控药物释放速率,药物可首先负载于纳米粒子中,然后载药纳米粒子再与角膜接触镜复合,制备出复合载药角膜接触镜,依靠多级调控机制可显著改善药物释放速率。Schults团队[49]将马来酸噻吗洛尔、酒石酸溴莫尼定分别负载于甲基丙烯酸甲酯和乙烯基吡咯烷酮复合纳米凝胶,再将其分散于水凝胶中制备成水凝胶角膜接触镜。体外释放结果表明药物在1 h内集中释放,可显著降低青光眼患者的眼压(连续14 d每天佩戴30 min)。Kim团队[50]将马来酸噻吗洛尔负载于钕纳米凝胶后,再将载药钕纳米凝胶嵌入水凝胶中,制备出马来酸噻吗洛尔复合角膜接触镜,其药物释放量每天约0.2 μg或标准剂量的11.3%。在前人的研究基础上,Maulv等[51]将噻吗洛尔负载于乙基纤维素纳米粒子后,再将载药纳米粒子分散于丙烯酸水凝胶中,制备出噻吗洛尔复合角膜接触镜,在兔眼实验中可持续降眼压达192 h。为了在动物模型中探索出隐形眼镜递送降眼压药物的功效,Peng等[52]将噻吗洛尔负载于硅酮水凝胶后,制备出噻吗洛尔硅酮水凝胶角膜接触镜。基于比格犬青光眼动物模型,与普通滴眼液相比,仅用1/3药物的载药角膜接触镜可以实现类似的眼压降幅,表明载药角膜接触镜具有更高的药物生物利用度。由于比格犬角膜形状和大小与人类相似,因此该研究对临床工作有指导性的意义。
角膜接触镜虽是一种有效的眼部药物递送系统,但仍面临一些现实问题,如:光学清晰度、患者佩戴舒适度和生物相容性、离子和氧气渗透性,以及诱发微生物性角膜炎和干眼症等[53]。因此,大剂量长时间递送药物仍面临巨大的挑战,角膜接触镜药物递送系统的商业化道路依然漫长。然而,随着当代人越来越多地使用角膜接触镜进行视力矫正,通过改善材料以及相关技术后,角膜接触镜药物递送系统可能会获得更广泛的接受。
3.1.2 泪点塞泪点塞是一种可以植入泪小管的棒状药物递送系统[54]。如拉坦前列素泪点塞递送系统(L-PPDS),每个塞子装有70.5 μg拉坦前列素,将2枚L-PPDS(共含药141 μg)塞入泪小管,30 d内眼压平均降幅达5.7 mmHg[54](图2(b))。Perera等[55]将曲伏前列素负载于聚乳酸微球中,并进一步分散到聚乙二醇水凝胶中,干燥后制成杆状泪点塞,泪点塞在植入泪小管后与泪液混合体积膨胀,可以填满泪小管空隙,在30 d内缓慢释放药物,可降低眼压24%(t=10 d)和15.6%(t=30 d)。
3.1.3 眼前房载药植入物为了改善眼表给药所带来的生物利用率低和患者依从性差等问题,人们研究开发了可植入眼前房的载药植入棒。如Allergan公司推出的比马前列素缓释棒(Bimatoprost Sustained-release implant)[42],临床试验表明,含15 μg比马前列素缓释棒的降眼压效果与局部外用比马前列素滴眼液相当(8.1 vs 8.4 mmHg),单次植入比马前列素缓释棒可控制大多数患者的眼压长达6个月,显著改善患者的预后(图2(c))。Jucara等[16]利用壳聚糖制备了比马前列素眼前房植入物,可在8 h内持续释放药物、降低眼压。Kim等[56,57]将降眼压药DE-117的前体药hDE-117封装于PCL膜中,体外释放显示药物释放速率约为每天0.5 μg,以接近零级释放模式释放药物达6个月。装置植入眼的眼压下降了4.6 mmHg,而对侧眼的眼压变化仅为0.3 mmHg。此外,Natu等[30,31]利用聚(ε-己内酯)和聚环氧乙烷-b-聚环氧丙烷-b-聚环氧乙烷复合载体材料和多佐酰胺制备了眼前房载药植入物,能够持续释放多佐酰胺达20 d,眼压降低幅度可达20%,与Trusopt滴眼液治疗效果相当。
3.1.4 结膜穹隆植入物结膜穹隆植入物是可以植入结膜穹隆位置的药物递送系统,包括块状或环状结构,结膜穹隆植入物具有类似角膜接触镜的使用便利性,不会遮挡视野,对角膜上皮细胞没有刺激作用[41]。Ocusert是1974年最早被FDA批准的储库类型的眼结膜穹隆植入物,具有良好的稳定性和氧气渗透性,可以显著增加药物与角膜接触时间、提高药物生物利用率、减少给药次数和全身副作用、提高患者的依从性[21],但由于在临床使用过程存在一些问题,已于1993年被停用。为了进一步提高其药物释放率及降低眼压的幅度,Macoul等[58]将毛果芸香碱负载于Ocusert,并将其植入结膜穹隆,以零级释放模式在7 d内持续释放毛果芸香碱,可降低眼压至21.7 mmHg(使用前为27.6 mmHg)。另外,Brandt等开发了一款缓释比马前列素的眼用植入物,将其运用于结膜穹窿处,比马前列素植入物可降低眼压达20%或4~6 mmHg,且能够在6个月内维持较低眼压。为了进一步提高眼压的降低幅度,ForSight VISION5公司开[43]发了一款比马前列素眼结膜穹隆环HeliosTM,其直径为24~29 mm,横截面直径为1 mm,聚丙烯支撑结构被硅酮基质包覆,比马前列素分布在硅酮基质中(图2(d))。二期临床试验表明,负载13 mg比马前列素的眼结膜穹隆环,可在6个月内持续稳定释放药物,使眼压平均降低4.7~6.5 mmHg。此外,Shokry等[26]利用PLGA复合材料制备了噻吗洛尔缓释膜,在高眼压兔眼结膜囊中单剂量应用,可在7 d内将眼压降幅控制在7 mmHg。另外,Nair团队[21]还利用海藻酸钠/乙基纤维素复合材料,制备了马来酸噻吗洛尔结膜穹隆植入物,其F4制剂(0.2 mg海藻酸钠/0.4 mg乙基纤维素)表现出83.4%的最大药物释放量,以及更显著的降眼压效果,在3 d之内眼压由30 mmHg降为15 mmHg。
3.1.5 微针微针是一种设置有大量微针的膜状药物递送系统,通过刺穿组织浅表皮层,直接将药物递送到目标组织,克服皮肤组织屏障[59]。微针给药方式取决于微针的设计方式,包括实心外涂层型、中空型和可降解型[60]。微针的微小突起结构,侵入性非常微小,能够一定程度上克服当前常规药物递送系统的缺点,穿越眼屏障,将药物直接递送至所需部位(图2(e))。Jiang等[61]将荧光素钠涂在微针表面,用于人尸体巩膜和兔角膜,前房中的荧光素浓度比局部滴眼液给药高出70倍,表明微针可以通过巩膜和角膜途径将荧光素输送到眼内。该团队又将负载了罗丹明的载药纳米粒子组装到中空微针中用于人尸巩膜[62],组织影像分析表明,空心微针能以最小侵入方式将药物通过巩膜输送到眼内。微针也可以刺入脉络膜上腔,将药物递送到脉络膜和邻近视网膜,以达到眼后段定向给药,如Kim等将负载了青光眼降压药物硫前列酮和溴莫尼定的中空微针定位于睫状体上方的巩膜位置,准确递送降眼压药物到睫状体,可使双侧眼压下降3 mmHg,与局部眼表滴眼液给药相比,药物剂量节省了约100倍。
3.2 降眼压药物缓释凝胶
在实际应用中,青光眼降眼压滴眼液在眼表停留时间常常较短、渗透性较差、药物生物利用率低[63]。研究表明,凝胶药物递送系统可以在不明显增加用药难度的前提情况下,显著延长药物作用时间、增大药物生物利用率,并最终提高降眼压效率[64]。凝胶药物递送系统可分为物理凝胶和化学凝胶。
3.2.1 物理凝胶物理凝胶是一种依靠物理相互作用形成的凝胶状材料,一般具备环境敏感性,如剪切敏感性、pH敏感性和温度敏感性(图3)。
(1)剪切敏感型:通过剪切变稀特性降低超分子水凝胶的黏度,使其具备一定的流动性或可注射性,以此来递送给药。Wang等[65]使用α-环糊精和4臂PEG形成支链聚轮烷超分子水凝胶,所得的超分子水凝胶显示出独特的剪切敏感性,表现出可逆的凝胶-溶胶转变。将溴莫尼定负载到α-环糊精/4臂PEG凝胶中,观察到药物释放行为受到剪切应力的影响。这种剪切敏感型凝胶适于制备缓释滴眼液或可注射药物缓释制剂,实现药物的控制释放。
(2)pH敏感型:弱酸性聚合物(多元酸)随外部pH的增加而溶胀,而弱碱性聚合物(多元碱)则随外部pH的增加而收缩,聚合物通过接受或释放质子对环境pH做出反应。基于上述弱酸性或弱碱性聚合物制备的水凝胶则表现出一定的pH敏感性。常用的pH敏感凝胶包括:羧乙烯聚合物卡波姆和醋酸纤维素邻苯二甲酸酯(CAP)[60]。Barse团队[66]以卡波姆与羟丙基甲基纤维素作为原料,开发了一款pH敏感的酒石酸溴莫尼定原位凝胶图3(a1)。相对市售滴眼液在2~3 h内仅降低13.4%的降眼压幅度,缓释制剂可在8 h内持续降眼压幅度达45.7%,凝胶载体显著优化了药物递送过程,延长了药物的降眼压作用时间,且提高了药物的生物利用率。Kouchak团队[67]基于卡波姆与羟丙基甲基纤维素(HPMC)复合材料开发了一种用于盐酸多佐胺(DRZ)眼部给药的pH触发原位凝胶,研究了其流变行为和体外药物释放,最佳制剂配方为含1 mg/mL卡波姆和1 mg/mL HPMC的DRZ(20 mg/mL)复合凝胶体系。与市售滴眼液和20 mg/mL的DRZ水溶液相比,该制剂的最大眼压降幅可达26.4%。Gupta 团队[68]基于卡波姆和壳聚糖复合材料开发了一款负载马来酸噻吗洛尔的pH敏感型凝胶给药系统,4 mg/mL卡波姆-5 mg/mL壳聚糖复合凝胶体系在室温、pH=6.0的条件下为液态,而当pH=7.4时迅速转变为凝胶。该给药系统可在24 h内持续释放马来酸噻吗洛尔,并且能有效抑制药物早期突释,提高药物的生物利用率。
(3)温度敏感型:温度敏感型凝胶一般室温下呈液态,升高温度或接触体温后,溶液相转化为凝胶态。常见的温敏凝胶有:聚(N-异丙基丙烯酰胺)、泊洛沙姆、壳聚糖、羧甲基纤维素(CMC)、羟丙基甲基纤维素[60],以及基于亲水/疏水分子链段的双亲性聚合物(如PEG与PLA、PLGA和PCL的共聚物)[37](图3(a2))。眼用温敏凝胶室温下呈液态,负载药物后滴加到角膜表面,遇热后溶液转化为凝胶态。Maria团队[24]将尼莫地平-环糊精复合物掺入壳聚糖滴眼液中,研发出一款眼用温敏原位凝胶系统。当温度从25 ℃升到生理温度(37 ℃)时,该制剂经历了溶液到凝胶的转变,能够增加在眼表的停留时间。相比市售尼莫地平制剂仅有2.8 h的有效降眼压时间,含有0.6%(质量分数)尼莫地平-环糊精复合物的壳聚糖滴眼液,其降眼压持续时间可延长到5.9 h。Li团队[69]基于泊洛沙姆和卡波姆研发了一种负载布林佐胺的眼用温敏原位凝胶,该缓释系统可在33 ℃表现出溶胶-凝胶转变,可在8 h内从温敏凝胶中缓释布林佐胺,显著提高药物生物利用率。Cao团队[70]基于聚(N-异丙基丙烯酰胺)-壳聚糖复合温敏凝胶制备了马来酸噻吗洛尔药物缓释系统,与相同浓度的噻吗洛尔滴眼液相比,该缓释系统可在12 h内获得更显著的眼压降幅。Song团队[71]研发了一款由β-甘油磷酸酯和琼尼平共交联的壳聚糖-明胶水凝胶,以负载降眼压药物马来酸噻吗洛尔。该复合体系在37 ℃下可快速形成凝胶,其降眼压效果长达24 h。为了进一步提高物理凝胶的稳定性、优化药物缓释行为,本课题组将纳米粒子引入到双亲性温敏聚合物PLGA-PEG-PLGA水溶液体系中,构建了溴莫尼定复合温敏凝胶递送系统[37]。该温敏复合凝胶系统可支持溴莫尼定持续释放,一次用药可在7 d内维持较低的眼内压。
近年来,整合多种凝胶形成双/多刺激敏感凝胶系统正成为一种新趋势。双/多刺激敏感凝胶可以优势互补,提高药物生物利用率和患者的依从性。Gupta团队[72]整合温敏聚合物泊洛沙姆与pH敏感聚合物壳聚糖,以负载降眼压药物马来酸噻吗洛尔。2.5 mg/mL的壳聚糖和90 mg/mL的泊洛沙姆具有较好的胶凝能力,在10 h内累积释放药物达98%,显著增加药物在眼表滞留时间,减少给药次数,提高药物生物利用率。
3.2.2 化学凝胶化学凝胶是一种依靠化学反应形成的凝胶状材料,不会随外界环境的改变而发生溶液化。El-Feky团队[73]在氧化蔗糖的辅助下构建了明胶-壳聚糖化学凝胶,以此来缓释降眼压药物噻吗洛尔(图3(b))。噻吗洛尔复合凝胶体系在给药后0.5 h开始出现眼压下降,在2 h后达到最大降幅,并持续降眼压达24 h。为了进一步提升药物的释放速率,Wang等[74]基于聚酰胺酰胺(PAMAM)树枝状聚合物和聚乙二醇二丙烯酸酯,利用氮杂-迈克尔加成反应制备了轻度交联的树枝状聚合物水凝胶,负载降眼压药物酒石酸溴莫尼定。超过70%的药物在6 h内完成释放,在24 h内达到100%的药物释放。与空白对照组相比,该药物的角膜渗透率提高了5倍,药物生物利用率显著提升。
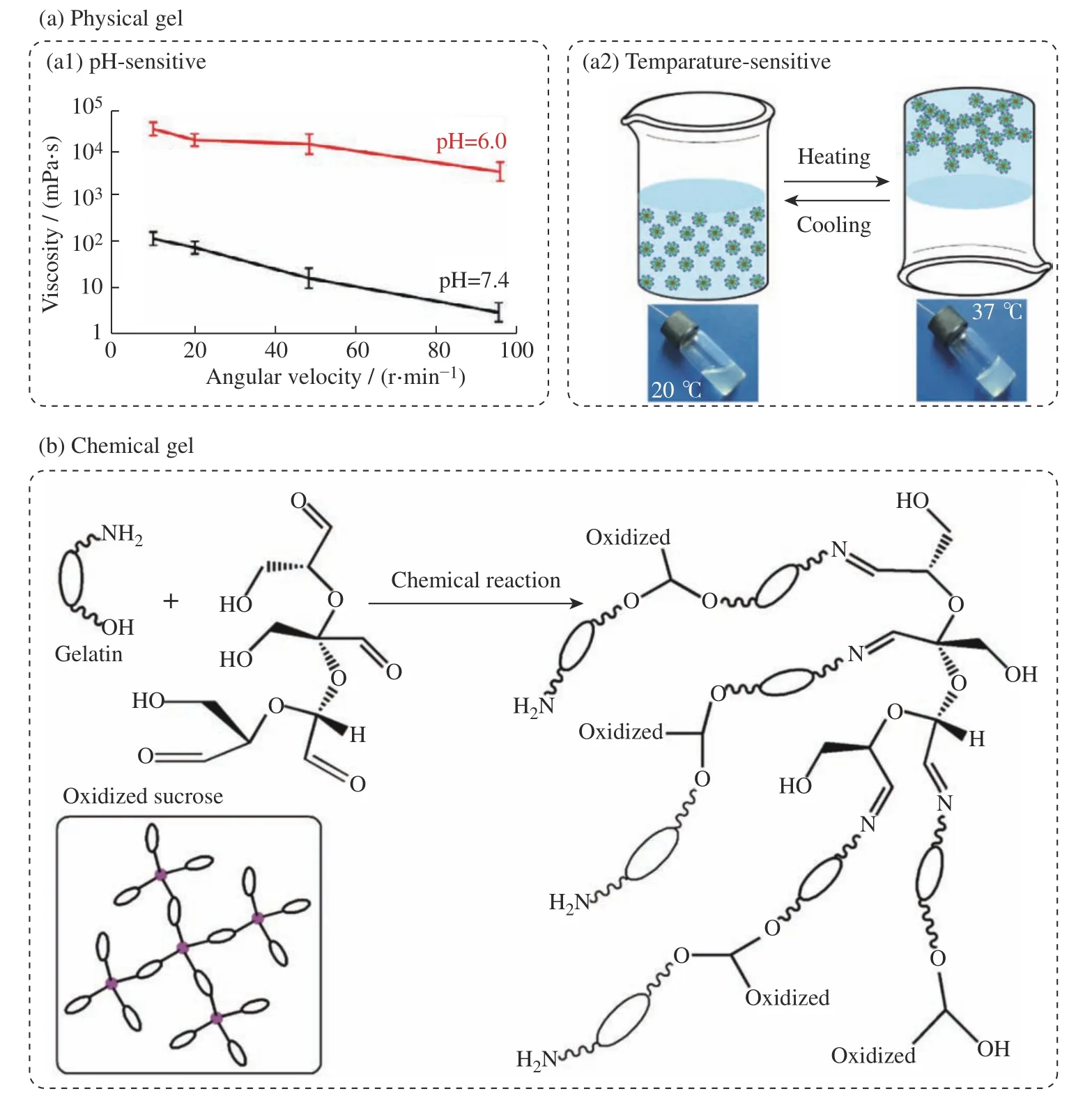
图3 降眼压凝胶药物缓释系统[37, 66, 73]Fig. 3 Schematic diagrams of gel-based drug sustained release systems for intraocular pressure-lowering treatment[37, 66, 73]
3.3 纳米药物递送系统
纳米药物递送系统将药物封装在纳米载体(如纳米粒子、脂质体/微脂囊和树状大分子等)中,递送至眼内预期位置并释放。纳米药物递送系统能够增强药物治疗效果并减少副作用[75]。图4汇总了可用于降眼压药物递送系统的高分子材料纳米粒子及其给药途径。

图4 用于降眼压药物递送系统的高分子纳米粒子及其给药途径示意图[76, 77]Fig. 4 Schematic diagrams of macromolecular nanoparticles used in intraocular pressure-lowering drug delivery systems and their administration routes[76, 77]
3.3.1 纳米粒子纳米粒子可以负载并保护降眼压药物,调节药物的物理性质,以延长药物作用时间、增加药物的角膜穿透性[78],在降眼压药物递送系统中被广泛应用(图4(a))。
(1)壳聚糖及其复合材料:壳聚糖天然带正电荷,能与带负电荷的角膜上皮细胞膜产生静电相互作用,因此在降眼压药物递送系统中得到了广泛应用[79]。Zhao团队[14]使用糖基化壳聚糖,制备了噻吗洛尔药物递送纳米粒子,眼表滴加后的4 h内,其降眼压最大值为10.5 mmHg,且持续降低眼压长达12 h。基于壳聚糖构建的复合纳米粒子也被广泛用于降眼压药物递送系统,如壳聚糖-海藻酸钠纳米粒子、壳聚糖-透明质酸纳米粒子、壳聚糖-果胶纳米粒子等,新组分的增加有利于改良纳米粒子的基本理化性质,有利于药物递送效率的提升。Zhu团队[80]制备了硫代壳聚糖-海藻酸钠纳米粒子,证实硫代后的纳米粒子体积更小,稳定性和黏膜黏附性更高,更容易被角膜上皮细胞摄取,并将异硫氰酸荧光素作为模型药物送入前房,验证了其在降眼压药物递送系统中作用。Kashiwagi等[81]研究了负载拉坦前列腺素和β受体阻滞剂的壳聚糖/海藻酸钠离子互补型纳米片,纳米级别的片状结构可牢固黏附于角膜表面实现长效药物递送,且几乎不影响光线折射率和视力。Wadaha团队[18]使用离子凝胶法制备了负载盐酸多佐胺的壳聚糖-透明质酸纳米粒子,且评估了其降眼压效果与药物释放速率。该制剂的释放量在4 h内即显示峰值效应,并保持长达12 h。该缓释系统可将基准眼压降低9.9 mmHg。另外,Dubey团队[15]制备了负载布林佐胺的壳聚糖-果胶纳米粒子,与商业制剂Azopt(10 mg/mL布林佐胺悬液)相比,壳聚糖-果胶纳米粒子具有更高的角膜渗透率,在8 h观察周期内其最大降眼压幅度可达23%。Khan团队[28]用表面修饰了壳聚糖的PLGA纳米粒子负载佛司可林,体外环境下72 h内可累积释放90%的佛司可林,24 h内有78.7%的药物可渗透通过离体山羊角膜显示出较好的药物递送效率。Pandian团队[82]用不同分子量PEG表面修饰的壳聚糖纳米粒子负载天然抗氧化剂白藜芦醇和槲皮素,在正常眼压兔眼中显示出持续的降眼压效果(5.5 mmHg)。
(2)明胶及其复合材料:明胶作为天然生物材料已被广泛用作多种降眼压药物递送系统,调节明胶基本性质可以最大程度地提高药物递送效率。Shokry团队[26]用明胶纳米粒子负载马来酸噻吗洛尔,与市售噻吗洛尔滴眼液相比平均眼压降低31%,该缓释制剂可在24 h内将基准眼压降低达52%。Liao团队[27]利用表面修饰了明胶分子的介孔二氧化硅纳米粒子负载噻吗洛尔,在兔眼前房内注射给药后,该缓释系统可有效降低兔眼眼压达21 d。Bhalerao团队[83]以明胶为原位胶凝剂,制备了负载布林佐胺的纳米凝胶乳液。相对于生理盐水和安慰剂对照组,该缓释制剂降眼压幅度可达13 mmHg,药物在眼表的平均停留时间显著延长到6 h。
(3)聚酯高分子材料:可用于制备纳米粒子的聚酯高分子材料包括PLGA、PCL和PLA等,都属于可生物降解并具有生物相容性的人工合成聚合物[33,34]。Lee团队[34]用PCL制备了纳米粒子和纳米胶囊,分别负载毛果芸香碱,结果表明纳米胶囊比纳米粒子多容纳3倍的毛果芸香碱,并可在兔高眼压模型中维持42 d的降眼压作用(图4(b))。
3.3.2 脂质体脂质体也叫微脂囊,是由自然或人工合成的脂质分子组装而成的囊泡状结构,可以是单层或多层[84](图4(c))。脂质体独特的双亲性囊状结构,使它具有可高效负载亲水性和亲脂性药物的双重特性[85]。脂质体具有与天然细胞膜相似的结构和良好的生物相容性,被认为是非常有产业化潜力的药物递送系统[1],是近年来最热门、研究最多的纳米制剂之一。Fahmy团队[86]用二棕榈酰磷脂酰胆碱( DPPC)脂质体负载拉坦前列素,该脂质体的载药量达到88%。相比市售拉坦前列素滴眼液在24 h内可将兔眼眼压从35 mmHg降至33 mmHg,该缓释制剂可在相同时间内将兔眼眼压从35 mmHg降至26 mmHg。为了进一步提高药物负载量,Natarajan团队[87]用改良薄膜水合技术制备卵磷脂酰胆碱脂质体负载拉坦前列素,该脂质体载药量高达94%。通过兔眼结膜下注射,可在90 d内持续降低兔眼眼压4.8 mmHg。Huang团队[88]用蒙脱土负载盐酸倍他洛尔,再用脂质体包裹,形成眼用药物递送系统,给药2 h后可降眼压达22.4%。Li等[89]用磷脂、甘油棕榈脂制备了载有醋甲唑胺(MTA)的固体脂质体,结果表明,相比MTA水溶液仅12.6%的降眼压幅度,缓释制剂的相应值可达35.7%,负载MTA的固体脂质体降低眼压的效果良好,并且持续时间更长。
3.3.3 树状大分子树状大分子也叫级联分子[90],是一种具有表面功能的支化三维大分子结构,被认为是最有前景的靶向药物递送系统之一(图4(d))。聚酰胺-胺(PAMAM)是制备树枝状大分子的常用聚合物[91]。PAMAM树状大分子可呈液态或半固态,含有大量的羧基、胺和羟基基团,对水溶性差的药物具有良好的增溶作用。Vandamme团队[39]利用PAMAM树状大分子负载托吡卡胺或硝酸毛果芸香碱,在兔眼眼压调节方面,PAMAM树状大分子的平均角膜停留时间为4~5 h。含有羟基和羧基末端基团的PAMAM树状大分子使毛果芸香碱的缩瞳效应增加了1.4~1.6倍,使托吡卡胺的扩瞳效果增加1.1~1.3倍。为了进一步提升树状大分子递送药物的效率,且增加其稳定性,Spataro团队[40]开发了含磷树状大分子,核心为季铵盐,周边为羧酸基团,降眼压药物卡替洛尔的氨基与树状大分子的羧基经离子键结合,得到的阳离子溶液可增加药物在眼表的停留时间,第2代树状大分子可将兔眼房水中卡替洛尔浓度提高2.5倍。
4 展 望
持续高眼压是青光眼发生和发展的直接原因,降眼压是青光眼疾病治疗唯一公认的干预措施。目前进入临床应用的几款基于高分子材料的药物递送系统,虽然能够持续较长时间释放药物、降低眼压,但仍面临生物安全性和患者依从性等方面的挑战,患者不得不接受频繁的眼内注射给药,显著增加了眼内炎的发生风险。以无创化、低风险和高便利的方式持续递送药物,是需要思考和解决的问题。随着科学技术的进步,新型药物递送系统逐步走向复合化、靶向化和智能化。复合化,是借助多种载体材料将两种或多种药物整合在一起,制备成适合眼部使用的复合制剂,扬长避短,协同发挥作用递送药物。靶向化,是在药物缓释系统中整合可特异性识别特定目标组织或细胞的生物靶向分子,将药物精准递送到疾病位置。智能化,是基于pH、离子浓度、温度、光和磁等环境刺激响应性聚合物构建的智能化药物递送系统,当受到特定条件触发时,在适当的位置释放适当量的降眼压药物,药物递送系统可以根据疾病需要动态调整给药目标和给药量,使药物生物利用率和组织安全性最大化。在不久的将来,更多更高效的药物递送系统必然会被逐渐开发出来,用于临床治疗青光眼高眼压疾病。

