生物解离对豆乳体系稳定性的研究
陈 龙,于爱华,王冬梅,李 波
(黑龙江省北大荒绿色健康食品有限责任公司,黑龙江佳木斯 154000)
大豆富含丰富的营养成分,含有大量的蛋白质、脂肪和碳水化合物,此外还含有丰富的维生素,含有人体所必需的8种氨基酸。而豆乳是大豆食品中的一种,含有多种功能性成分如大豆低聚糖、异黄酮和软磷脂等,一直受到消费者的青睐,行业发展迅速,其产量和产品品种也在不断增加。但在传统工艺制备豆乳的过程中,蛋白质容易凝集沉淀,严重时出现分层现象,严重影响其感官质量和营养价值。针对豆乳稳定性的提高,大量的研究主要集中在传统工艺参数的优化,尚不能解决长期存储过程中豆乳稳定性的问题。
生物解离技术是一种新型的生物技术,广泛应用于各个领域。众多研究学者主要研究采用生物解离技术提取植物油脂和蛋白质。张根生等[1]在研究水酶法提取南瓜籽油过程中,联合化学法进行破乳。吴海波等[2]对大豆油工艺乳状液的破乳开展了相关研究,发现解离条件在pH8.0,解离时间为3 h,破乳效果最好。同时,研究学者采用生物解离技术成功的从核桃中提取植物油脂[3]。王欢等[4]采用生物解离技术研究富肽豆粉蛋白质亚基及功能性的变化。钟明明等[5]将生物解离大豆膳食纤维作为一种改性膳食纤维应用于饼干中,开发新型大豆膳食纤维烘焙食品。生物解离技术结合传统豆乳的制备工艺,对豆乳稳定性的分析未见报道。
因此,本实验采用生物解离技术结合传统豆乳的生产工艺,测定粒径分布、Zeta电位、流变学特性、乳化活性和乳化稳定性,并结合多重光散射分析,探究生物解离时间对豆乳稳定性的影响,从而为生物解离豆乳的增值利用提供新思路,为开发新型豆乳产品提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
东农42大豆 东北农业大学大豆研究中心;Alcalase 2.4 L碱性蛋白酶10万酶活力 诺维信(中国)生物技术有限公司;磷酸氢二钠、磷酸二氢钠、盐酸 天津市耀华化工厂;氢氧化钠 天津市天大化学试剂厂;十二烷基硫酸钠(SDS) 博士德生物有限公司;麦芽糖浆 山东西王糖业有限公司;消泡剂 美博食品科技有限公司;其它试剂 均为国产分析纯。
JE-502电子天平 上海浦春计量仪器有限公司;FA2004电子分析天平 上海舜宇恒平科学仪器有限公司;HH-4电热恒温水浴锅 余姚市东方电工仪器厂;Mastersize2000激光粒度分析仪 英国伍斯特郡马尔文仪器有限公司;多重光散射仪 德国Dataphysics公司;Turbiscan Lab Expert稳定性分析仪 法国Formulaction公司;DHG-9240A型电热鼓风干燥箱 上海一恒科学仪器有限公司;PHS-25C数字酸度计 上海大普仪器有限公司;ZetaPALS-Zeta电位仪 美国布鲁克海文仪器公司;722型可见分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 生物解离豆乳的制备 大豆生物解离豆乳制备流程参考江连洲的方法[6],过程如下:
大豆→清理→浸泡(6 h)→磨浆(干豆∶水=1∶6)→过滤(过200目筛布)→豆乳→生物解离(2.0‰Alcalase 2.4 L碱性蛋白酶v/v,50 ℃,pH=8,0、10、20、30 min)→灭酶(沸水浴10 min)→冷却→调配浓缩(pH=7.0~7.2)→均质(10 MPa,5 min)→生物解离豆乳。
1.2.2 多重光散射稳定性的测定 参考姚盛宇[7]的测定方法。利用多重光散射稳定性分析仪测量生物解离作用时间下的豆乳稳定性,并测定动力学稳定指数(TSI)。将准备好的样品加入到多重光散射稳定性分析仪的样品分装瓶中(样品含量约20 mL),将分装好的样品瓶平稳的置于样品槽内,波长880、55 mm长度上每40 μm扫描一次,每个样品扫描时间为4 h,每2 min扫描一次,得到原始光学数据。
1.2.3 流体动力学半径及其分布测定 参考Shao[8]的测定方法。采用动态光散射技术,利用激光粒度分析仪测定生物解离豆乳的粒度分布。参数设置为:样品折射率1.520,颗粒吸收率0.001,分散剂为水,分散剂折射率1.330。试验采用D4,3,即体积平均直径表征液滴粒度的大小,生物解离豆乳样品制备出后立即测定,每个样品重复3次。
1.2.4 Zeta电位测定 采用ZetaPALS-Zeta电位仪测定样品的Zeta电位,通过pH7.0 0.05 mol/L的磷酸盐缓冲液来稀释生物解离豆乳中蛋白质质量浓度到2 mg/mL,上样体积为1 mL,测定温度为25 ℃,温度平衡2 min。计算3次重复得到的平均值为测定值。
1.2.5 流变学特性的测定 参考Wang等[9]的方法。利用DHR-1流变仪测定生物解离豆乳的稳态流变性质,在试验台上取1.00 mL的豆乳加在样品测试台上,温度设置为25 ℃,采用40.00 mm平行板夹具,狭缝距离设置为0.50 mm,剪切速率为0~100 s-1,检测样品流变特性。
1.2.6 乳化活性与乳化稳定性测定 参照Shao等[10]的方法,乳化活性(emulsion activity index,EAI)与乳化稳定性(emulsion stability index,ESI):取30 mL不同生物解离作用时间下的豆乳,分别加入10 mL大豆油均质使其混合均匀,取50 μL上述溶液加入5 mL 0.1%(m/V)SDS溶液,涡漩振荡混匀后在500 nm波长处测量吸光度A0。静置30 min后再次测定吸光度A30。乳化活性EAI(m2/g)和乳化稳定性ESI(min)计算公式如下所示:
式中:N为稀释倍数(250);C生物解离作用下豆乳溶液中蛋白质的质量浓度(g/mL);Φ为豆乳中油相体积分数;A0、A30分别为0、30 min时的吸光度值。
1.3 数据处理
2 结果与分析
2.1 多重光散射稳定性的测定
图1为生物解离条件下的豆乳溶液的多重光散射分析,当样品经过扫描后,其透射光曲线和背散射光曲线均为一条线时,表明溶液均一,样品粒径大小一致性较高。由图1可知,在生物解离作用下,豆乳样品均一性较好,较稳定。在生物解离作用时间为30 min时,样品的均一性和稳定性最好。TSI稳定性指数代表了整体分散体系的稳定性,数值越大,表明体系越不稳定[11]。由TSI曲线可知,随着时间的增加,TSI数值不断升高,稳定性越来越差。在相同扫描时间,生物解离作用30 min时,TSI数值最小,表面体系的稳定性最好。

图1 生物解离作用时间对豆乳稳定性的影响Fig.1 Effect of biological dissociation time on the stability of soymilk注:TSI图中横坐标为时间,m表示min,如2 h:20 m为2 h,20 min,其它同。
2.2 流体动力学半径及其分布测定
本文利用动态光散射技术研究分析不同生物解离作用时间下,豆乳的粒径分布及平均粒径的大小,其粒径变化主要由样品中蛋白质分子内的交联和聚集引起。由图2和图3可知,随着生物解离作用时间的延长,平均粒径变小,粒径主要分布在100~1000 nm,经生物解离作用20 min时,豆乳体系的平均粒径为456 nm。说明在生物解离作用下,碱性蛋白酶破坏了蛋白质的结构,蛋白质颗粒发生了解聚作用,使得蛋白质颗粒不断变小,平均粒径不断降低,因在本试验中生物解离作用对象为浓度较低的豆乳溶液,粘度较低,分子碰撞机率降低,未引起蛋白质分子的聚集,因此,平均粒径不断降低。张兴等[12]研究了生物解离条件下,大豆乳状液粒径分布情况,发现随着生物解离作用时间的延长,平均粒径先减少后增加,其粒径增大是因生物解离作用改变了乳液油滴表面的蛋白质结构,引起油滴表面的静电作用发生变化,同时增加了乳液中分子碰撞的机率,使乳油滴分子间趋于聚集。王立敏等[13]研究pH对蛋白质粒径分布情况发现,在接近蛋白质等电点时,表面净电荷最少,静电斥力最小,蛋白质发生解聚,充分伸展,活性残基充分暴露,蛋白质之间作用力最强,聚集速度最快,此时粒径最大。在偏离等电点时,静电斥力增大,蛋白质之间结合能力减弱,不易发生聚集,此时粒径最小。

图2 生物解离作用时间对豆乳的粒径分布的影响Fig.2 Effect of biological dissociation time on particle size distribution of soymilk
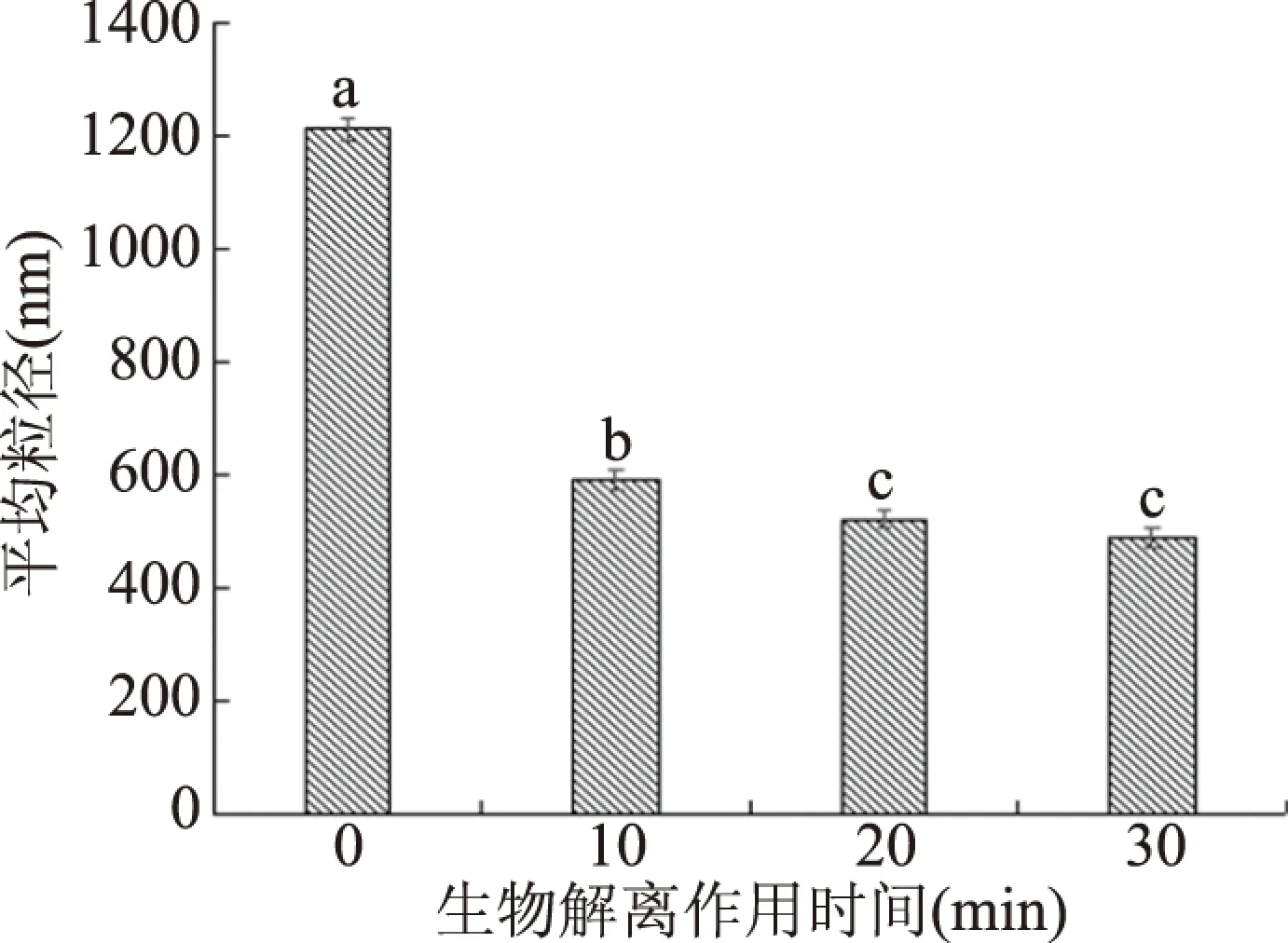
图3 生物解离作用时间对豆乳平均粒径的影响Fig.3 Effect of biological dissociation time on the average particle size of soymilk注:不同字母代表差异显著(P<0.05),图4、图6同。
2.3 Zeta电位测定分析
界面电势即Zeta电位用以表示对溶液中颗粒聚结造成的动力学障碍能力,促使溶液具有较好的稳定性[14]。生物解离作用时间对豆乳体系Zeta电位的影响如图4所示,经生物解离作用20 min时,Zeta电位值为28.9 mV,在生物解离作用时间为30 min时,电位绝对值最大为30.3 mV,此条件下的溶液中颗粒间的斥力较大,体系处于相对稳定状态。随着生物解离作用时间的增加,电位绝对值不断增大,说明生物解离作用有效增加了豆乳溶液体系界面电荷密度,增加了液滴间斥力,提高了豆乳体系的稳定性。在生物解离作用时间20和30 min时,电位绝对值均较大,变化不显著,说明在长时间的生物解离作用下,豆乳溶液体系界面电荷密度较大,电位绝对值差异不显著。陈林等[15]研究界面吸附蛋白电荷的静电斥力会影响油滴表面分子间的相互作用,而乳液的稳定性与界面吸附蛋白有密切关系,因此推测乳液的稳定性有可能与表面分子间的相互作用有关。
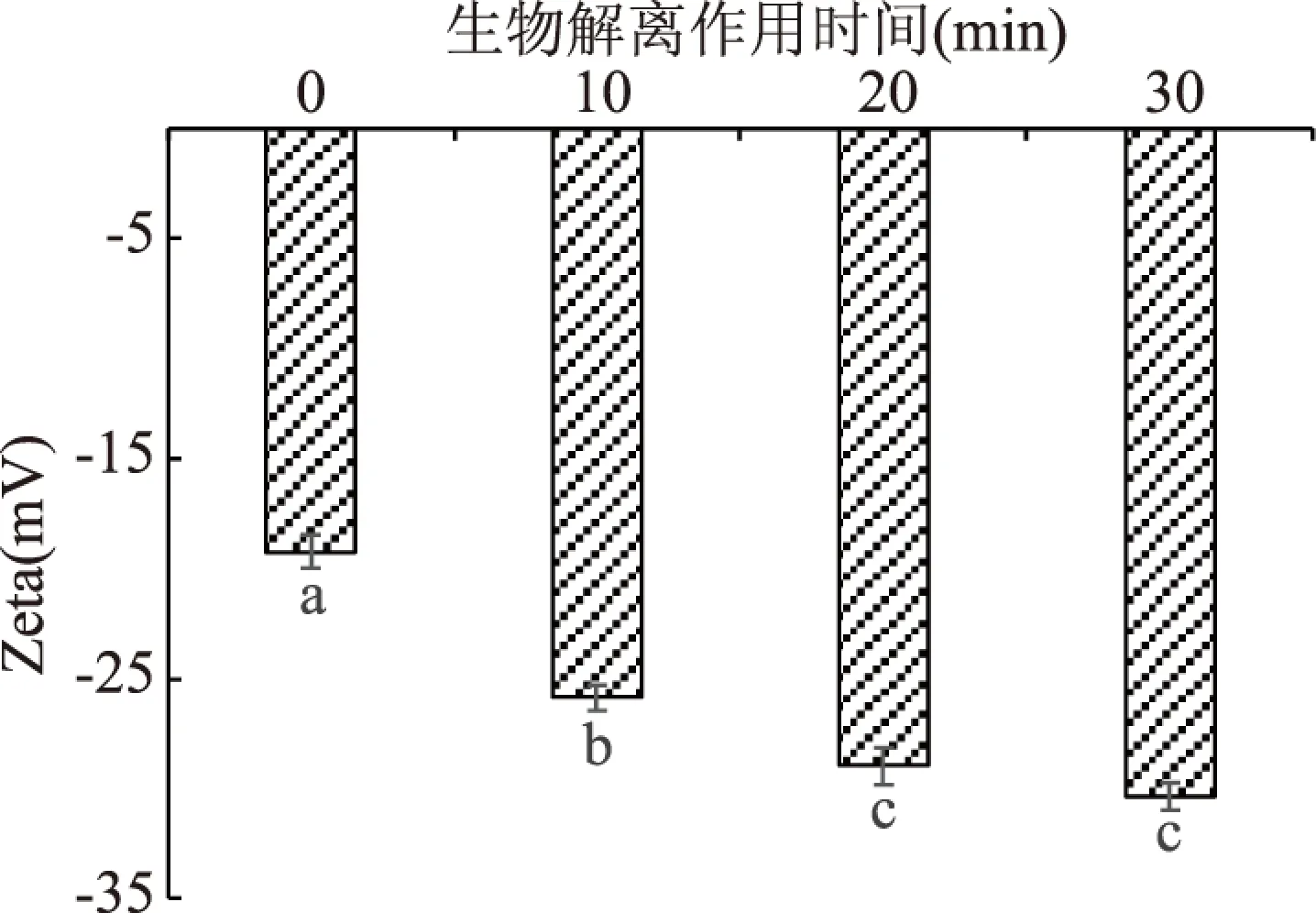
图4 生物解离作用时间对豆乳 Zeta 电位的影响Fig.4 Effect of biological dissociation time on Zeta potential of soymilk
2.4 流变学特性的测定分析
生物解离作用时间对豆乳黏度的影响如图5所示,在不同的生物解离作用时间条件下,豆乳的黏度随频率的变化趋势基本相同,随着频率的不断增加,豆乳的粘度呈现递减趋势,表明经过不同生物解离作用时间处理后,豆乳具有典型的假塑性流体的特征,且豆乳粘度的初始值和曲线形状具有一定的差异,这主要是由于豆乳本身的性质、颗粒间的相互作用、粒径分布和形变对流变学性质具有一定影响[16]。试验结果表明,生物解离作用后的豆乳界面成分发生变化,这可能是由于界面蛋白的水解使豆乳体系中蛋白大分子与水之间相互作用力减弱,导致粘度随之降低。另外,也可能是由于生物解离处理使得豆乳界面蛋白表面的负电性增强,导致界面蛋白与水的相互作用增强,引起粘度的降低[17]。

图5 生物解离作用时间对豆乳粘度的影响Fig.5 Effect of biological dissociation time on viscosity of soymilk
2.5 乳化稳定性测定
EAI表示的是溶液中蛋白/肽能够强烈吸附在油-水界面形成乳化层的能力;ESI代表溶液中乳滴的稳定能力。所以,EAI及ESI为表征溶液中蛋白质/肽乳化特性及稳定特性的重要指标之一[18]。Zhao等[19]及Lam等[20]研究发现生物解离不利于蛋白质的乳化特性,蛋白质的乳化特性和肽的尺寸之间存在明确联系,即酶解产生的小分子量肽会使蛋白质溶解性增加,降低蛋白质的乳化特性;同时,小分子量肽会降低界面张力不足以稳定乳液,也会削弱其乳化特性。不同生物解离作用时间下豆乳的EAI和ESI的变化如图6所示,随着生物解离作用时间的增加,EAI和ESI均呈现递减的变化趋势,且变化显著,这主要由于随着生物解离过程的进行,吸附在油滴表面的蛋白被酶解成小分子量的肽,导致其从油滴表面脱落,再重新与油滴吸附时,就不能迅速的吸附在油滴表面,界面膜就会遭受破坏,无法保持完整性,其EAI和ESI就会大幅度降低[21-23]。另外,蛋白酶的过度酶解也会使维持界面蛋白内部结构的力(例如氢键、范德华力、离子键等)慢慢被破裂,使包裹油滴的保护膜越来越薄,导致EAI和ESI的降低[24-25]。

图6 生物解离作用时间对豆乳蛋白EAI及ESI的影响Fig.6 Effect of biological dissociation time on activity index and stability index of soymilk
3 结论
本实验通过研究可知,生物解离技术结合传统豆乳制备工艺,可有效提高豆乳的稳定性,生物解离时间不同对豆乳稳定性的影响不同。经生物解离30 min后,豆乳溶液体系的Zeta电位绝对值最大为30.3 mV,平均粒径变小。以上结果表明,生物解离对豆乳稳定性的提高效果显著,可作为一种改变豆乳稳定性的手段,对豆乳稳定性进一步研究提供理论依据,但经过生物解离后,豆乳体系的乳化性能降低,适口性变差。因此,开发长期贮存稳定性与感官特性良好的豆乳具有重要意义。

