菱角梗、菱角壳提取物抑菌活性及其活性成分分析
王洪斌,陈云舒,严守雷,3,*,梅大佐,赵道华,张剑雄,王清章,李 洁,3
(1.武昌工学院食品与环境工程学院,湖北武汉 430065; 2.华中农业大学食品科学技术学院,湖北武汉 430070; 3.湖北省水生蔬菜保鲜加工工程技术研究中心,湖北武汉 430070; 4.湖北华贵食品有限公司,湖北洪湖 433200; 5.湖北天井湖农业科技服务有限公司,湖北黄冈 438203)
菱角(TrapabispinosaRoxb.)属菱科,是一种一年生自由漂浮的植物[1]。原产于欧洲和亚洲的温和地域,在中国主要种植于南方,特别是太湖地区和长江下游的珠江三角洲[2]。成熟的菱角外果皮坚硬,内有白色果实,口感甘甜[3-5],菱角中含有淀粉、膳食纤维、必需氨基酸、多酚、多糖等物质具有抗癌、抗肿瘤和抗氧化等一系列生物活性[6-8],因此菱角作为一种药食两用的果实一直以来受到中国人的青睐。
农产品加工过程中会产生大量副产物,这些副产物中很多都含有丰富的酚类物质,并被证明是酚类抗氧化剂的有效来源[9-10]。菱角壳是菱角加工进程中的主要副产物,约占菱角总量的25%[11-12]。各种研究发现,菱角壳提取物具有降血糖[13-14]、保护肝脏细胞[15-16]、抗癌[17]等作用,这都归因于菱角壳中含有生物碱、酚酸类、萜类和甾体、多糖类、黄酮类以及苯丙素类等活性物质[18-19]。有研究人员[9]从菱角壳中提取了抑菌活性物质,发现其中主要发挥抑菌作用的成分为没食子酸以及阿魏酸,并且对革兰氏阳性菌有良好的抑制效果,然而,对菱角壳提取物的抑菌稳定性以及成分鉴定方面的研究较少。同样作为菱角加工过程中的副产物,菱角梗中的多糖被证明具有良好的抗氧化活性[20]。但菱角梗引发科学界关注的最神奇之处在于,其可以在炎炎夏日保持多日不腐,而菱角梗提取物的抑菌活性及成分分析情况鲜有报道。
目前对于菱角加工生产过程中产生的大量副产物——菱角梗和菱角壳,只有极少一部分用作中药材,大部分仍然是作为垃圾丢弃,这造成了极大的资源浪费。本实验选择菱角梗和菱角壳为材料制备天然抑菌剂,全面系统地研究这些抑菌物质的抑菌活性以及成分,为其作为抑菌剂在各种食品保鲜中的实际应用提供参考。
1 材料与方法
1.1 材料与仪器
菱角梗和菱角壳 选材于湖北省洪湖市的二角菱;供试微生物金黄色葡萄球菌(AB 99002)、蜡样芽孢杆菌(AB 2011085)、枯草芽孢杆菌(AB 90008)、大肠杆菌(AB 208270)、铜绿假单胞菌(AB 93066)、酿酒酵母(AY 92003) 由中国典型培养物保藏中心提供;培养基:马铃薯葡萄糖琼脂培养基、营养肉汤培养基 北京路桥技术有限公司;所用试剂 均为分析纯。
SPX-250B型生化培养箱 天津市泰斯特仪器有限公司;SB-5200DNT超声波清洗仪 宁波新芝生物科技股份有限公司;UV-1800紫外-可见分光光度计 日本岛津有限公司;ME104电子天平 梅特勒-托多利仪器上海有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司;RE52型旋转蒸发仪 上海亚荣生化仪器厂;安捷伦1260高效液相色谱仪 安捷伦科技有限公司;Q-Exactive超高效液相色谱质谱仪 赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1 乙醇提取液的制备 新鲜菱角梗、菱角壳经洗净整理后,在日光下晒干,切分成1 cm长度,粉碎后,用60目筛进行处理,得到的粉末低温冷藏备用。
称取一定量的菱角梗、菱角壳粉末,料液比1∶30 (g∶mL),提取剂95%乙醇溶液,水浴温度50 ℃,在功率500 W、振动频率40 kHz条件下超声波辅助提取20 min,采用布氏漏斗抽滤,得滤液[21-22]。将上述步骤重复2~3次,把滤液合并后即可得到乙醇提取液。
1.2.2 各溶剂萃取物的制备 将1.2.1中获得的提取液,在温度45 ℃的条件下,使用真空旋转蒸发仪回收全部提取剂,得到乙醇提取物粉末。乙醇提取物粉末用10倍量蒸馏水悬浮,依次用等体积的有机试剂石油醚、乙酸乙酯、正丁醇[23]萃取,各萃取液在温度45 ℃的条件下,使用真空旋转蒸发仪回收全部萃取剂,得到各萃取部分粉末。
1.2.3 菌种活化 待测细菌于营养肉汤培养基中37 ℃下培养24 h,使用前在相同培养条件下的试管斜面上活化培养24 h,待测真菌于马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)上于28 ℃下培养48 h,使用前在相同培养条件下在试管斜面上活化培养48 h,抑菌实验前制备菌悬液浓度为106~107CFU/mL。
1.2.4 抑菌活性检测 抑菌实验采用滤纸片扩散法[24-26]。样品利用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,采用二倍稀释法配制系列质量浓度(mg/mL)的待测样品液。准确吸取100 μL菌悬液均匀涂布于平皿培养基上,在培养基上等间距平铺4片已灭菌直径为6 mm的滤纸片,其中3片滴加10 μL经0.22 μm无菌滤头处理的样品液,根据实验目的不同,设置空白对照时,另1片滴加等量的DMSO;设置阳性对照时,另一片滴加阳性对照液,阳性对照液为10.0 μg/mL的氨苄青霉素(Ampicillin)或1.0 mg/mL的两性霉素B(Amphotericin B)。细菌于37 ℃下培养24 h,真菌于28 ℃下培养48 h,采用十字交叉法量取抑菌圈直径(包括滤纸片直径)。观察菌落生长情况,存在抑菌圈的最低样品液浓度即为最小抑菌浓度(minimum antimicrobial concentration,MIC)(mg/mL)。菱角梗、菱角壳乙醇提取物的抑菌活性测定过程中,设置阳性对照;菱角梗、菱角壳各溶剂萃取物的抑菌活性测定过程中,设置空白对照和阳性对照。
1.2.5 乙酸乙酯萃取物抑菌稳定性检测 取三种典型腐败微生物大肠杆菌、金黄色葡萄球菌、酿酒酵母菌作为供试菌种,考察温度、pH、紫外光处理对乙酸乙酯萃取物抑菌稳定性的影响,各处理如下:将浓度为50 mg/mL的萃取物溶液,分别在20、40、60、80、100 ℃水浴温度下处理30 min,检测抑菌活性;利用0.1 mol/L的NaOH和0.1 mol/L的HCl溶液调节pH,得到pH分别至5、6、7、8、9浓度为50 mg/mL的萃取物溶液,检测抑菌活性;使浓度为50 mg/mL的萃取物溶液在30 W的紫外灯下分别照射10、20、30、40 min,检测抑菌活性。
1.2.6 乙酸乙酯萃取物的纯化 根据抑菌实验结果,选择活性最强的乙酸乙酯萃取物,采用HP-20大孔树脂[27]进行初步纯化,上样质量为10 g,柱体积为590 mL(47 cm×4 cm),采用体积分数0~100%的甲醇溶液进行洗脱,得到各洗脱组分。将检测得到的洗脱活性组分再上Sephadex LH-20凝胶柱(85 cm×1 cm),依次用不同浓度的甲醇液(体积分数0~100%)洗脱,得到进一步的纯化品,用于后期的结构鉴定分析。
1.2.7 超高效液质联用法和高效液相色谱法条件 超高效液质联用法(ultra-performance liquid chromatography-tandem mass spectrometry,UPLC-MS)条件:色谱柱Agilent ZORBAX SB-C18(2.1 mm×100 mm,1.8 μm);流动相:A,水;B,甲醇;洗脱程序:0~15 min,0~100% B;15~20 min,100% B;20~25 min,100%~0B;流速300 μL/min,进样量1.0 μL,柱温40 ℃。质谱条件:电喷雾电离(ESI),检测离子为负离子;分辨率70000,扫描范围m/z 140~2000;鞘气、辅助气流速分别为35、15 L/min,电离电压-3.2 kV,离子参数管温度320 ℃,离子源温度200 ℃,数据扫描模式Full MS-ddMS2。
高效液相色谱法(high performance liquid chromatography,HPLC)条件参考文献方法[28-29]:色谱柱,Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm);流动相:A,乙腈;B,0.1%甲酸水;洗脱程序:0~3 min,2% A;3~30 min,2%~30% A;30~35 min,30%~70% A;35~39 min,70% A;39~41 min,70%~2% A;41~45 min,2% A。流速0.8 mL/min,进样量10 μL,柱温40 ℃。
1.2.8 UPLC-MS和HPLC分析 菱角梗、菱角壳的乙酸乙酯萃取物经UPLC-MS检测,通过人工谱图解析及文献对比,确定了样品中的各种化学物质,最后利用HPLC法,通过标准品对已知物质进行定量检测。
1.3 数据处理
所有实验至少重复三次,数据结果取平均值,采用Origin 8.0进行单因素方差分析与图表制作。
2 结果与分析
2.1 菱角梗、菱角壳乙醇提取物的抑菌活性分析
菱角梗、菱角壳乙醇提取物在浓度为50 mg/mL时对几种典型腐败微生物的生长有明显的影响,结果见表1。
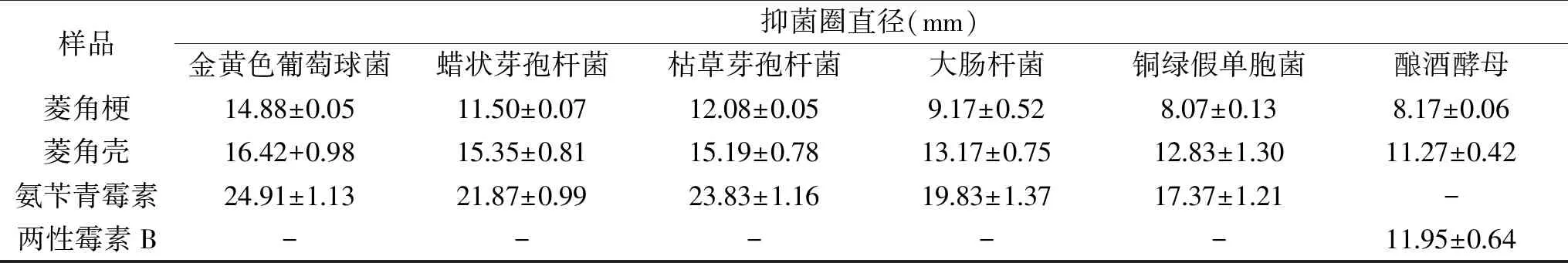
表1 菱角梗、菱角壳乙醇提取物的抑菌活性Table 1 Antibacterial activity of water chestnut stem and water chestnut pericarp ethanol extract
由表1可知,菱角壳乙醇提取物的抑菌活性强于菱角梗乙醇提取物,且两者均表现出一定的抑菌规律:对革兰氏阳性菌抑菌能力>对革兰氏阴性菌抑菌能力>对真菌抑菌能力。
2.2 菱角梗、菱角壳各溶剂萃取物的抑菌活性分析
菱角梗、菱角壳中各极性萃取物对四种典型腐败菌(金黄色葡萄球菌、蜡样芽孢杆菌、大肠杆菌、酿酒酵母菌)的抑菌活性结果见图1和图2。由图1和图2可知,在同一浓度下(50 mg/mL),菱角梗和菱角壳各极性萃取物对四种典型腐败菌的抑菌作用趋势一致,菱角梗各极性萃取物对腐败菌抑菌能力由强到弱为(除大肠杆菌):乙酸乙酯萃取物>正丁醇萃取物或石油醚萃取物>水萃取物,菱角壳各极性萃取物对腐败菌抑菌能力由强到弱为:乙酸乙酯萃取物>正丁醇萃取物>石油醚萃取物>水萃取物。可得出结论:发挥主要抑菌能力的活性成分主要集中在中等极性的乙酸乙酯萃取物中,因此,在后续分析及分离鉴定实验中,重点分析菱角梗的乙酸乙酯萃取物(ethyl acetate extract of water chestnut stem,EAS)和菱角壳的乙酸乙酯萃取物(ethyl acetate extract of water chestnut pericarp,EAP)。
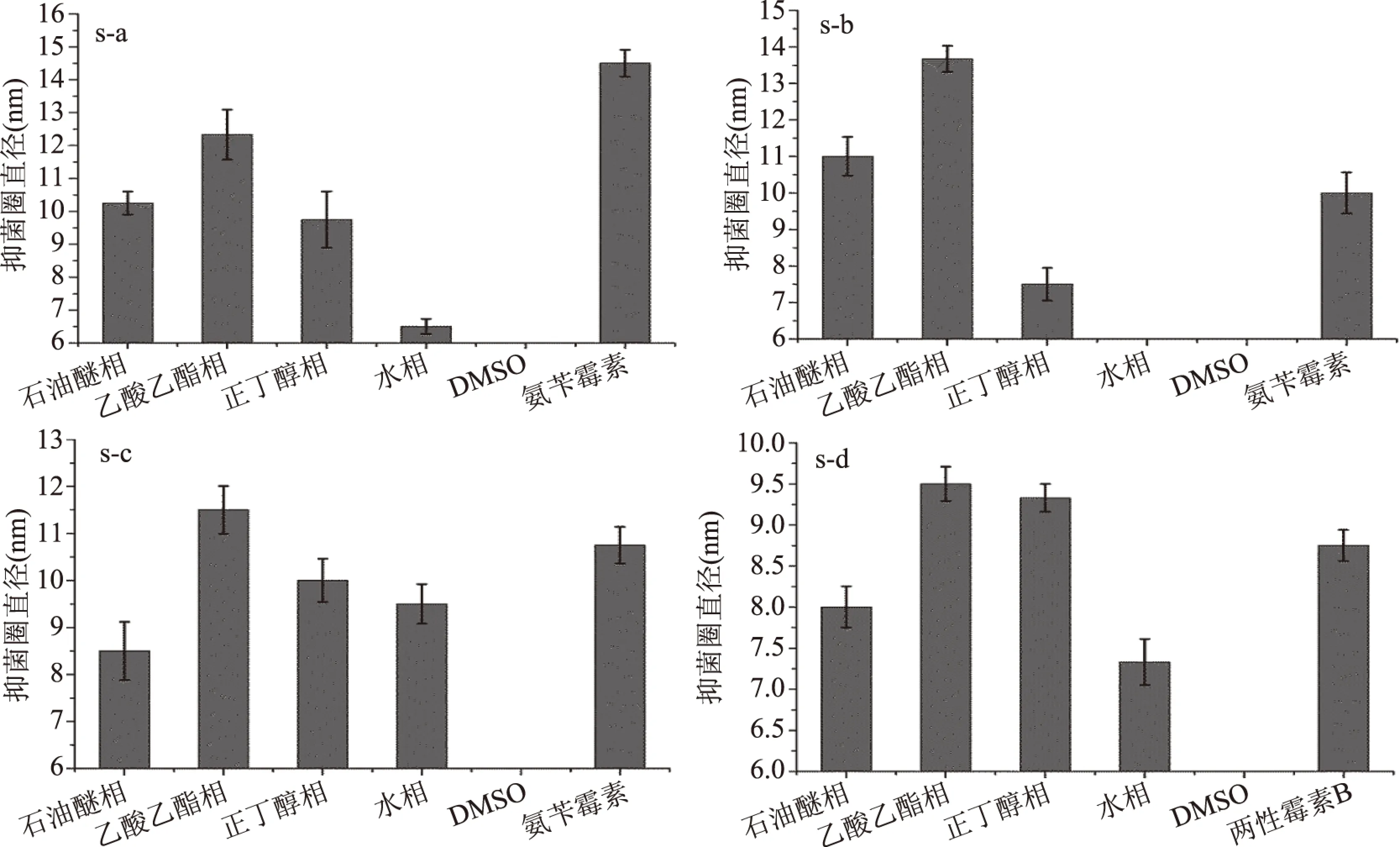
图1 菱角梗各溶剂萃取物的抑菌活性Fig.1 Antibacterial activity of solvent extracts from water chestnut stem注:s-a:金黄色葡萄球菌;s-b:蜡样芽孢杆菌;s-c:大肠杆菌;s-d:酿酒酵母菌。
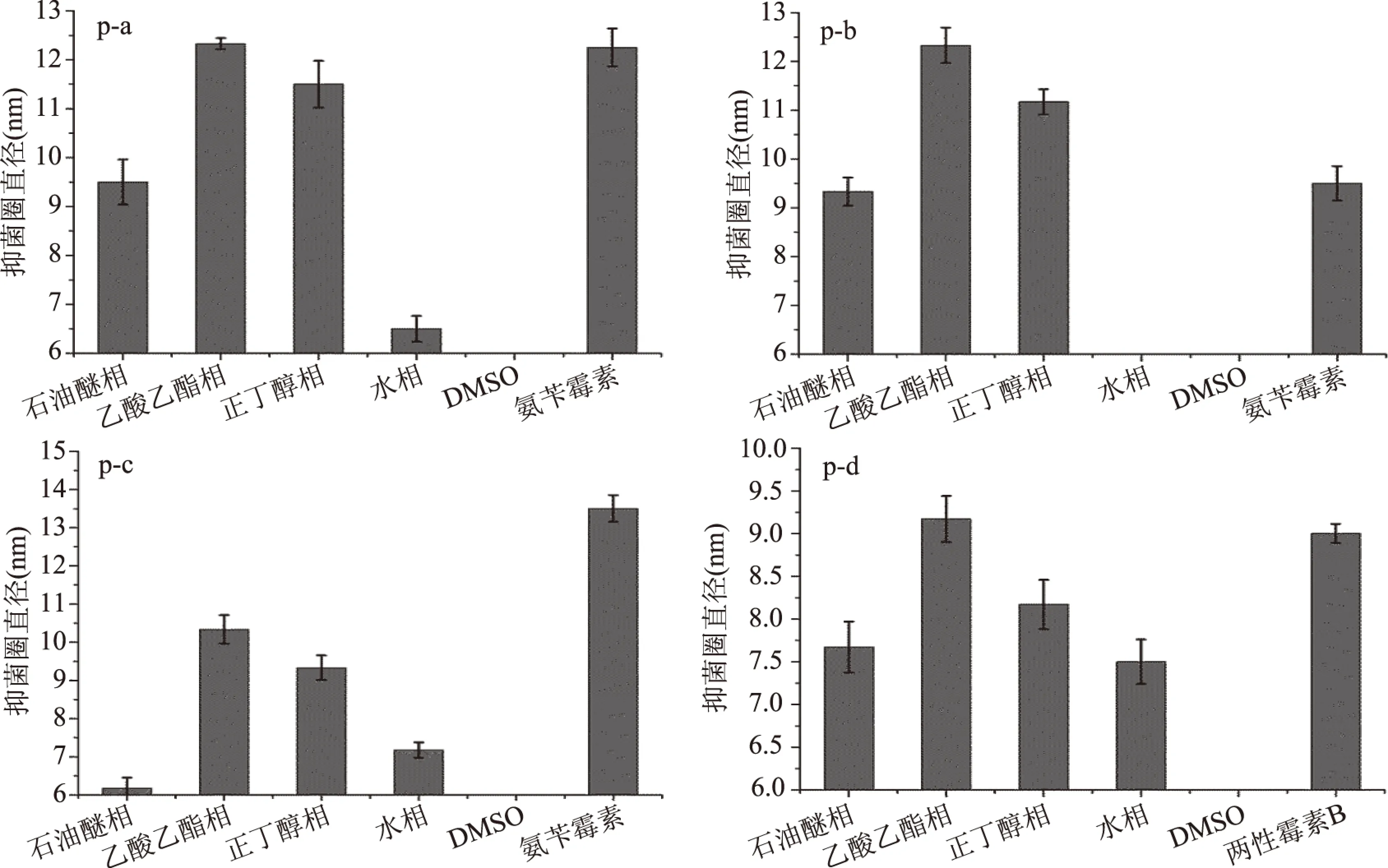
图2 菱角壳各溶剂萃取物的抑菌活性Fig.2 Antibacterial activity of solvent extracts from water chestnut pericarp注:p-a:金黄色葡萄球菌;p-b:蜡样芽孢杆菌;p-c:大肠杆菌;p-d:酿酒酵母菌。
2.3 EAS、EAP的最小抑菌浓度
对EAS、EAP的最小抑菌浓度进行测定,结果如表2。EAS、EAP对3种供试菌的抑菌能力由大到小分别为:金黄色葡萄球菌≥大肠杆菌>酿酒酵母菌,该结果与前述抑菌活性筛选的结果一致,表明EAS、EAP对革兰氏阳性菌的抑菌作用优于革兰氏阴性菌,对真菌的抑制作用最不明显。另外,从结果也可看出,EAP的MIC值明显低于EAS的,说明整体来看,EAP的抑菌能力强于EAS。
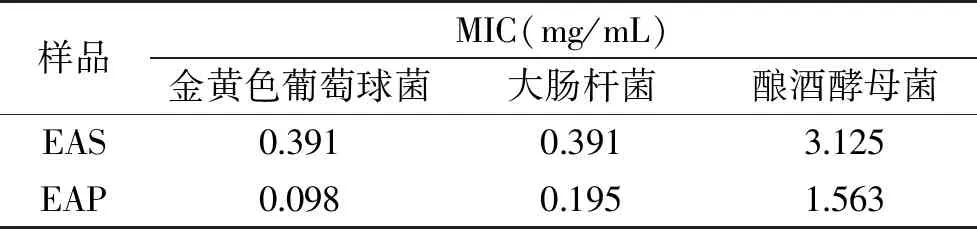
表2 EAS、EAP的最小抑菌浓度Table 2 Minimum antibacterial concentration of ethyl acetate extract from water chestnut stem and water chestnut pericarp
2.4 EAS、EAP的抑菌稳定性分析
将EAS、EAP进行不同温度、不同pH和不同时间的紫外照射处理,对其抑菌稳定性进行分析。由图3(A)可知,在不同温度处理后,EAS对三种微生物抑菌能力未出现明显变化,均表现较好的热稳定性。由图3(B)可知,经过不同pH调节处理,EAS对大肠杆菌的抑菌性能波动较大,具体表现为碱性条件下,抑菌性能明显下降;而对金黄色葡萄球菌和酿酒酵母菌而言,抑菌作用较稳定。因此,酸性环境下更有利于EAS抑菌活力的发挥。由图3(C)可知,经过不同时间紫外线照射处理后发现,紫外线照射时间30 min可明显促进EAS对大肠杆菌的抑菌作用;当照射时间20 min,EAS对金黄色葡萄球菌的抑菌能力最强;而紫外线照射处理对酿酒酵母的抑菌作用几乎没有影响。总体来说,EAS在使用过程中暴露在紫外线下的时间不宜超过30 min。
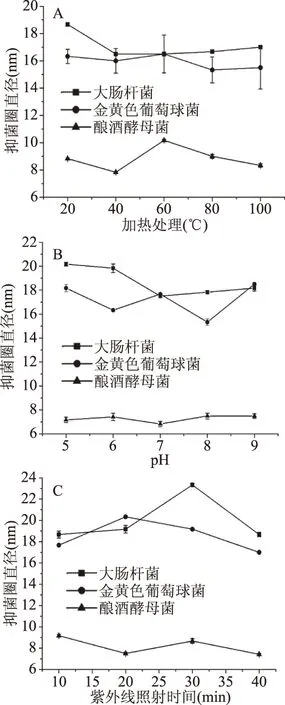
图3 各处理条件对EAS抑菌稳定性的影响Fig.3 Effects of various treatment conditions on antibacterial stability of ethyl acetate extract of water chestnut stem
由图4(A)可知,加热处理对EAP抑菌能力的影响,呈现先增强后减弱的趋势,60 ℃下处理30 min时对金黄色葡萄球菌和大肠杆菌的抑菌能力达到峰值,温度高于60 ℃抑菌能力明显降低;加热处理对酿酒酵母的抑菌活性几乎无影响,与菱角梗的结果类似。由图4(B)可知,pH高于5时,EAP对金黄色葡萄球菌的抑菌活性出现较明显的下降,之后随着pH的升高,保持较好的抑菌稳定性,而对大肠杆菌和酿酒酵母菌的抑菌能力无明显变化,较EAS而言,EAP表现出更好的酸碱稳定性。由图4(C)可知,不同时间的紫外线照射处理时,EAP对金黄色葡萄球菌抑菌活性有略微的影响,当照射时间超过20 min后,对大肠杆菌和酿酒酵母菌的抑菌活性有略微下降。但总体而言紫外线照射对EAP的抑菌活性影响不大。
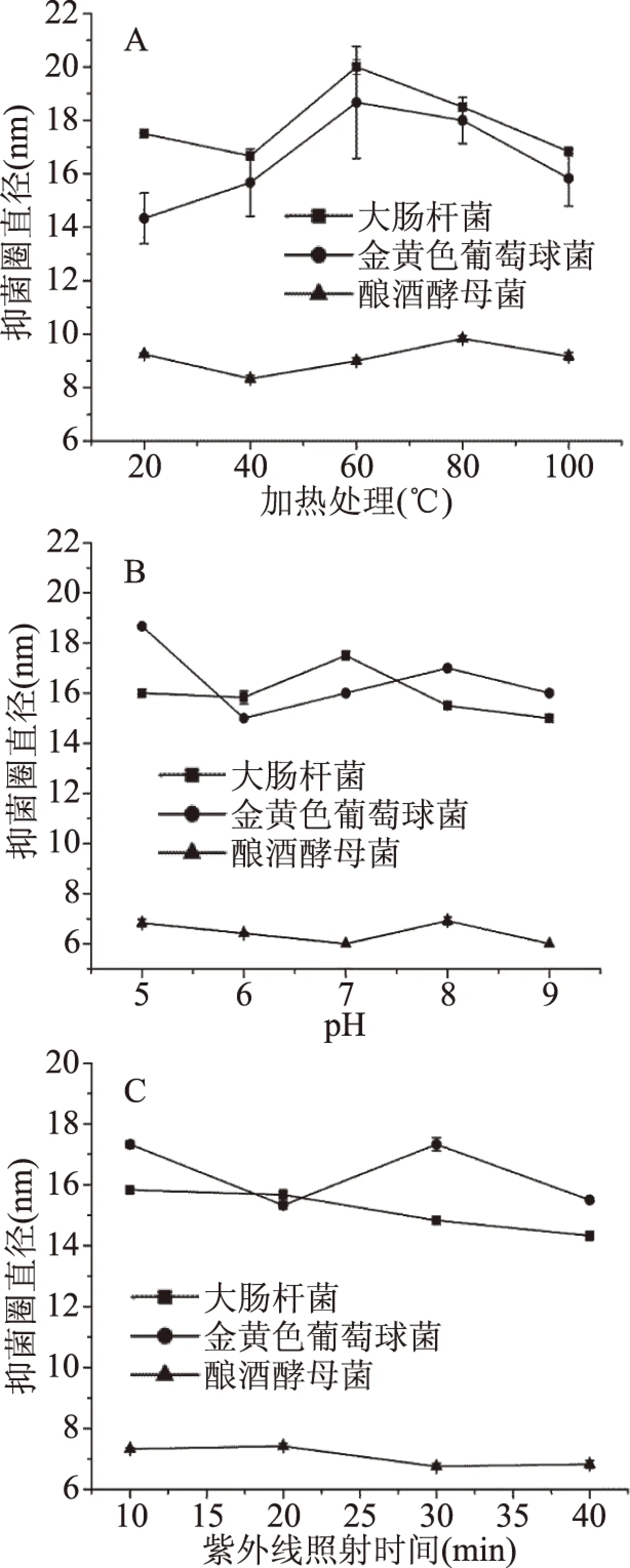
图4 各处理条件对EAP抑菌稳定性的影响Fig.4 Effects of various treatment conditions on antibacterial stability of ethyl acetate extract of water chestnut pericarp
2.5 菱角梗、菱角壳抑菌成分化学结构鉴定
从EAS中鉴定出10种化合物(见表3),在高效液相色谱图(见图5A)中的峰归属编号为1~10号,其中化合物1~4、6~10为没食子酸及其衍生物,化合物5为黄酮类化合物。EAS中没食子酸最为丰富,含量27.22%,其次为1,2,6-三-O-没食子酰-β-D-葡萄糖,含量18.65%。有学者在研究中发现,没食子酸会以剂量依赖性方式引起细菌内膜严重收缩和不规则形态,从而表现出抑菌作用[30],这可能就是菱角梗抑菌成分可以达到抑菌效果的原因。
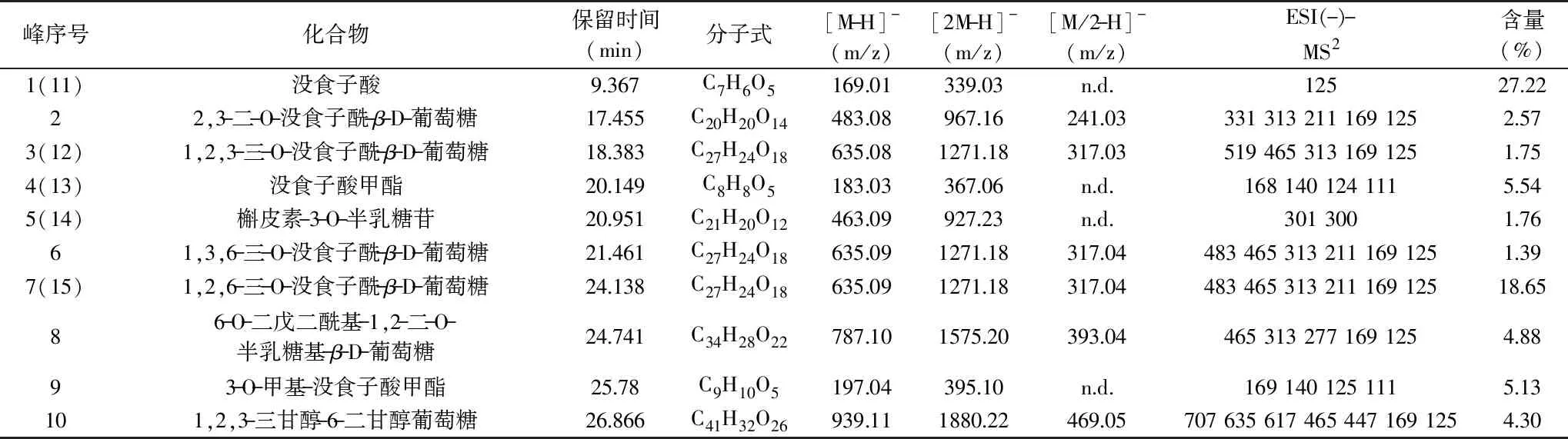
表3 EAS的UPLC-MS和UPLC鉴定结果Table 3 UPLC-MS and UPLC identification results of ethyl acetate extract of water chestnut stem
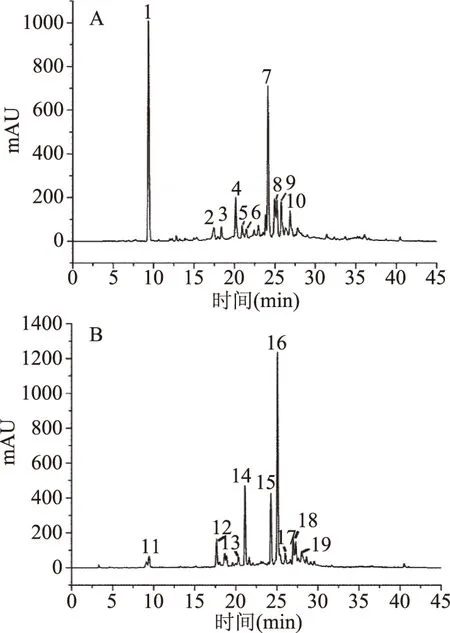
图5 EAS、EAP中抑菌成分的高效液相色谱图Fig.5 High performance liquid chromatograms of antibacterial components in EAS and EAP 注:A:EAS中抑菌成分的高效液相色谱图; B:EAP中抑菌成分的高效液相色谱图。
从EAP中鉴定出9种化合物(见表4),在高效液相色谱图(见图5B)中的峰归属编号为11~19,其中化合物11~15与EAS的化合物1、3、4、5、7分别重叠,化合物14、19为类黄酮类化合物,其余为没食子酸及其衍生物。EAP中含量最为丰富的为1,2,3,6-四-O-没食子酰-β-D-葡萄糖,含量33.93%,其次为槲皮素-3-O-半乳糖苷和1,2,6-三-O-没食子酰-β-D-葡萄糖,含量分别12.23%、11.68%。
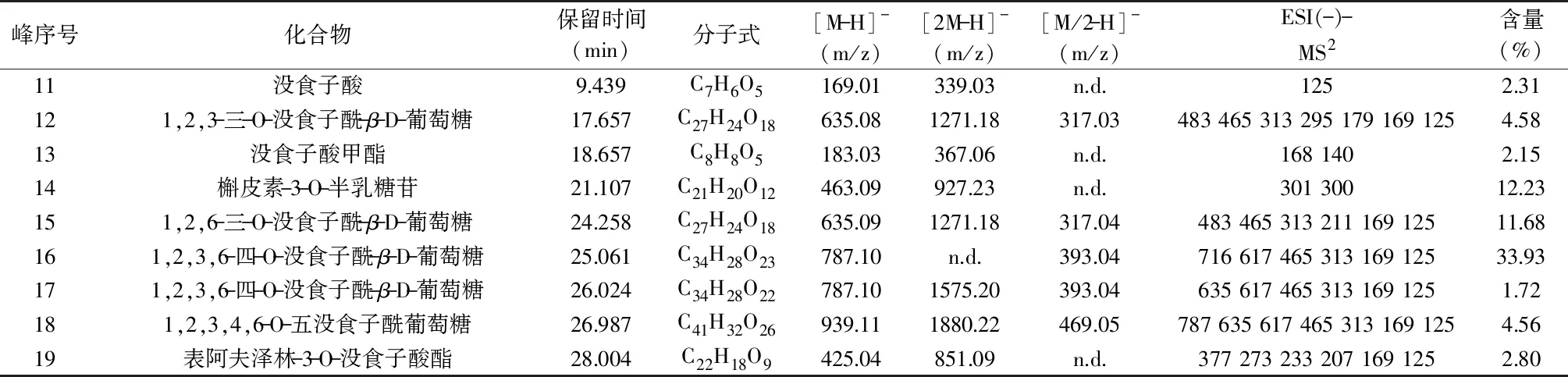
表4 EAP的UPLC-MS和UPLC鉴定结果Table 4 UPLC-MS and UPLC identification results of ethyl acetate extract of water chestnut pericarp
3 结论
EAS和EAP都具有较强的抑菌能力,它们均对革兰氏阳性菌的抑菌作用优于革兰氏阴性菌,对真菌的抑菌作用最弱。通过比较EAS和EAP的MIC值,EAP的抑菌能力优于EAS。在抑菌稳定性研究中发现,对于EAS而言,其具有良好的热稳定性,在酸性条件下抑菌活性较强,紫外线中暴露时间不宜超过30 min;对于EAP而言,避免温度高于60 ℃,酸碱稳定性较好,紫外线照射对抑菌能力的影响较小。利用UPLC-MS和HPLC,从EAS中鉴定出10种化合物,主要为没食子酸及其衍生物,其中没食子酸含量27.22%,1,2,6-三-O-没食子酰-β-D-葡萄糖含量18.65%;从EAP中鉴定出9种化合物,其中最为丰富的为一种没食子酸衍生物——1,2,3,6-四-O-没食子酰-β-D-葡萄糖,含量33.93%。本研究为EAS和EAP在食品保鲜加工中作为抑菌剂的利用提供了理论支持,具有实际应用的意义。

