脑白质高信号与上下肢运动功能障碍的相关性研究
侯雨桐 杨淑娜 李 悦 李譞婷 胡文立
(首都医科大学附属北京朝阳医院神经内科,北京 100020)
脑白质高信号(white matter hyperintensities, WMH)是脑小血管病(cerebral small vessel disease, cSVD)的重要影像学特征之一。既往研究[1]证实,WMH能够导致运动功能障碍、认知水平下降、情感障碍以及尿便障碍等。随着人口老龄化的日益加重,运动功能障碍成为导致老年人生活质量下降的重要原因之一。既往研究[2]表明,步态障碍是造成老年人口跌倒、自主生活能力下降甚至死亡的首要因素,严重增加了家庭以及社会的负担。在步态障碍的危险因素分析中发现其与严重的WMH有关,但目前结论还不统一[3-5]。鉴于WMH在老年人口中的高发病率以及其危害的严重性,探究WMH与运动障碍的关系,并且通过控制其危险因素并及早进行功能锻炼,从而延缓老年人口的运动功能下降尤为重要。
目前对于步态障碍采用的研究工具各不相同。定量研究的方法,对受试者的步速、步宽等指标进行测量,随着WMH严重程度的加重,会导致受试者步长变短、步宽变宽、步速降低以及单脚站立时间变短等[4]。还有一些研究[3, 6-7]应用Tinetti平衡与步态量表、起立行走计时测试(Timed Up and Go,TUG)、简易体能测试量表(Short Physical Performance Battery, SPPB)等半定量量表对下肢功能进行评价,显示严重WMH会导致受试者在测试中的表现不佳,但结论不统一且采用的方法也各不相同。目前大多数研究[3-4,6-7]都集中在下肢功能障碍,对于上肢的研究还很欠缺。
本研究通过定量及半定量工具对受试者下肢运动功能进行评估,首先探究WMH对下肢运动功能的影响,其次希望提供更多的下肢测量工具有效性的数据。此外,本研究应用帕金森病评定量表(Unified Parkinson’s Disease Rating Scale, UPDRS)中对上肢评定的方法对脑白质高信号受试者上肢功能进行评估,探究其与WMH的关系,以及其在脑小血管病中的应用价值。
1 对象与方法
1.1 研究对象
本研究连续入组2019年3月至2019年12月于首都医科大学附属北京朝阳医院神经内科入院进行查体的受试者。受试者均同意参与本研究,并签署知情同意书,同意使用其数据进行研究。本研究的设计由首都医科大学附属北京朝阳医院伦理委员会批准,按照赫尔辛基宣言进行。入组标准:年龄45~80岁;能够配合完成头部磁共振成像(magnetic resonance imaging, MRI)检查。排除标准:痴呆、帕金森病和帕金森综合征、脑积水、新发脑梗死、脑出血、颅内占位性病变、非小动脉闭塞型卒中病史、精神疾病、视力听力问题以及语言障碍、腿或关节疾病、预期寿命<6个月、近期使用影响运动功能的药物等。
1.2 临床信息采集
收集并记录所有入组受试者的姓名、性别、年龄、既往病史(包括:高血压、糖尿病、高脂血症)和吸烟饮酒史。收集所有受试者入院第二天清晨空腹静脉血进行化验。记录检查结果。
1.3 颅脑磁共振检查和分组
全部受试者在3T磁共振成像扫描仪(德国Siemens公司)行脑结构检查。推测为血管源性的WMH定义为T2WI及FLAIR序列上高信号,无空洞形成(信号不同于脑脊液)。根据Fazekas量表对WMH负担进行评分。Fazekas评分是脑室旁WMH和深部WMH的总和,范围是0~6分。脑室旁WMH评分为① 0分:无病变;② 1分:帽状或者铅笔样薄层病变;③ 2分:病变呈光滑的晕状;④ 3分:不规则的脑室旁WMH,延伸到深部白质。深部白质WMH评分为① 0分:无病变;② 1分:点状病变;③ 2 分:病变开始融合;④ 3分:病变大面积融合。所有受试者根据Fazekas总分分为两组:评分为0~2分的为WMH低负担组;3~6分的为WMH中-高负担组。
1.4 运动功能测量
1.4.1 下肢运动功能数据测量
受试者穿适合的平底鞋在6米步行走道上以正常速度走3次,分别记录步长、步宽、步频并计算步速;受试者独立完成起立-行走计时测试 3次,记录相应时间并对完成度进行打分,3次取平均值;完成Tinetti平衡与步态量表(performance oriented mobility assessment, POMA)以及SPPB量表内容,并记录得分。
1.4.2 上肢运动数据测量
应用共济失调等级量表(Scale for the Assessment and Rating of Ataxia,SARA)以及统一UPDRS中的双手手指捏合、双手轮替、手运动的评价标准对其完成情况进行打分并且记录完成10次所需要的时间,上述操作进行3次,取平均值。
1.5 统计学方法
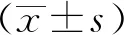
2 结果
2.1 人口学及临床资料
本研究共对295名受试者进行了运动功能测评,39名被排除(15名MRI影像不清晰,24名不能完成运动功能测试),最终256名受试者纳入了本次研究。受试者平均年龄(61.6±10.1)岁,男性152名 (59.3%)。WMH低负担组受试者172例 (67.2%),平均年龄(58.9±9.6)岁,其中男性受试者110例 (64.0%);WMH中-高负担组受试者84例 (32.8%),平均年龄(64.2±8.2)岁,其中男性受试者42例 (50.0%)。WMH中-高负担组年龄大于低负担组(P<0.05),受试者其他临床特征以及实验室检查结果详见表1,两组其他资料间差异无统计学意义(P>0.05)。

表1 不同WMH严重程度分组的临床和实验室检查特征
2.2 WMH与下肢运动功能的关系
与WMH低负担组相比,WMH中-高负担组受试者步长更短、步数更多、步宽更宽,相应的步速也更慢,均P<0.01。Tinetti以及SPPB测试中,WMH中-高负担组得分更低,完成TUG测试所需时间更长,表现也更差(表2)。多因素线性回归分析发现校正性别、年龄、身高、脑血管病危险因素以及腔隙性脑梗死和其他cSVD分型后,步宽和步频与WMH严重程度呈正相关(β=1.174,0.533,均P<0.05),步速以及步长与WMH严重程度无关(表3)。
2.3 WMH与上肢运动功能的关系
WMH中-高负担组患者完成10次双手轮替、10次双手捏合以及10次手运动所需时间更长,与WMH低负担组相比差异有统计学意义(表2)。在多因素回归分析校正危险因素以及腔隙性脑梗死等其他可能影响手运动功能的因素后,发现WMH中-高负担组与10次双手轮替、10次双手手指捏合以及10次手运动所需时间均呈正相关(β=0.635,0.962,0.518,均P<0.05),详见表3。
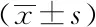
表2 不同WMH严重程度分组间的运动功能差异

表3 上肢、下肢运动功能和脑白质负担的多因素线性回归分析
3 讨论
本研究探究了WMH负担对上、下肢运动功能的影响。结果显示WMH的严重程度与步宽及步频呈正相关,与步速和步长无关。中-高负担组在Tinetti以及SPPB测试中得分明显更低,在TUG试验中的用时更长且表现更差。在上肢运动功能评估方面发现中-高度WMH会导致手部运动功能减退,表现为手活动的不灵活。在校正了血管危险因素以及腔隙性脑梗死等可能影响运动功能的因素后,结果未发生改变。
目前的研究主要集中在WMH与下肢运动关系方面。LADIS研究[8]纳入639名年龄在65到84岁的老年人,对其进行步速、单脚站立时间测量并且应用SPPB试验对其步态和平衡功能进行评价,结果显示,随着WMH严重程度的加重,受试者步速逐渐下降、单脚站立时间变短,在SPPB测试中重度WMH患者在平衡和步态方面均表现较差。利用5.6米步行走道测量受试者步态数据,结果显示WMH与步长、步宽以及步速存在相关性,但是与步频无关[5]。另一项研究[4]显示,WMH与步长和步宽相关性更大,与步速和步频相关性不大。以上研究显示WMH与步宽相关,这与本研究结果一致。不同之处在于本研究发现虽然中-重度WMH受试者的步速更慢,但是在校正危险因素后与WMH无关。既往研究[2]显示,步速下降其实是步宽变宽以及步长变短的表现形式,步长和步宽也可以反映步速的情况,并且相对于步速更直接和精准。应用弥散张量成像技术对WMH的不同部位和传导束进行了评估,发现特定部位的WMH(胼胝体、内囊、上纵束等)与步速的减慢相关,而其他脑区的病变则没有对步速造成影响[9]。本研究未发现与步速的关系可能因为选取的受试者WMH损伤部位不同。本研究发现步频与WMH密切相关,既往在这方面的研究较少且结论也不统一。既往对于步频的测量方式存在差异,可能是造成结论不一的原因。
除了应用步行走道对受试者下肢功能进行定量研究,既往还应用了半定量的测量方法。LADIS研究显示严重WMH与TUG表现不佳有关。法国的3C研究显示脑室旁WMH与Tinetti得分降低、平衡步态障碍有关,但是RUN DMC研究则显示在校正危险因素后WMH与Tinetti及TUG测试均无关,但是与步速、步长相关[3-4, 6]。本研究结果提示TUG、Tinetti以及SPPB量表评价下肢功能与WMH相关,却没有发现步速与WMH的关系,笔者推测量表由于在测量中添加了像站立、串联站立、转弯、坐下等活动,相对于直线行走提供了更多灵活性以及平衡功能的信息,能够更好地反映出微小的下肢运动功能变化,且本研究受试者普遍活动较好,在普通的速度测量上大多无异常,而在更加复杂细微的测量中则能够更好地反映出运动功能的障碍。不仅如此,既往研究[10]已经证明TUG以及Tinetti测试在评估老年人跌倒风险上有良好的可信度与灵敏度,可以很好地反映老年人口下肢运动功能的损伤,且可以作为锻炼的方法,所以选择这两个量表应用于cSVD患者也有很好的适用性。对于SPPB量表目前应用还较少,需要进一步的应用研究。综合以上笔者发现无论应用定量还是半定量测量方式评价下肢运动功能,均可以反映出WMH对下肢的影响,联合使用更易于准确地发现问题。
相对于下肢功能,上肢功能更加复杂与精细,更能预示人的衰老、疾病与死亡[11],但此方面的研究很少。国内的顺义研究[6]显示,重度WMH及脑萎缩会造成手指轮替时间明显延长,与本研究结果一致,并未发现WMH与手指捏合时间的关系。而本研究发现WMH中-高负担组手指捏合及手运动时间均会延长,这说明WMH不仅仅损伤手指的灵活性,对于前臂功能也有损伤。目前研究结果不统一的原因可能因为对于手指捏合以及双手轮替完成次数的测量过少,对于年龄较轻的患者不能反映出手部功能的微小变化,造成结果的误差,适当增加测量次数以及测量内容可能会有所帮助。
在WMH导致运动功能障碍的机制方面,研究结果各不相同。目前认为WMH导致脑结构破坏是造成运动功能障碍的重要原因[5]。既往研究显示与皮质脊髓束受损有关,该传导束调控下肢运动功能,脑室旁区域的白质正好对应了该传导束经过的区域,故而受损会造成功能障碍[12]。Linortner等[13]的研究则显示额叶下环路受损会导致下肢运动功能的障碍。其他研究[14]还显示额叶、顶叶结构破坏造成的丘脑前辐射、上纵束、扣带、下额枕束和胼胝体在内的额顶叶的微结构变化是造成步态障碍的原因。上肢相对于下肢对运动功能的控制需要更多的传导束。完成精细的活动需要视觉、运动以及感觉的联合作用[11]。而胼胝体区联系了额、顶、枕部的皮质,是运动控制的重要通路。WMH会造成胼胝体压部的视空间信息整合区受损,该区域对老年人手部运动功能调控起到很重要的作用,这可能与老年人上肢功能受损有关[15]。
本研究创新性地应用了定量以及半定量指标测量上、下肢运动功能,探讨其与WMH负担的相关性。本研究也存在不足,首先需要扩大样本量,并且对受试者进行纵向随访研究以探究WMH对运动功能的长期影响;第二,需要更精准的工具测量运动功能;最后,需要用影像学设备对WMH的不同分区及范围进行测量,以更好地探究其发病机制。
综上所述,本研究发现无论应用定量指标还是半定量工具对下肢运动功能评价,WMH会导致下肢功能障碍,造成行走缓慢、步宽变宽。此外,严重的WMH也会导致受试者上肢运动功能的障碍,导致手部灵活性下降。运动数据的测量,脑部结构的分析随着技术的发展,实现早期诊断,早期预防的目标。

