来曲唑联合高糖高脂饮食构建多囊卵巢综合征伴胰岛素抵抗大鼠模型研究
王景尚 尹晓丹 何军琴 武 颖 张 莹 李宪锐
(首都医科大学附属北京妇产医院中医科,北京 100026)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是青春期和育龄期妇女最常见的一种复杂的内分泌紊乱综合征,是导致女性不孕症发生的主要病因之一[1]。我国PCOS患者人群庞大,据统计在育龄期女性中的发病率高达5%~10%[2]。PCOS不仅影响女性的生殖功能,而且会使患者2型糖尿病、代谢综合征及心脑血管疾病等远期并发症的发病风险显著高于一般人群,并可持续到绝经后,其机制被认为与PCOS患者的胰岛素抵抗(insulin resistance, IR)状态有关[3-4]。临床流行病学研究[5]显示,PCOS患者伴有IR(polycystic ovary syndrome with insulin resistanc,PCOS-IR)的比例高达50%~70%,同时具有高发性、异质性、终身性、难治性等特点,严重影响女性身心健康,成为临床和基础研究的热点和难点。建立可靠、简便、符合临床特征的PCOS-IR动物模型对于推动该病的深入研究具有重要意义。本课题组前期通过高糖高脂饮食喂养的方法成功构建了IR及糖代谢异常大鼠模型,并经过反复验证[6]。本研究在此基础上,应用高糖高脂饮食和来曲唑灌胃的方法诱导构建PCOS-IR大鼠模型,分析其内分泌、胰岛素抵抗和卵巢病理改变特征,旨在建立一种有效的、更加符合人体生理病理特征的PCOS-IR动物模型。
1 材料与方法
1.1 实验动物
6周龄SPF级雌性SD大鼠20只,体质量160~180 g,购自北京大学实验动物中心,实验动物许可证号:SCXK(京)2016-0010。饲养条件为2级,室温保持在(22±2)℃,相对湿度(55±5)%,光照时间7:00~19:00。
1.2 动物饲料、药物及试剂
动物饲料购自购自北京科澳协力饲料有限公司,其中高脂饲料含猪油20%、蔗糖10%、胆固醇1.25%、胆酸盐0.25%,普通饲料68.5%;来曲唑购自大连美仑生物技术有限公司;罗氏活力型血糖仪试纸购自德国罗氏诊断有限公司;血清促卵泡生成素(follicle stimulating hormone, FSH;批号:CSB-E06869r)、促黄体生成素(luteinizing hormone,LH;批号:CSB- E12654r)、睾酮(testosteron,T;批号:CSB-E05100r)及空腹胰岛素(fasting insulin,FINS;批号:CSB-E05070r)、ELISA试剂盒均购自武汉华美生物工程有限公司。
1.3 模型构建
大鼠普通饲料适应性喂养1周后,随机数字表法选取10只作为对照组,其余10只作为模型组。对照组给予普通饲料,模型组给予高糖高脂饲料喂养28 d。于喂养第8天,模型组大鼠开始每日用0.4 mL溶于1%(质量分数)羧甲基纤维素溶液(carboxymethyl cellulose solution,CMC)的来曲唑液(1 mg·kg-1·d-1)灌胃,对照组灌服0.4 mL 1%(质量分数)CMC溶液。自灌胃第7天开始每天早晨行阴道涂片,观察阴道脱落细胞的周期变化,判断动情周期。连续观察至第21天,模型组大鼠均丧失完整动情周期,对照组大鼠均处于动情前期时,结束灌胃,以观察基础卵泡及性激素变化。灌胃结束后,各组大鼠在取材前一晚20:00开始禁食水,次日用1%(质量分数)水合氯醛麻醉,尾静脉采血,用罗氏血糖仪测定空腹血糖(fasting blood glucose,FBG)浓度并记录。随后经腹主动脉取血,收集血清标本置-80 ℃保存备用。迅速摘取双侧卵巢,放入4%(质量分数)多聚甲醛液固定。
1.4 指标检测
1.4.1 大鼠一般情况及阴道细胞学检测
每日观察大鼠活动、饮食、大小便及毛色等情况,每周称体质量1次;自实验开始第15 d起,每天早晨行阴道涂片,观察阴道脱落细胞的周期变化,判断动情周期,直至实验结束。
1.4.2 大鼠血清性激素测定
取大鼠血清,采用ELISA法测定大鼠FSH、LH及T浓度,具体操作严格按照说明书进行。
1.4.3 大鼠血糖、胰岛素浓度测定与评估
用罗氏血糖仪测定FBG浓度,ELISA法测定FINS浓度。采用胰岛素抵抗指数(insulin resistance index,HOMA-IR)及胰岛素敏感指数(insulin sensitivity index,ISI)评估IR程度。HOMA-IR=FBG(mmol/L)×FINS(mU/L)/22.5。ISI=1/ FINS (mU/L)×FBG(mmol/L)[7]。
1.4.4 大鼠卵巢组织学形态观察
应用苏木精-伊红(hematoxylin-eosin,HE)染色法观察大鼠卵巢组织形态。取出经4%(质量分数)多聚甲醛固定的卵巢组织,常规组织脱水,石蜡包埋;将卵巢组织切成5 μm厚切片,常规脱蜡、水化后经HE染色,中性树胶封片,光学显微镜下观察两组大鼠卵巢组织病理学变化。
1.5 统计学方法
2 结果
2.1 大鼠一般情况及体质量的变化情况
2组大鼠饮食、活动、大小便及毛色均未见明显异常,实验期间2组未见大鼠死亡。造模前2组大鼠体质量差异无统计学意义,造模后2组大鼠体质量均较造模前显著增加,差异有统计学意义,造模后模型组与对照组相比,差异有统计学意义(P<0.01),详见表1。
2.2 大鼠动情周期观察
正常雌性大鼠性成熟后,随激素变化会产生4~5 d 规律的动情周期。本研究结果显示,造模前大鼠动情周期稳定,光学显微镜下阴道涂片观察可见成熟的角化脱落上皮,到动情前期出现有核上皮细胞,出现规律动情周期,典型变化详见图1; 造模后10只大鼠的阴道角化和有核上皮数量均明显减少,以角化上皮减少为主,动情期间和动情期后白细胞增加,角化上皮脱落减少,动情期缩短,动情间期延长,提示模型大鼠均失去动情周期变化,典型变化详见图2。
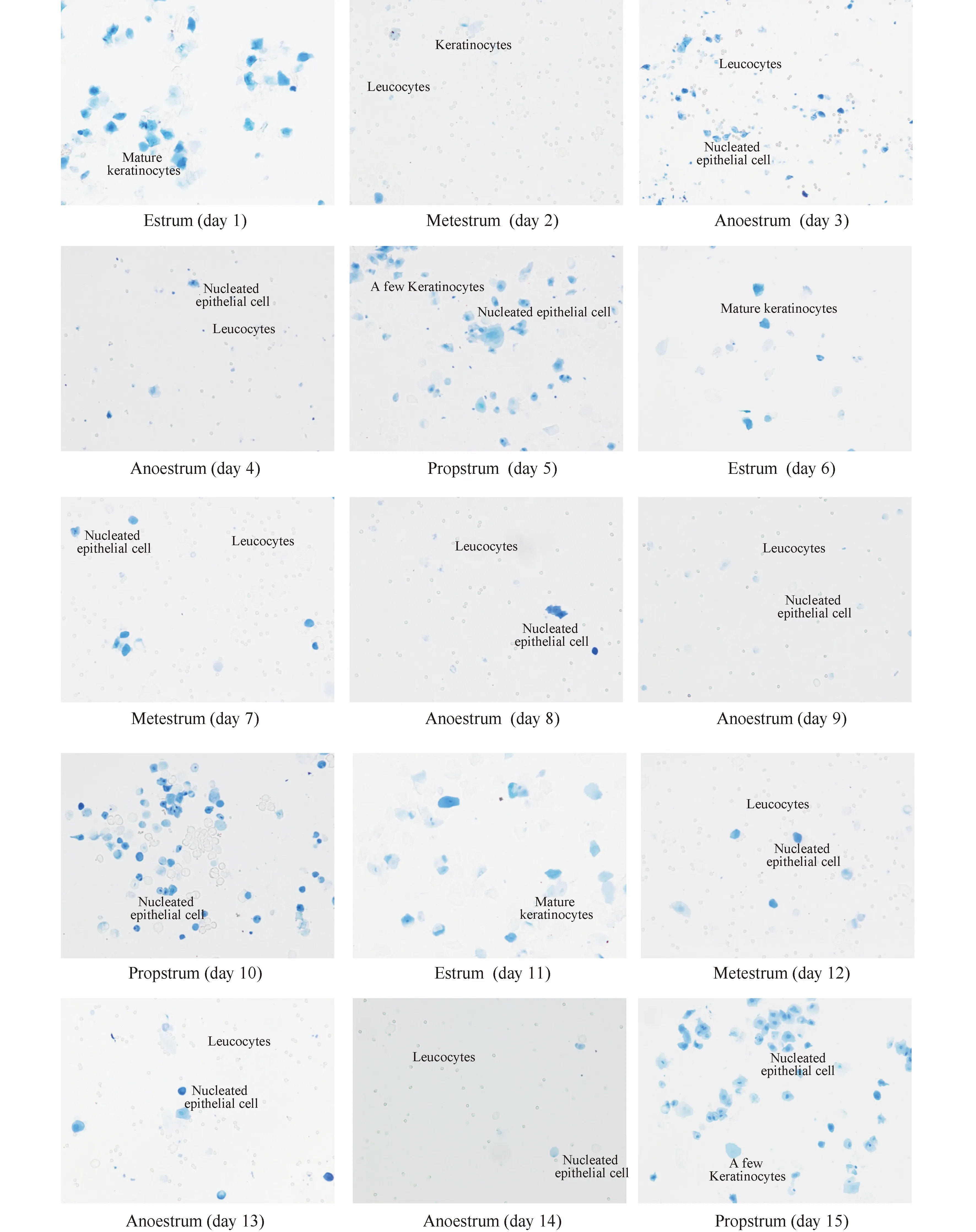
图1 对照组大鼠1~15 d阴道涂片典型变化情况
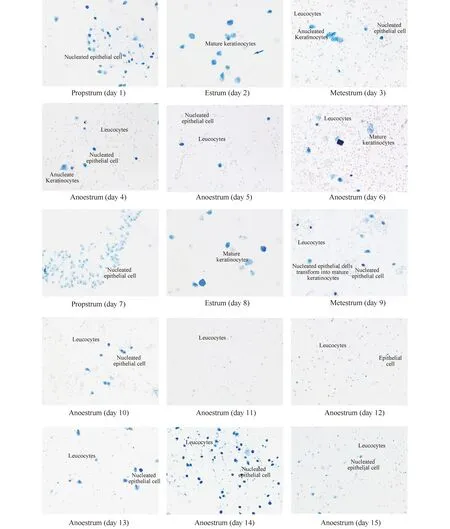
图2 模型组大鼠1~15 d阴道涂片典型变化情况
2.3 大鼠血糖及胰岛素抵抗变化情况
与对照组相比,模型组FBG、FINS及HOMA-IR指数升高(P<0.01),ISI浓度降低(P< 0.01),差异均有统计学意义,详见表2。
表2 各组大鼠血糖及胰岛素抵抗情况比较
2.4 大鼠血清性激素变化情况
与对照组相比,模型组FSH降低(P<0.01),T、LH浓度及LH/FSH比值均明显升高(P<0.01),差异均有统计学意义。提示模型组大鼠出现显著的高雄激素状态和激素分泌异常,详见表3。
表3 各组大鼠血清性激素浓度比较
2.5 大鼠卵巢HE染色情况
对照组大鼠镜下可见多个不同发育时期的卵泡和黄体,极少见囊性扩张卵泡,卵泡内颗粒细胞层较厚,排列整齐,卵泡膜细胞8~9层;光镜下,多囊卵巢综合征的典型形态学特征为:各级发育卵泡数量减少、有囊性扩张的卵泡、闭锁卵泡、黄体组织比例减少、卵泡颗粒细胞层减少或消失、泡膜细胞增生。模型组10只大鼠卵巢均呈现出典型的多囊样改变,可见囊状扩张卵泡,卵泡内颗粒细胞层减少至2~3层,排列疏松,卵泡膜细胞增生,详见图3。
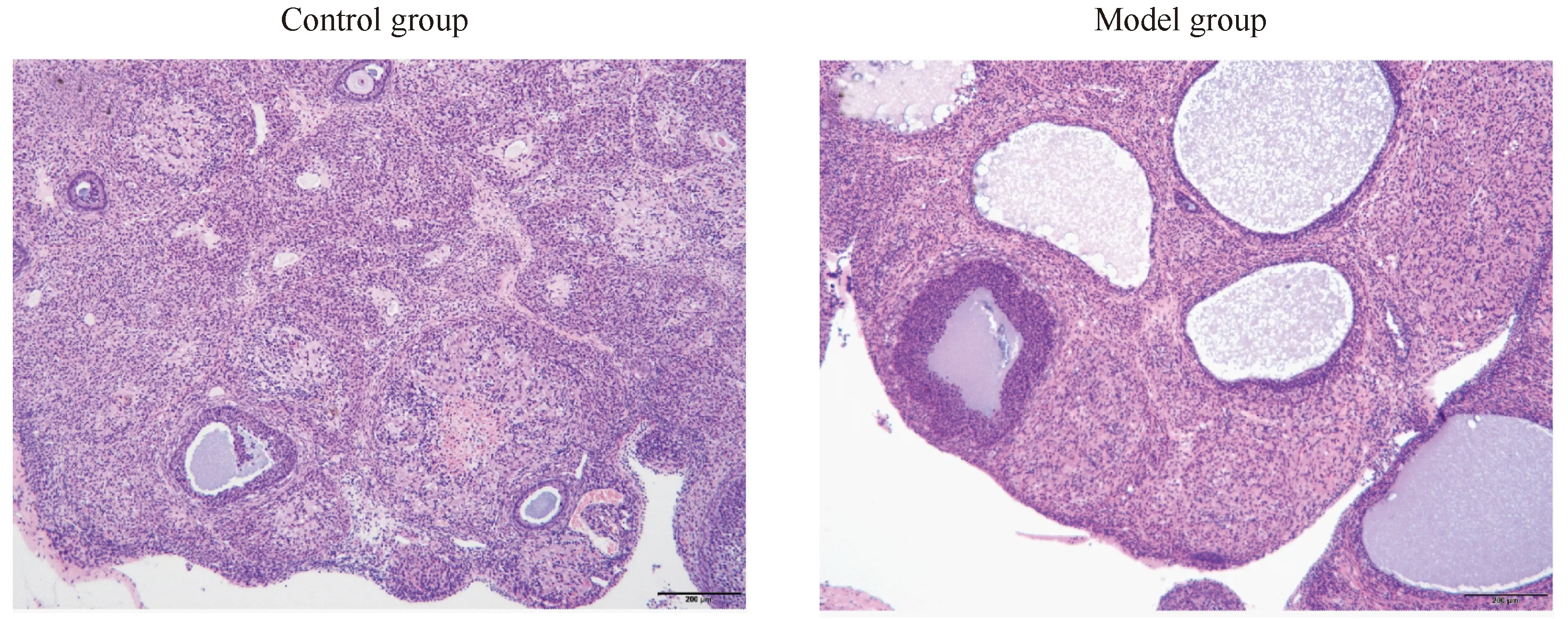
图3 2组大鼠卵巢组织HE染色(光镜,100×)
3 讨论
PCOS是女性最常见的内分泌代谢异常性疾病,主要临床特征为持续性无排卵、高雄激素和卵巢多囊样改变。近年来研究[3,8]显示,约50%~70%的 PCOS患者存在明显IR,10%的PCOS患者伴有糖尿病,同时PCOS-IR患者远期出现2型糖尿病的风险亦显著升高,提示了IR在PCOS发生发展过程中的重要作用。IR作为 PCOS最重要的病理生理机制,是导致PCOS患者超重和肥胖的主要原因,同时超重和肥胖也加重了PCOS的内分泌和代谢紊乱[9]。在临床中,PCOS-IR患者较单纯PCOS的病理机制更加复杂、治疗难度也更大,明确其发病机制并进行有效的治疗仍是目前研究的热点和难点,而构建可靠、简便、符合临床特征的动物模型是进行相关研究的前提。
目前存在多种成熟的制备PCOS动物模型的方法,比如:芳香化酶抑制剂造模法、胰岛素联合人绒毛膜促性腺激素模法、孕激素联合人绒毛膜促性腺激素造模法、雄激素造模法,皮下注射丙酸睾丸酮联合高脂饲料饮食,上述造模方法均能很好地模拟PCOS在卵巢组织形态学及性激素方面的变化[10]。在此基础上,联合其他手段使模型大鼠出现显著的IR及其所致的代谢异常特征,是成功制备出PCOS-IR动物模型的关键。目前,有学者[11-12]对此进行了有益的尝试,主要的方法有:通过皮下注射脱氢表雄酮或者丙酸睾丸油剂联合高脂饲料喂养的方法构建,模型大鼠尽管出现了典型的PCOS-IR病理及内分泌特征,但外源性雄激素注射的方法,并不适用于进行模型大鼠雄激素变化的研究;通过皮下注射胰岛素(insulin,INS)和人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG)的方法[13],尽管亦构建了均有IR及PCOS 特征的模型,但是并不符合PCOS-IR临床发病的过程,对于研究大鼠胰岛素浓度变化不适用;通过来曲唑联合高脂饲料饮食21~30 d的方法[14-16],成功制备了基本符合PCOS-IR 病理及内分泌、代谢紊乱疾病特征的模型,但也存在模型大鼠糖代谢异常及IR程度不高的缺点。
来曲唑作为一种芳香化酶抑制剂,目前被广泛应用于PCOS模型的制备,其主要机制是通过抑制芳香化酶的生物学作用,减少雄激素向雌激素的转化,进而降低雌激素浓度,消除其对下丘脑的负反馈抑制,从而使垂体促性腺激素分泌增加,高水平、失去脉冲的LH作用于卵泡膜细胞,生成过多的雄激素,体内雄激素堆积,特别是卵巢局部雄激素增加,导致排卵障碍和卵巢多囊样改变[17]。尽管来曲唑造模法建立起来的PCOS大鼠模型表现出和人类PCOS类似的代谢特征,但是存在IR状态不够典型的弊端。来曲唑联合高脂饲料的方法,从一定程度上解决了这一弊端,但是模型大鼠的糖代谢异常和IR程度仍不够明显。本课题组长期从事胰岛素抵抗和2型糖尿病的相关基础研究,前期通过高糖高脂饲料喂养的方法成功构建了具备显著IR及糖代谢异常特征的大鼠模型,并经过反复验证[5-6]。
本研究沿用前期使用的高糖高脂饲料配方和干预时间,联合连续来曲唑灌胃的方法,尝试构建PCOS-IR大鼠模型。研究结果显示,经过28 d的高糖高脂饲料喂养和21 d的来曲唑灌胃后,模型大鼠体质量明显增加,INS浓度显著升高,HOMA-IR指数提高3倍以上,同时伴有ISI的显著下降,空腹FBG浓度亦显著下降,从而提示模型大鼠出现了显著的高胰岛素血症及糖代谢紊乱,表现出了显著的IR特征。动情周期的典型变化为:动情前期,大量有核上皮细胞,偶有少量角化细胞;动情期,鳞片状无棱角化细胞,或间自少量上皮细胞;动情后期,大量白细胞;动情间期,白细胞为主,有核细胞及无核角化细胞同时存在,以白细胞为主。本研究结果显示,模型组大鼠血清T浓度出现显著升高,同时大鼠出现持续的无排卵现象及卵巢组织多囊样改变,提示模型组大鼠显现了显著的IR-高胰岛素血症-高雄激素状态及典型的PCOS改变。高胰岛素血症可以刺激卵巢合成大量雄激素形成高雄激素血症,尤其是游离雄激素浓度升高,引起IR的发生。两者互相促进并形成IR-高胰岛素血症-高雄激素血症的恶性循环,共同参与卵巢功能障碍的发生,本研究结果与此一致。同时,模型组大鼠血清LH及LH/FSH比值显著升高,符合典型的PCOS性激素特征。以上研究结果显示,模型组大鼠体质量显著增加,出现持续无排卵现象,卵巢组织呈多囊样改变,同时血清T、LH、LH/FSH比值均显著升高,此外血清INS和HOMA-IR值显著升高、IRI指数显著降低,符合人类PCOS-IR的典型病理改变。
综上所述,高糖高脂饲料联合来曲唑连续灌胃的方法可以成功构建具有显著PCOS-IR病理形态、内分泌异常、代谢紊乱特征的大鼠模型,为未来进行相关后续研究奠定了基础。

