Runt相关转录因子2与基因基质金属蛋白酶3的表达与乳腺癌侵袭性的关系
侯琛
(天津医科大学肿瘤医院/国家肿瘤临床医学研究中心/天津市“肿瘤防治”重点实验室/乳腺癌防治教育部重点实验室,天津 300060)
乳腺癌是一种常见的恶性肿瘤,具有较高的发生率和病死率[1]。肿瘤转移是导致乳腺癌患者发生转移的主要原因[2],其中以骨转移最为常见,严重影响患者的生活质量。Runt相关转录因子2(Runt-related transcription factor 2,RUNX2)能够促进成骨细胞分化与形成[3],参与调节细胞外基质(ECM)重塑相关基因转录[4-5],其高表达与乳腺癌骨转移密切相关[6]。基质金属蛋白酶3(matrix metalloproteinase 3,MMP-3)作为RUNX2的靶基因,可以降解多种ECM底物[7],在肿瘤侵袭、转移中起促进作用[8]。
早期研究发现RUNX2可调节MMP家族成员的表达,如MMP-9、MMP-13[9-10],但有关RUNX2调节乳腺癌中MMP-3表达的研究非常有限。本研究将进一步探讨RUNX2表达水平对MMP-3基因转录的影响及其机制,为乳腺癌的靶向治疗研究提供潜在的理论基础。
1 材料与方法
1.1 主要试剂与仪器
乳腺癌细胞MDA-MB-231、BT-549和人胚胎肾上皮细胞293T购于ATCC细胞库;Opti-MEM、胎牛血清、RPMI-1640以及DMEM高糖培养基购于美国Gibco公司;Lipofectamine 2000、逆转录试剂盒以及Platinum Quantitative PCRSuperMix-UDG试剂盒购于美国Invitrogen公司;氨苄青霉素购自上海生工公司;RUNX2、MMP-3抗体购于Santa Cruz公司,β-actin抗体购于美国Abcam公司;T4DNA连接酶、限制性内切酶Hind III酶、Xho I酶、GeneJETPlasmid Miniprep Kit试剂盒和GeneJETGel Extraction试剂盒购于美国Thermo公司;感受态细胞DH-5α、PrimeSTARMax DNA Polymerase、DNA Marker购自日本TaKaRa公司;Dual-Luciferase Reporter Assay System购自Promega公司;染色质免疫共沉淀试剂盒购自美国Millipore公司。
1.2 RUNX2 和MMP-3 基因靶向关系以及无远处转移生存(DMFS)的生物信息学预测
利用cBioPortal数据库(http://www.cbioportal.org)根据Breast Cancer(METABRIC,Nature 2012 &Nat Commun 2016)数据集分析1902例乳腺癌患者组织中RUNX2和MMP-3 mRNA水平间相关性;在Kaplan Meier Plotter数据库(http://kmplot.com/analysis)中下载乳腺癌患者基因表达数据及生存信息,分析基因表达谱与预后间关系(http://kmplot.com/analysis);生物信息学方法(http://www.cbioportal.org;http://jaspar.genereg.net;http://kmplot.com/analysis)预测乳腺癌中RUNX2与MMP-3的相关性和启动子区结合的保守序列以及其在乳腺癌患者中与DMFS的相关性[11]。
1.3 染色质免疫共沉淀(ChIP)
在MDA-MB-231细胞中转染带有His标签的RUNX2过表达质粒,并用His抗体特异性结合于RUNX2结合的基因启动子序列。收集ChIP-DNA产物并利用GeneJETPCRPurification Kit试剂盒纯化。引物设计软件(NCBI中Primer Blast)设计扩增引物序列(MMP-3 基因启动子区),引物由上海生工生物工程有限公司合成。PCR反应和琼脂糖凝胶电泳分析RUNX2 对MMP-3启动子DNA 片段的结合。C h IP 引物上游序列:5'-ATAGGGATCTTATTGC-3',下游序列:5'-GAACATCTTGGGAGTA-3';空白对照引物上游序列:5'-GAATGTTTGGAAATGGTCCT-3',下游序列:5'-TCTCTATGCCTTGCTGTC-3'。PCR反应扩增模板即ChIPDNA。反应体系为:10×Buffer 2.5 μL,dNTP(25 mmol/L)2 μL,其中,上下游引物(10 mmol/L)各0.5 μL,DNA2 μL,Taq酶2.5U,补充水至25 μL。PCR扩增条件:95 ℃预变性4 min;94 ℃ 30 s,最适退火温度30 s,72 ℃ 30 s,共37个循环;72 ℃延伸5 min。扩增产物经琼脂糖凝胶电泳分离后,在成像仪中观察RUNX2在MMP-3基因启动子区序列是否存在结合。
1.4 细胞转染、qRT-RCR 和Western blot
分别收集转染了siRUNX2、RUNX2过表达质粒的MB-MDA-231及BT549细胞并提取RNA,使用逆转录试剂盒将所提取的RNA反转为cDNA;随后,通过qRT-PCR检测干扰RUNX2处理后的MMP-3的mRNA表达水平。RUNX2的上游引物序列:5'-CTCTGCACCAAGTCCTTTTAATC-3',下游引物序列:5'-AGGAGGGGTAAGACTGGTCATAG-3',探针序列:5'-TGCCTGGGGTCTGTAATCTGAC-3';MMP-3 上游引物序列:5'-TGCCCACTTTGATGATGAG-3',下游引物序列:5'-GTTGGCTGAGTGAAAGAGACC-3',探针序列:5'-GACAAAGGATACAACAGG GACCAAT-3'。TaqMan PCR反应体系:10 μLSuperMix,0.4 μLRox,0.6 μL上下游引物,1 μL模板cDNA,加水补至20 μL。PCR反应条件:95 ℃预变性30 s;95 ℃变性30 s,65 ℃(RUNX2)或57 ℃(MMP-3)延伸30 s,共40 个循环。以GAPDH为内参,用2-ΔΔCt值表示目的基因的相对表达水平。
分别收集转染了siRUNX2、RUNX2过表达质粒的MB-MDA-231及BT549细胞,PBS冲洗2次后置于裂解液中冰上裂解30 min,随后,4 ℃,12000r/min离心15 min,吸取上清于新EP管中进行蛋白质浓度测定。10% SDS-PAGE分离蛋白并转膜,5%脱脂牛奶室温封闭1 h,按比例稀释一抗,β-actin(1∶7000)、RUNX2(1∶1000)、MMP-3(1∶1000),4 ℃过夜孵育;TBST 洗膜3 次(7 min/次)后室温孵育二抗1 h,再用TBST洗膜3次(7 min/次),加入ECL发光工作液后显影观察。
1.5 PCR 法扩增目的DNA 片段及纯化
以收取细胞基因组DNA为模板,运用PCR法扩增MMP-3基因包含结合序列以及空白对照的两个不同片段大小的启动子区目的基因。双荧光引物空白对照上游序列:5'-GGAGGTACCCTATTCTGCCCATGAGGTTT-3',下游序列:5'-GCAGATCTCTGCCTCCTTGTAGGTCCAA-3';双荧光包含RUNX2结合位点的引物上游序列5'-GGAGGTACCGGGCATCTTCAGTCATAGGG-3'下游序列5'-GCAGATCTCTGCCTCCTTGTAGGTCCAA-3'。PCR 的反应条件:98 ℃预变性3 min;98 ℃变性10 s,60 ℃退火5 s,72 ℃延伸15 s,共35 个循环。PCR 的反应体系:2×PrimeSTARMax Premix 25 μL;DNA2 μL;上、下游引物各 1 μL;加水补至50 μL。
1.6 MMP-3 基因启动子荧光素酶报告基因质粒的构建
应用特异的限制性内切酶Xho I和Hind III对PGL3-Basic质粒以及合成的启动子基因片段进行双酶切反应。反应物37 ℃水浴过夜,琼脂糖凝胶电泳切取回收目的片段进行DNA纯化,同时利用T4DNA连接酶在PGL3-Basic载体中插入DNA片段,并将所得反应物置于4 ℃过夜连接。随后将10 μL的连接产物加入120 μL感受态细胞DH5α中,冰上放置30 min后,42 ℃的水浴90 s,再次置于冰上10 min。随后,复加(无氨苄霉素抗性)LB的培养基1 mL进行混匀,并置于37 ℃轻摇1 h,吸取100 μL涂抹在含氨苄霉素抗性LB平板中(在37 ℃的环境平板倒置过夜培养)。从中选取单个菌落加入培养基中并在37 ℃的摇动12 h,经过菌液PCR鉴定(反应体系同1.5),将实验所得的质粒送达北京金唯智公司进行测序鉴定,测序结果应用UCSC基因组浏览器与NCBI软件所获的启动子区序列,从比对中确认克隆片段序列的正确性。
1.7 双荧光素酶活性测定
参照生产商说明书,通过24孔板转染双荧光质粒24 h后,去除孔内培养基,PBS洗涤两次,每孔内添加100 μL裂解液,室温摇动20 min至充分裂解;随后吸取10 μL裂解产物与50 μL底物进行混合,检测萤火虫荧光素酶活性随后加入50 μL的Stop&Glo Reagent,检测海肾荧光素酶活性,计算上述两种荧光素酶活性的比值。
1.8 Transwell 实验
首先将Matrigel Invasion Chamber(BDBiosciences公司)从-20 °C冰箱放置4 ℃过夜,用50 mg/LMatrigel 1∶8稀释液包被Transwell小室底部膜的上室面,37 ℃培养箱放置5 h使其凝固。之后分别在上室和下室中加入500 μL无血清培养基,然后放置于37 °C培养箱2 h。用移液器移除上下室中的培养基,下室中加入750 μL含20%血清的培养基。胰酶消化细胞,终止消化后1000r/min离心5 min弃去培养基,用PBS洗1~2遍,用无血清培养基配制细胞浓度为5×104个/mL的单细胞悬液,取500 μL细胞悬液缓慢加入上室,轻轻混匀,定时观察细胞穿过小室的侵袭情况。小室分别用棉签小心擦去其上层的细胞。之后用配制好的4%甲醛室温固定细胞30 min,用Giemsa染液对细胞进行染色,室温30 min,清水冲洗,室温风干,用刀片将膜部分小心割下,中性树胶固定封片。显微镜下观察穿过孔的染色细胞,随机选取的5个视野拍照并统计细胞数。
1.9 统计学处理
SPSS21.0软件用于统计学分析,Transwell实验采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 RUNX2 与MMP-3 高表达乳腺癌患者DMFS降低
1902 例原发性乳腺癌患者肿瘤组织中,RUNX2与MMP-3的mRNA水平呈正相关(r=0.3042,P<0.0001)(图1A)。在Kaplan Meier Plotter数据库,RUNX2或MMP-3低表达患者的DMFS(黑色曲线)明显高于RUNX2或MMP-3高表达患者(红色曲线)(P=0.034,P=0.013(图1B)。
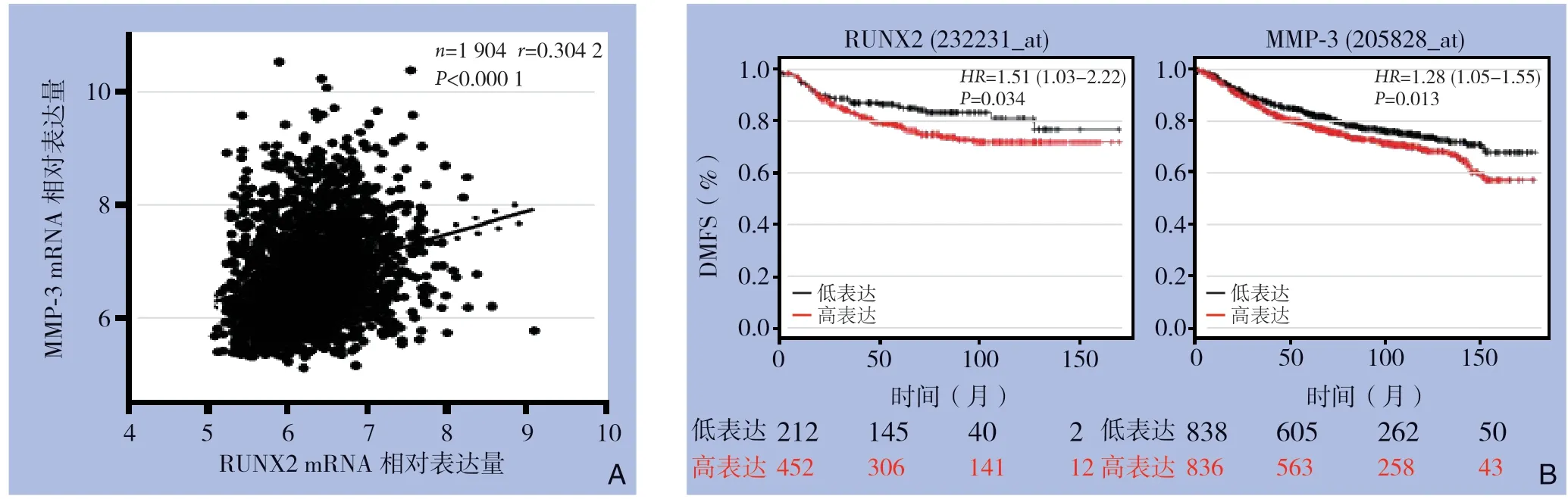
图1 数据库资料分析 A:RUNX2 与 MMP-3 在乳腺癌中相关性分析;B:RUNX2 与MMP-3 在乳腺癌患者中与DMFS 相关性Figure 1 Database analysis A:Correlation analysis of the relationship between RUNX2 and MMP-3 in breast cancer;B:Correlation analysis of RUNX2 and MMP-3 with DMFS in breast cancer patients
2.2 RUNX2可调节MDA-MB-231细胞中MMP-3表达水平
qRT-PCR结果显示,干扰RUNX2后,MDA-MB-231细胞MMP-3 mRNA水平下调(均P<0.05)(图2A)。Western blot检测结果显示,干扰RUNX2 后,MDA-MB-231与BT-549细胞中RUNX2和MMP-3蛋白表达水平均明显下调,而转染RUNX2过表达质粒后,MDA-MB-231与BT-549细胞中RUNX2与MMP-3蛋白表达水平均明显上调(均P<0.05)(图2B)。以上结果证实,在MDA-MB-231细胞中RUNX2水平可以影响MMP-3表达。
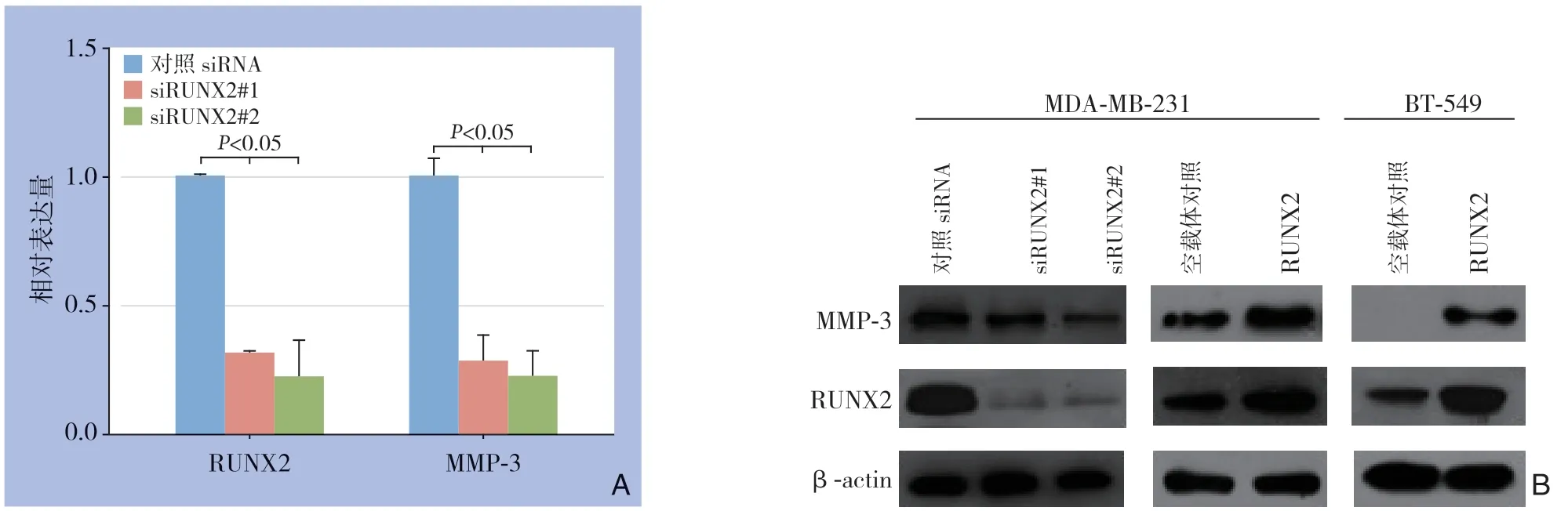
图2 RUNX2 对MMP-3 表达的影响 A:qRT-PCR 检测转染siRUNX2 的MDA-MB-231 中RUNX2 与MMP-3 mRNA;B:Western blot 检测转染siRUNX2 及RUNX2 过表达质粒后MDA-MB-231 与BT-549 细胞中RUNX2 与MMP-3 蛋白表达水平Figure 2 The effect of RUNX2 on MMP-3 expression A:The mRNA levels of RUNX2 and MMP-3 in MDA-MB-231 transfected with siRUNX2 detected by qRT-PCR;B:The protein levels of RUNX2 and MMP-3 in MDA-MB-231 and BT-549 cells transfected with siRUNX2 or RUNX2 over-expressed plasmid detected by Western blot
2.3 RUNX2 可以与MMP-3 基因启动子序列结合
通过生物信息学分析获得MMP-3转录起始位点上游2 kb的启动子区序列,发现MMP-3启动子序列中存在RUNX2结合位点(5'-ACCACA-3')(图3A)。利用ChIP实验在MDA-MB-231细胞中进行验证。采用脂质体法用带有His标签的RUNX2过表达质粒转染MDA-MB-231细胞,并用His抗体特异性结合于RUNX2结合的基因启动子序列,之后进行PCR反应和琼脂糖凝胶电泳,分析RUNX2对MMP-3启动子DNA片段的结合。结果显示,在MDA-MB-231细胞中,RUNX2可以与MMP-3基因启动子序列结合(图3B)。

图3 RUNX2 与MMP-3 相关性验证 A:Jaspar 预测RUNX2 在MMP-3 基因启动子区的结合位点;B:ChIP 实验检测RUNX2 与含有或缺乏RUNX2 结合序列的MMP-3 基因启动子区的结合作用Figure 3 Verification of the correlation between RUNX2 and MMP-3 A:Predicting the binding site of RUNX2 in the MMP-3 gene promoter using Jaspar;B:The binding of RUNX2 to the MMP-3 promoters containing or lacking RUNX2-binding sequences assessed by ChIP assays
2.4 启动子区扩增产物鉴定
为进一步验证,构建含有或缺乏RUNX2结合位点的MMP-3启动子区双荧光报告质粒。以293T细胞基因组DNA为模板,通过PCR法获得MMP-3启动子区DNA片段,随后采用1.5%琼脂糖凝胶电泳对其进行检测,可见扩增出两条条带的状态呈单一性,分别位于601 bp和1346 bp处,根据条带位置可初步判断出扩增所得的DNA片段为所需的目的DNA片段(图4)。
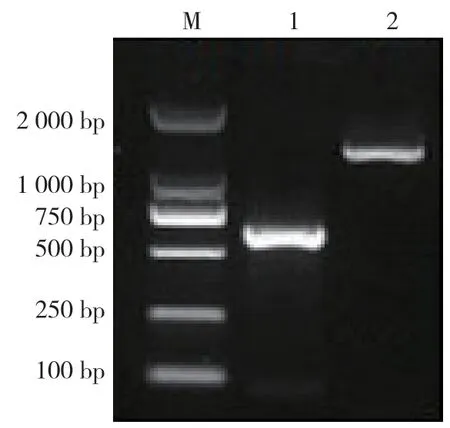
图4 MMP-3 基因包含RUNX2 结合序列启动子区及其空白对照PCR 扩增产物电泳图 M:DL2000DNAMarker;1:不含RUNX2 结合位点MMP-3 基因启动子PCR 产物;2:含RUNX2 结合位点MMP-3 基因启动子PCR 产物Figure 4 Electrophoretogram of PCR amplification product of the promoter region of MMP-3 gene containing RUNX2 binding sequence and its blank control M:DL2000DNAMarker;1:PCR products of MMP-3 gene promoter containing no Runx2 binding site;2:PCR products of MMP-3 gene promoter containing Runx2 binding site
2.5 重组质粒的酶切鉴定
通过琼脂糖凝胶电泳对重组质粒进行双酶切鉴定,结果显示,克隆片段与目的序列的理论序列大小一致,初步判断质粒构建正确(图5)。
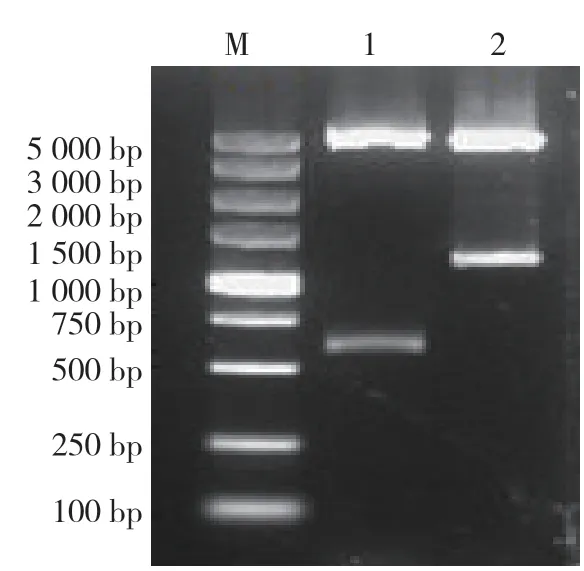
图5 琼脂糖凝胶电泳双酶切鉴定 M:DL5000DNA marker;1:空白对照质粒双酶切产物;2:含RUNX2结合位点质粒双酶切产物Figure 5 DNA plasmid identified by restriction endonucleases digestion M:DL5000DNA marker;1:Double digestion products of the empty control plasmids;2:Double digestion products of the plasmids containing RUNX2 binding site
2.6 RUNX2 可调节MMP-3 双荧光质粒转录活性
将含有RUNX2 结合位点的MMP-3 启动子序列克隆到pGL3-Basic质粒,构建pGL3-MMP-3及其空白对照荧光报告质粒。通过siRNA沉默MDAMB-231 细胞中RUNX2 后,再分别转染p GL3-MMP-3 质粒,同时转染空白质粒作为对照,双荧光报告素酶系统检测启动子转录活性。在沉默RUNX2表达的细胞中pGL3-MMP-3转录活性低于对照组(图6),证实RUNX2能够促进MMP-3启动子的转录活性。
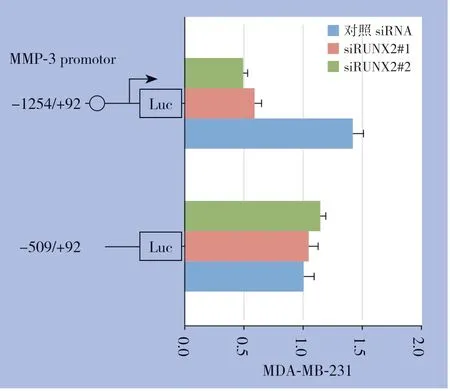
图6 RUNX2 对MMP-3 启动子双荧光报告质粒转录活性影响Figure 6 Effects of RUNX2 on transcriptional activity of MMP-3 promoter luciferase reporter plasmids
2.7 RUNX2 和MMP-3 过表达促进乳腺癌细胞侵袭
Transwell方法检测细胞的侵袭能力发现,RUNX2过表达的MDA-MB-231、BT-549与对照细胞相比侵袭能力增加,而同时沉默MMP-3表达之后,过表达RUNX2的两种细胞侵袭能力降低(均P<0.05)(图7)。
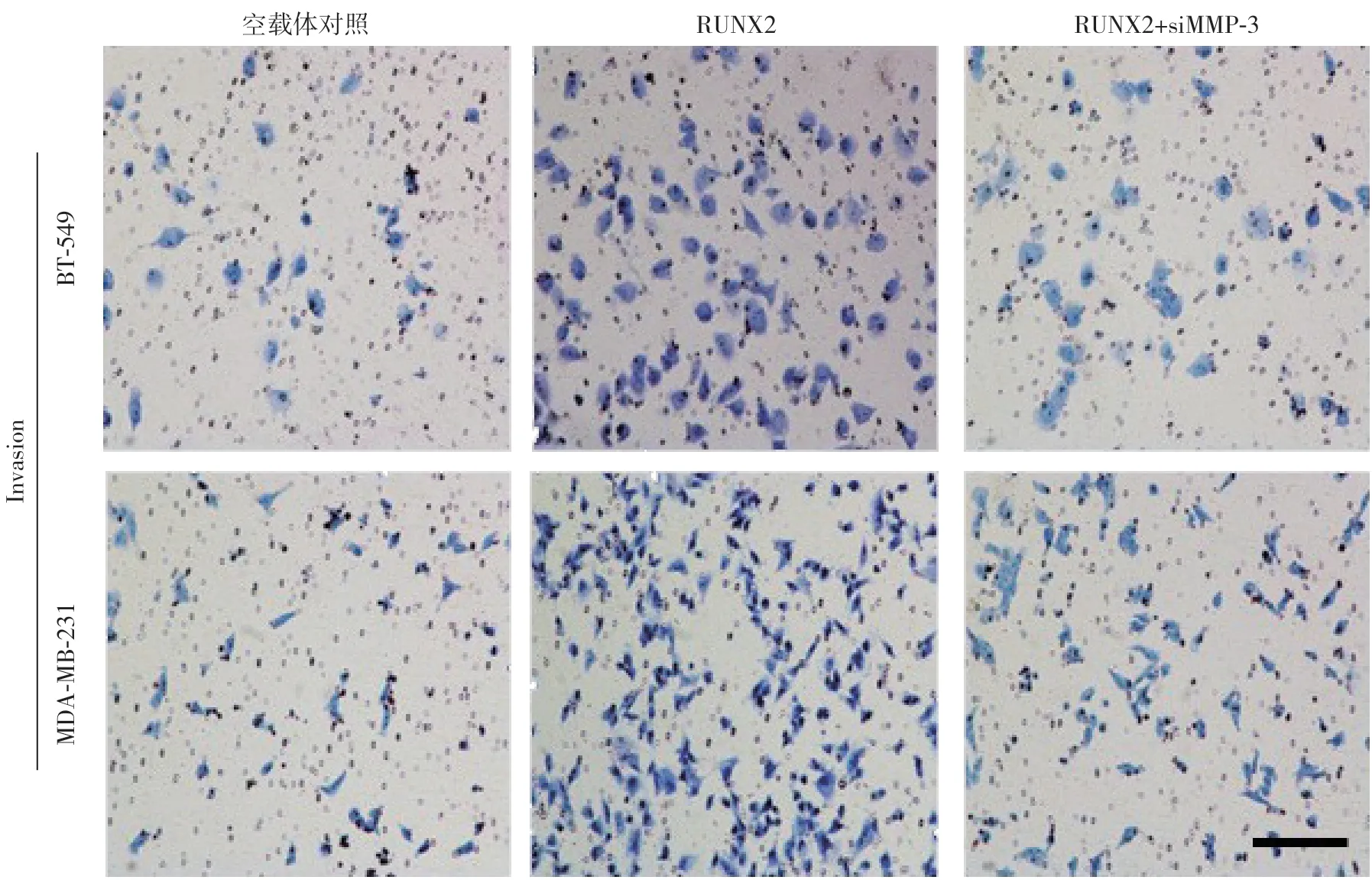
图7 RUNX2 和MMP-3 过表达对乳腺癌细胞侵袭能力的影响Figure 7 Effect of overexpression of RUNX2 and MMP-3 on the invasion ability of breast cancer cells
3 讨论
乳腺癌是女性常见的恶性肿瘤之一,尽管在诊断、治疗及预后评估方面已经取得较大进展,但病死率仍然没有明显改善。乳腺癌的发生发展与癌基因激活与抑癌基因失活密切相关。因此,筛选出与乳腺癌发生发展相关的分子遗传学改变,对于早期诊断、个体化治疗及预后分层至关重要。本研究采用多种生物信息学分析方法,发现乳腺癌患者组织中RUNX2和MMP-3 mRNA水平呈正相关,且高表达RUNX2或MMP-3患者具有更短的DMFS。进一步的分子生物学实验证实,RUNX2表达水平可以调节乳腺癌细胞中MMP-3基因的转录水平,且两者过表达可以增强肿瘤细胞的迁移能力,上述结果为乳腺癌的临床研究提供了潜在的理论基础。
RUNX2 属于RUNX 转录因子家族成员,通过调控下游基因表达参与细胞增殖分化等过程。RUNX2通过维持成骨细胞和破骨细胞的生成,调节骨发育[12-14]。早期研究发现,RUNX2可参与多种肿瘤的发生与发展,包括乳腺癌、胰腺癌、肝癌等[15-18],其中越来越多的证据支持RUNX2在浸润性乳腺癌中发挥重要作用。与正常乳腺上皮细胞相比,RUNX2在浸润性乳腺癌细胞系中被发现上调[19],是浸润性和非浸润性乳腺癌细胞比较筛选中确定的基因之一[20]。RUNX2过表达与乳腺癌的侵袭以及骨转移有关[5]。
侵袭和转移是导致乳腺癌进展及患者死亡的主要原因[21-22]。肿瘤细胞启动转移时,细胞首先要失去黏附力,运动并侵入ECM,随后进入循环系统,最终在远处的组织和器官中定植形成转移灶[23-24]。ECM的蛋白水解是肿瘤侵袭及转移过程中的关键步骤,也是是血管生成和肿瘤细胞浸润的重要因素。研究[26-28]表明MMP在负责ECM的降解中起到关键作用[25],MMP-1,-2,-3,-7,-9,-13和-14的上调与乳腺癌细胞的侵袭有关。早期研究[26]发现MMP-3过表达可导致小鼠乳腺肿瘤的形成。此外,据报道[27]MMP-3的表达水平在乳腺癌细胞中上调并与乳腺癌存活率相关。
尽管RUNX2 和MMP-3 在乳腺癌进展中发挥重要的促进作用,但有关两者间相互作用关系的研究非常有限。本研究联合数据库分析发现,乳腺癌组织RUNX2 mRNA与MMP-3 mRNA表达水平呈正相关,高表达RUNX2 或MMP-3 的乳腺癌患者的DMFS均显著降低,提示RUNX2和MMP-3能提高乳腺癌患者的复发与转移。RUNX2能够促进乳腺癌细胞MMP-3 表达,提示RUNX2 很可能通过调节MMP-3表达增强乳腺癌细胞侵袭能力。经过Transwell实验验证发现,过表达RUNX2可以增强肿瘤细胞的侵袭能力,若在过表达RUNX2的乳腺癌细胞中下调MMP-3表达,则可以抑制细胞侵袭。由此,笔者推测RUNX2很可能通过调节MMP-3的表达参与乳腺癌细胞的侵袭。早期研究发现,RUNX2还可调节MMP2、MMP9和MMP13表达参与肿瘤的转移和侵袭[29-30]。由于MMP-3可以激活多种MMP,包括proMMP-1、-3、-7、-8、-9和-13[28],因此,RUNX2 除了结合到MMP9、MMP13 启动子区并直接调控其转录,还可能间接通过促进MMP-3 的表达进而激活MMP9 以及MMP13。因此,尽管单个金属蛋白酶的表达虽然不足以使乳腺腺癌进展为侵袭性和转移性表型,但是可以通过多种基质金属酶的协作促进乳腺癌侵袭过程,而这个阶段正是针对乳腺癌疾病治疗的关键环节,应引起足够重视。
总之,本研究首次报道了RUNX2可以通过调节MMP-3表达影响乳腺癌细胞侵袭能力,为乳腺癌治疗的临床及基础研究提供了潜在的理论基础。

