芥子碱硫氰酸盐对人皮肤鳞状细胞癌SCL-1细胞增殖、上皮间质转化、转移的影响及其机制研究
苏羽屾 曾智锐 荣冬芸 王叶 李丹 唐姗姗 汪涛 龙雪梅 曹煜


中图分类号 R965 文献标志码 A 文章编号 1001-0408(2021)08-0952-09
DOI 10.6039/j.issn.1001-0408.2021.08.10
摘 要 目的:研究芥子碱硫氰酸盐(ST)对人皮肤鳞状细胞癌SCL-1细胞增殖、上皮间质转化(EMT)和转移的影响,并考察其可能的作用机制。方法:将人皮肤鳞状细胞癌SCL-1细胞分为空白对照组(0.1%二甲基亚砜)和ST不同浓度组(5、10、20 μmol/L),分别通过CCK-8实验、5-乙炔基-2′脱氧尿嘧啶核苷染色实验、细胞划痕实验和Transwell小室侵袭实验测定各组细胞的增殖、迁移和侵袭能力,通过Western blot实验和免疫荧光实验分别测定各组细胞中EMT相关指标N-钙黏着蛋白(N-cadherin)、E-钙黏着蛋白(E-cadherin)的表达水平。另将SCL-1细胞分为空白对照组(0.1%二甲基亚砜)、ST单用组(20 μmol/L)、ST+NSC228155组[20 μmol/L ST+100 μmol/L NSC228155(EGFR激动剂)]和ST+SC79组[20 μmol/L ST+20 μmol/L SC79(PI3K/Akt激动剂)],分别通过CCK-8实验、细胞划痕实验和Transwell小室侵袭实验测定各组细胞的增殖、迁移和侵袭能力,并通过Western blot实验测定空白对照组(0.1%二甲基亚砜)和ST不同浓度组(5、10、20 μmol/L)组细胞中表皮生长因子受体(EGFR)、磷脂酰肌醇3激酶(PI3K)、磷酸化磷脂酰肌醇3激酶(p-PI3K)、蛋白激酶B(Akt)和磷酸化Akt(p-Akt)蛋白的表达水平,以验证ST的作用与EGFR/PI3K/Akt信号通路的关系。另将SCL-1细胞和人正常皮肤成纤维细胞WS1分别分为空白对照组(0.1%二甲基亚砜)、 ST组(20 μmol/L)、 ZD1839组(阳性对照,20 μmol/L,EGFR抑制剂)和LY294002组(阳性对照,20 μmol/L,PI3K/Akt抑制剂),采用CCK-8实验测定各组细胞的增殖能力,以评价ST的细胞毒性。结果:与空白对照组比较,5、10、20 μmol/L ST组SCL-1细胞的增殖、迁移和侵袭能力均显著减弱(P<0.05);Western blot和免疫熒光实验结果显示,5、10、20 μmol/L ST组SCL-1细胞中N-cadherin蛋白的表达均显著下调(P<0.05),E-cadherin蛋白的表达均显著上调(P<0.05),并且细胞中EGFR、p-PI3K、p-Akt蛋白的表达水平均显著降低(P<0.05)。与ST单用组比较,ST+NSC228155组和ST+SC79组SCL-1细胞的增殖、迁移和侵袭能力均显著增强(P<0.05)。与空白对照组比较,ST组WS1细胞的增殖能力差异无统计学意义(P>0.05),SCL-1细胞增殖能力显著减弱(P<0.05),ZD1839组和LY294002组两种细胞的增殖能力均显著减弱(P<0.05);与ST组比较,ZD1839组和LY294002组WS1细胞的增殖能力均显著减弱(P<0.05),但SCL-1细胞的增殖能力差异无统计学意义(P>0.05)。结论:ST可能通过抑制EGFR/PI3K/Akt信号通路的活化而抑制人皮肤鳞癌SCL-1细胞的增殖、EMT和转移,且其毒副作用较小。
关键词 芥子碱硫氰酸盐;人皮肤鳞状细胞癌SCL-1细胞;增殖;上皮间质转化;转移;EGFR/PI3K/Akt信号通路
Study on the Effects and Its Mechanism of Sinapine Thiocyanate on the Proliferation, Epithelial Mesenchymal Transition and Metastasis of Human Cutaneous Squamous Cell Carcinoma SCL-1 Cells
SU Yushen1,2,ZENG Zhirui3,4,RONG Dongyun1,2,WANG Ye1,2,LI Dan1,2,TANG Shanshan1,2,WANG Tao1,2, LONG Xuemei1,2,CAO Yu1,2(1. School of Clinical Medicine, Guizhou Medical University, Guiyang 550004, China; 2. Dept. of Dermatology, the Affiliated Hospital of Guizhou Medical University, Guiyang 550004, China; 3. Dept. of Physiology, School of Basic Medical Science, Guizhou Medical University, Guiyang 550004, China; 4. Guizhou Provincial Key Laboratory of Pathogenesis&Drug Research on Common Chronic Diseases, Guiyang 550004, China)
ABSTRACT OBJECTIVE: To study the effects of sinapine thiocyanate (ST) on the proliferation, epithelial mesenchymal transformation (EMT) and metastasis of human cutaneous squamous cell carcinoma SCL-1 cells, and to investigate its possible mechanism. METHODS: Human cutaneous squamous cell carcinoma SCL-1 cells were divided into blank control group (0.1% DMSO) and ST different concentration groups (5, 10, 20 μmol/L). CCK-8 assay, 5-ethynyl-2′-deoxyuridine (EDU) test, scratch test and Transwell chamber invasion test were adopted to test the proliferation, migration and invasion ability. The expression of N-cadherin and E-cadherin were detected by Western blot and immunofluorescence assay. Other SCL-1 cells were collected and divided into blank control group (0.1% DMSO), ST group (20 μmol/L), ST+NSC228155 group [20 μmol/L ST+100 μmol/L NSC228155 (EGFR agonist)] and ST+SC79 group [20 μmol/L ST+20 μmol/L SC79 (PI3K/Akt agonist)]. The proliferation, migration and invasion ability of SCL-1 cells in each group were detected by CCK-8 assay, scratch test and Transwell chamber invasion assay. The expression of epidermal growth factor receptor (EGFR), phosphatidylinositol 3 kinase (PI3K), phosphorylated phosphatidylinositol 3 kinase (p-PI3k), protein kinase B (Akt) and phosphorylated protein Akt (p-Akt) protein of cells in blank control group and ST different concentration groups (5, 10, 20 μmol/L) were determined by Western blot assay so as to validate the relationship between ST effect and EGFR/PI3K/Akt signaling pathway. SCL-1 cells and human normal skin fibroblasts cell WS1 were divided into blank control group (0.1% DMSO), ST group (20 μmol//L), ZD1839 group (positive control, 20 μmol//L, EGFR inhibitor) and LY294002 group (positive control, 20 μmol//L, PI3K/Akt inhibitor). CCK-8 assay was used to detect the cell proliferation in order to evaluate the cells cytotoxicity of ST. RESULTS: Compared with blank control group, the proliferation, migration and invasion ability of SCL-1 cells were significantly decreased in 5, 10, 20 μmol/L ST groups (P<0.05). Western blot and immunofluorescence assay showed that the expression of N-cadherin in SCL-1 cells were decreased significantly in 5, 10, 20 μmol/L ST groups (P<0.05), while the protein expression of E-cadherin was increased significantly (P<0.05); the protein expressions of EGFR, p-PI3K and p-Akt were significantly decreased (P<0.05). Compared with ST group, the proliferation, migration and invasion ability of SCL-1 cells were increased significantly in ST+NSC228155 group and ST+SC79 group (P<0.05). Compared with blank control group, the proliferation ability of WS1 cells had no significant change in ST group, while the proliferation ability of SCL-1 cells was decreased significantly (P<0.05); the proliferation ability of the two kinds of cells were decreased significantly in ZD1839 group and LY294002 group (P<0.05). Compared with ST group, the proliferation ability of WS1 cells was decreased significantly in ZD1839 group and LY294002 group (P<0.05), but there was no significant difference in the proliferation ability of SCL-1 cells (P>0.05). CONCLUSIONS: ST may inhibit the proliferation, EMT and metastasis of SCL-1 cells through inhibiting the activation of EGFR/PI3K/Akt signaling pathway, and its side effects are few.
KEYWORDS Sinapine thiocyanate; Human cutaneous squamous cell carcinoma SCL-1 cells; Proliferation; Epithelial mesechymal transition; Metastasis; EGFR/PI3K/Akt signaling pathway
皮肤鳞状细胞癌多为表皮肿瘤,常采用手术方法进行治疗,但治疗后容易复发和转移;复发后,多采用放化疗方法进行治疗,治疗风险较高[1-2]。因此,寻找一种安全的新型药物对于治疗复发和转移性皮肤鳞状细胞癌较为重要。皮肤鳞状细胞癌易发生远处转移,其中上皮间质转换(EMT)是其转移的重要机制之一[3]。EMT是细胞由上皮表型转化为间质表型的过程,其与多种细胞生物的正常胚胎发育相关,但同时也与肿瘤的发生发展相关[4]。在皮肤鳞状细胞癌的发展过程中,原柱状的正常上皮细胞会逐渐变为梭形的间质细胞,此时上皮细胞的极性消失,失去了原本与基底膜连接的上皮表型特征,从而获得迁移、侵袭、抗凋亡等间质表型功能[5]。
表皮生长因子受体(EGFR)是细胞增殖、发育所必需的受體[6]。当表皮生长因子与其配体在细胞外结合后形成二聚体,此二聚体可使细胞内酪氨酸发生磷酸化并激活下游细胞内的信号级联,激活磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)途径[7],而该途径与癌细胞的增殖、迁移和侵袭等恶性行为密切相关[8]。
芥子碱硫氰酸盐(ST)是从十字花科药用植物中提取得到的一种木脂素类化合物,具有抗炎、抗衰老、抗氧化、抗肿瘤等多种药理作用[9],具有较大的开发价值。有报道指出,ST能够抑制小鼠的血脂血糖升高、动脉粥样硬化和肝细胞脂肪变性[10-11];此外,ST对肝癌细胞的增殖和转移有抑制作用[12]。然而,ST对皮肤鳞状细胞癌的影响及作用机制尚不清楚。因此,本研究拟探讨ST对人皮肤鳞状细胞癌SCL-1细胞增殖、EMC和转移的影响,并从EGFR/PI3K/Akt信号通路出发初步分析其分子作用机制,为ST药用价值的进一步开发以及将其用于临床治疗皮肤鳞状细胞癌提供可行的参考依据。
1 材料
1.1 主要仪器
HHM-SY96S型多功能酶标仪购自深圳恒美生物科技有限公司;54-03003型倒置光学显微镜购自德国Bresser公司;GelDoc XR型凝胶成像仪购自美国Bio-Rad公司;LV100ND型荧光显微镜购自日本Nikon公司;DYCP-31DN型电泳仪、DYCZ-40D型转膜仪均购自北京六一生物科技有限公司;D-650型水平细胞超净工作台购自江苏常州如益科技有限公司;303-5B型二氧化碳培养箱购自上海尚仪生物科技有限公司。
1.2 主要药品与试剂
ST原料药(批号7431-77-8,纯度>98%)购自成都仪睿生物科技有限公司;EGFR激动剂NSC228155、PI3K/Akt激动剂SC79、EGFR抑制剂ZD1839和PI3K/Akt抑制剂LY294002(批号分别为HY-101084、HY- 18749、HY-50895、HY-10108,纯度均大于99%)均购自美国MCE公司;RPMI 1640培养基、胎牛血清(FBS)、0.25%胰蛋白酶[含乙二胺四乙酸(EDTA)]溶液均购自美国Gibco公司;CCK-8试剂盒(批号BS350A)购自上海白鲨生物科技有限公司;Transwell小室(批号30419069)购自美国Corning公司;Matrigel胶(批号2446ML005)购自德国Biofroxx公司;苯甲基磺酰氟(PMSF)、RIPA裂解液均购自福州飞净生物科技有限公司;十二烷基硫酸钠-聚丙烯酰胺电泳(SDS-PAGE)凝胶试剂盒、二喹啉甲酸(BCA)定量试剂盒(批号分别为MA0388-08F、MA0082-02C)均购自大连美仑生物技术有限公司;兔源EGFR、PI3K、磷酸化PI3K(p-PI3K)、Akt、磷酸化Akt(p-Akt)多克隆抗体(批号分别为25869、60225、10176、12789、22018)均购自武汉三鹰生物技术有限公司;兔源N-钙黏着蛋白(N-cadherin)多克隆抗体、鼠源E-钙黏着蛋白(E-cadherin)单克隆抗体、鼠源β-肌动蛋白(β-actin)单克隆抗体(批号分别为GB111009、GB12868、GB12001)均购自武汉塞维尔生物技术有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗、HRP标记的山羊抗鼠IgG二抗(批号分别为AS014、AS003)均购自武汉爱博泰克生物科技有限公司;5-乙炔基-2′脱氧尿嘧啶核苷(EDU)增殖检测试剂盒(批号C0088L)购自上海碧云天生物技术有限公司;ECL高敏曝光液(批号36222ES60)购自武汉聚能慧达生物科技有限公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 细胞
人皮肤鳞状细胞癌SCL-1细胞购自武汉普诺赛生物科技有限公司,人正常皮肤表皮纤维细胞WS1购自美国ATCC细胞库。
2 方法
2.1 细胞的培养
将SCL-1细胞和WS1细胞分别用含10%FBS的RPMI 1640培养基(后文简写为“完全培养基”)在37 ℃、5%CO2培养箱中进行培养,当细胞生长至融合度约90%时,用0.25%胰蛋白酶(含EDTA)溶液对其进行消化、传代,取对数生长期且状态良好的细胞用于后续实验(本研究所用的为传代6~10代的细胞)。
2.2 ST对SCL-1细胞增殖的影响
2.2.1 CCK-8实验 将SCL-1细胞用0.25%胰蛋白酶(含EDTA)溶液消化7 min后,以1 000 r/min离心5 min,吸弃上清液,收集细胞沉淀。将细胞沉淀用完全培养基重悬,制成密度均为4×103 mL-1的单细胞悬液,按每孔100 μL接种到96孔板中。将细胞分为空白对照组(含0.1%DMSO的完全培养基,下同)和ST不同浓度组(5、10、20 μmol/L,以完全培养基配制,药物浓度均根据前期预实验结果确定,下同),每组设置6个复孔;并另设不加细胞和药物的调零孔。将细胞置于37 ℃、5%CO2培养箱中培养过夜,待细胞充分贴壁后,每孔加入相应药液或完全培养基100 μL。培养24 h后,吸弃培养基,按每孔100 μL加入CCK-8溶液(将CCK-8溶液与RPMI 1640培养基按体积比1 ∶ 9混合);作用3 h后,采用多功能酶标仪在450 nm波长下测定各孔的光密度(OD)值并计算各组细胞的增殖率:增殖率(%)=(实验组OD值-调零孔OD值)/(空白对照组OD值-调零孔OD值)×100%。实验重复3次。去掉3次实验中的最大值和最小值,将其余所有数据均用于统计分析。
2.2.2 EDU染色实验 将SCL-1细胞用0.25%胰蛋白酶(含EDTA)溶液消化8 min后,以1 000 r/min離心5 min,吸弃上清液,收集细胞沉淀。将细胞沉淀用完全培养基重悬,制成密度为2×105 mL-1的细胞悬液。在6孔板中铺上无菌盖玻片,并按每孔200 μL加入细胞悬液。将细胞分为空白对照组(含0.1%DMSO的完全培养基)和ST不同浓度组(5、10、20 μmol/L),每组设置2个复孔。每组细胞中加入EDU溶液(按RPMI 1640培养基和EDU原液体积比1 000 ∶ 1稀释)1.9 mL和相应药液/完全培养基100 μL,于37 ℃、5%CO2培养箱中培养2.5 h,根据EDU增殖检测试剂盒说明书方法对其进行洗片、固定、染色、DAPI染核等操作。随后,在荧光显微镜下随机选取5个视野进行拍照,分别计数每视野下的阳性细胞数(即出现绿色荧光的细胞数),并计算阳性细胞率:每视野下的阳性细胞率(%)=每视野下阳性细胞数/总细胞数×100%,每组均取平均值作为检测结果。实验重复3次,数据处理同“2.2.1”项。
2.3 ST对SCL-1细胞迁移能力的影响
采用细胞划痕实验进行检测。按“2.2.2”项下方法对SCL-1细胞进行消化、离心和重悬。将细胞悬液按每孔1 mL接种至6孔板中,并按每孔1 mL加入完全培养基,吹打混匀后,将细胞分为空白对照组(含0.1%DMSO的完全培养基)和ST不同浓度组(5、10、20 μmol/L),每组设置3个复孔。将细胞置于37 ℃、5%CO2培养箱中培养过夜,待细胞融合度达95%以上时,用200 μL移液枪枪头在每孔细胞中划3条线。以磷酸盐缓冲液(PBS)洗涤2次后,分别加入RPMI 1640培养基1.9 mL和相应药液/完全培养基100 μL。在加药培养的0、24 h时,分别在倒置光学显微镜下随机选取5个视野对进行拍照,使用Image Pro Plus 6.0软件测量各孔划痕的面积并计算各组细胞的相对迁移率:相对迁移率(%)=(实验组培养0 h时的划痕面积-实验组培养24 h时的划痕面积)/(空白对照组培养0 h的划痕面积-空白对照组培养24 h时的划痕面积)×100%,每组均取平均值作为检测结果。实验重复3次,数据处理同“2.2.1”项。
2.4 ST对SCL-1细胞侵袭能力的影响
采用Transwell小室侵袭实验进行检测。将Matrigel胶和不含血清的培养基按体积比1 ∶ 8混匀,均匀铺在Transwell小室的上室,在37 ℃培养箱中将Matrigel烘干,弃掉多余的培养基。按“2.2.2”项下方法对SCL-1细胞进行消化、离心并收集细胞,然后将细胞用完全培养基重悬,制成密度为4×105 mL-1的细胞悬液。吸取上述细胞悬液100 μL到Transwell小室的上室,下室加入完全培养基700 μL。将细胞分为空白对照组(含0.1%DMSO的完全培养基)和ST不同浓度组(5、10、20 μmol/L),每组设置3个复孔。各组细胞均按每孔100 μL加入相应药液/完全培养基。将小室置于37 ℃、5%CO2培养箱中培养过夜后,再以4%多聚甲醛溶液固定20 min,PBS漂洗5 min×2次;用1%结晶紫试剂染色15 min,PBS漂洗5 min×2次。擦拭掉非侵袭细胞后将小室放入烘箱中烘干,然后在倒置光学显微镜下观察各孔侵袭的细胞,每个小室随机选择5个视野进行拍照后进行计数,取其平均值作为检测结果。实验重复3次,数据处理同“2.2.1”项。
2.5 ST对SCL-1细胞中EMT相关蛋白表达的影响
2.5.1 Western blot实验 将SCL-1细胞以0.25%胰蛋白酶(含EDTA)溶液消化7 min后,以1 000 r/min离心5 min,收集细胞沉淀。按“2.2.2”项下方法将细胞重悬,然后按每孔2 mL将细胞接种至6孔板中,将其分为空白对照组(含0.1%DMSO)和ST不同浓度组(5、10、20 μmol/L)。将细胞置于37 ℃、5%CO2培养箱中培养,待培养24 h细胞贴壁后,每孔加入相应药液/完全培养基2 mL,继续培养24 h;吸弃培养基,按每孔100 μL加入体积比1 ∶ 100的PMSF和RIPA裂解液的混合液,于冰上裂解15 min,然后在4 ℃下以12 000 r/min离心20 min,吸取蛋白上清液,并采用BCA蛋白定量法进行蛋白定量。取变性后的蛋白20 μg行10%SDS-PAGE(电压85 V,时间2 h),再以320 mA恒流2 h转至聚偏氟乙烯膜上。以5%脱脂牛奶室温封闭2 h后,分别加入E-cadherin、N-cadherin、β-actin一抗(稀释比例均为1 ∶ 1 000),4 ℃孵育过夜;TBST溶液漂洗15 min×3次,加入HRP标记的山羊抗兔IgG二抗、HRP标记的山羊抗鼠IgG二抗(稀释比例均为1 ∶ 2 000),室温孵育2 h;TBST溶液漂洗3次×15 min,加入ECL曝光液后,于凝胶成像仪中成像。以Image Lab 5.2.0软件测定目标条带的灰度值,以目标蛋白与内参蛋白(β-actin)的条带灰度值比值表示目标蛋白的表达水平。实验重复3次。
2.5.2 免疫荧光实验 按“2.2.2”项下方法对SCL-1细胞进行消化、离心和重悬,然后按每孔100 μL接种到预先放有盖玻片的6孔板中,并加入完全培养基2 mL,吹打混匀。将细胞置于37 ℃、5%CO2培养箱中培养24 h后,以PBS清洗细胞爬片5 min×3次,然后将细胞分为空白对照组(含0.1%DMSO的完全培养基)和ST不同浓度组(5、10、20 μmol/L),每组设置3个复孔,各组细胞均按每孔100 μL加入相应药液/完全培养基。将细胞再次置于37 ℃、5%CO2的培养箱中培养24 h,然后用PBS浸洗3 min×3次,用4%多聚甲醛溶液固定爬片15 min,以PBS浸洗5 min×3次,用0.3%TritonX-100试剂室温通透25 min,以PBS浸洗5 min×3次,将爬有细胞的盖玻片倒扣在载玻片上,在每个盖玻片上滴山羊血清室温封闭30 min后,吸掉多余封闭液,分别加入N-cadherin、E-cadherin一抗(稀释比例均为1 ∶ 100),4 ℃孵育过夜;PBS浸洗3 min×3次,避光加入HRP标记的山羊抗兔IgG二抗、HRP标记的山羊抗鼠IgG二抗(稀释比例均为1 ∶ 100),室温孵育1 h;以PBS浸洗3 min×3次,用DAPI复染核5 min;以PBS浸洗3 min×3次,吸水纸吸干多余液体,然后用含荧光猝灭剂的封片液封片。在荧光显微镜下观察并采集图像,用Image Pro Plus 6.0软件测定各组细胞每视野下的荧光强度并计算其相对荧光强度:相对荧光强度(%)=各实验组细胞每视野下平均荧光强度/空白对照组细胞每视野下平均荧光强度×100%。实验重复3次,数据处理同“2.2.1”项。
2.6 ST是否通过EGFR/PI3K/Akt信号通路影响SCL-1细胞生物学效应的研究
2.6.1 加入EGFR/PI3K/Akt信号通路激动剂后对ST生物学效应的影响 实验设置空白对照组(含0.1%DMSO的完全培养基)、ST组(20 μmol/L)、ST+NSC228155组[20 μmol/L ST+100 μmol/L NSC228155]和ST+SC79组[20 μmol/L ST+20 μmol/L SC79],分别按“2.2.1”“2.3”“2.4”项下方法进行细胞培养并检测SCL-1细胞的增殖、迁移和侵袭能力。每个实验均重复3次,数据处理同“2.1.1”项。
2.6.2 细胞中EGFR/PI3K/Akt通路相关蛋白的表达采用 Western blot法进行检测。按“2.7”项下方法对细胞进行分组、给药、电泳和转膜等操作。用5%脱脂牛奶室温封闭2 h后,分别加入EGFR、PI3K、p-PI3K、Akt、p-Akt、β-actin一抗(稀释比例均为1 ∶ 1 000),4 ℃孵育过夜;TBST溶液漂洗15 min×3次,加入HRP标记的山羊抗兔IgG二抗(稀释比例为1 ∶ 2 000),室温孵育2 h;TBST溶液漂洗15 min×3次,加入ECL曝光液后,于凝胶成像仪中成像。以Image Lab 5.2.0软件测定目标条带的灰度值,以目标蛋白与内参蛋白(EGFR以β-actin为内参,p-PI3K以PI3K为内参,p-Akt以Akt为内参)的条带灰度值比值表示目标蛋白的表达水平。实验重复3次。
2.7 ST的细胞毒性考察
分别将SCL-1、WS1细胞分为空白对照组(含0.1%DMSO的完全培养基)、ST组(20 μmol/L)、EGFR抑制剂ZD1839组(阳性对照,20 μmol/L)和 PI3K/Akt抑制剂LY294002组(阳性对照,20 μmol/L),按“2.2.1”项下方法检测细胞的增殖能力,并进行数据处理。实验重复3次。
2.8 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05表示差异具有统计学意义。
3 结果
3.1 ST對SCL-1细胞增殖的影响结果
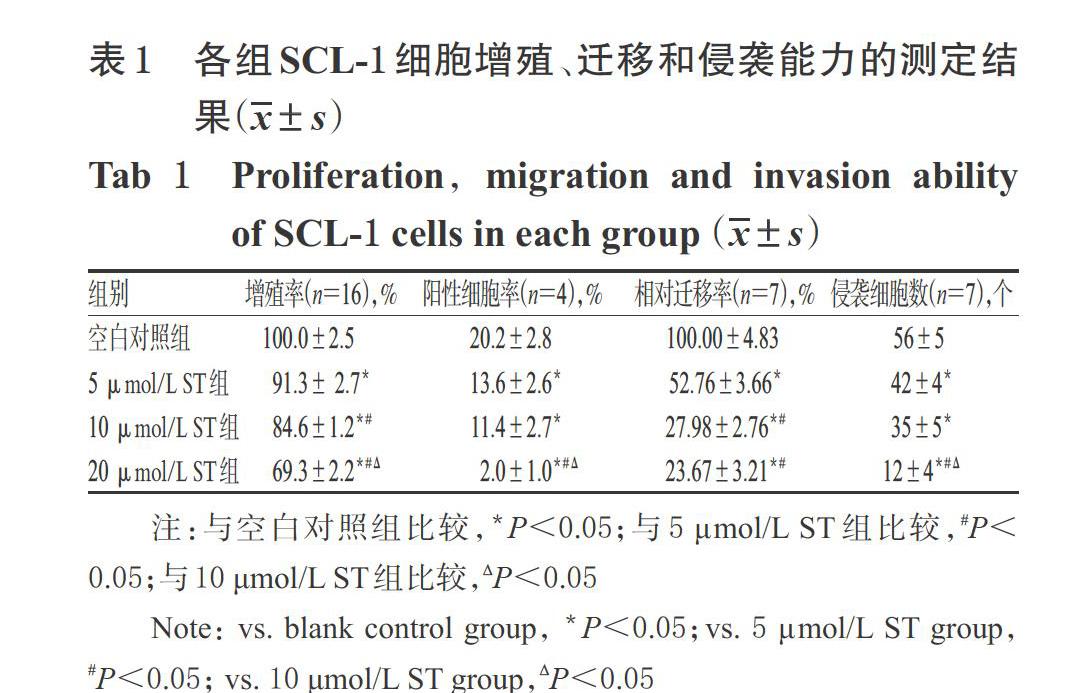
3.1.1 CCK-8实验结果 与空白对照组比较,5、10、20 μmol/L ST组细胞的增殖率均显著降低(P<0.05),且ST的作用具有明显的浓度依赖性(P<0.05)。各组SCL-1细胞增殖率的测定结果见表1。
3.1.2 EDU染色实验结果 与空白对照组比较,5、10、20 μmol/L ST组的细胞阳性率均显著降低(P<0.05),且ST的作用具有一定的浓度依赖性趋势,其中20 μmol/L ST组的细胞阳性率显著低于5、10 μmol/L ST组(P<0.05)。各组SCL-1细胞的EDU染色图见图1(图中,EDU表示阳性细胞,DAPI表示细胞核,Merge表示两者的荧光合并图),阳性细胞率的测定结果见表1。
3.2 ST对SCL-1细胞迁移的影响结果
与空白对照组比较,5、10、20 μmol/L ST组细胞的相对迁移率均显著降低(P<0.05),且ST的作用具有一定的浓度依赖性趋势,其中10、20 μmol/L ST组细胞的相对迁移率显著低于5 μmol/L ST组(P<0.05)。各组SCL-1细胞迁移能力观察的显微图见图2,相对迁移率的测定结果见表1。
3.3 ST对SCL-1细胞侵袭能力的影响结果
与空白对照组比较,5、10、20 μmol/L ST组的侵袭细胞数均显著减少(P<0.05),且ST的作用具有一定的浓度依赖性趋势,其中20 μmol/L ST组的侵袭细胞数显著少于5、10 μmol/L ST组(P<0.05)。各组细胞侵袭能力观察的显微图见图3,侵袭细胞数的测定结果见表1。
3.4 ST对SCL-1细胞EMT相关蛋白表达的影响结果
3.4.1 Western blot实验结果 与空白对照组比较,5、10、20 μmol/L ST组细胞中E-cadherin蛋白的表达水平显著升高(P<0.05),N-cadherin蛋白的表达水平显著降低(P<0.05),且ST的作用具有明显的浓度依赖性(P<0.05)。各组细胞中E-cadherin、N-cadherin蛋白表达的电泳图见图4,表达水平的测定结果见表2。
3.4.2 免疫荧光实验结果 与空白对照组比较,5、10、20 μmol/L ST组细胞中E-cadherin蛋白表达显著增加(P<0.05),N-cadherin蛋白表达显著减少(P<0.05),且ST的作用具有明显的浓度依赖性(P<0.05),该结果与Western blot实验结果相一致。各组细胞中E-cadherin、N-cadherin蛋白表达的免疫荧光图见图5(图中,E-cadherin、N-cadherin表示蛋白表达,DAPI表示细胞核,Merge表示两者的荧光合并图),表达水平的测定结果见表2。
3.5 ST是否通过EGFR/PI3K/Akt信号通路影响SCL-1细胞生物学效应的研究结果
3.5.1 加入EGFR/PI3K/Akt信号通路激动剂后对ST抑制SCL-1细胞增殖、迁移、侵袭能力的影响结果 与空白对照组比较,各药物组细胞的增殖率、相对迁移率和侵袭细胞数均显著降低(P<0.05)。与ST组比较,ST+NSC228155组和ST+ SC79组细胞的增殖率、相对迁移率和侵袭细胞数均显著升高(P<0.05),表明EGFR激动剂NSC228155和PI3K/Akt激动剂SC79均可逆转ST对SCL-1细胞增殖、迁移和侵袭能力的抑制作用,这提示ST可能是通过EGFR/PI3K/Akt信号通路而发挥其对SCL-1细胞的增殖、迁移和侵袭的抑制作用。加入EGFR/PI3K/Akt信号通路激动剂后对ST抑制SCL-1细胞迁移、侵袭能力影响的显微图见图6,增殖、迁移、侵袭能力影响的测定结果见表3。
3.5.2 ST对SCL-1细胞中EGFR/ PI3K/Akt信号通路相关蛋白表达的影响结果 与空白对照组比较,5、10、20 μmol/L ST组细胞中EGFR、p-PI3K、p-Akt蛋白的表达水平均显著降低(P<0.05),且具有明显的浓度依赖性(P<0.05)。各组细胞中EGFR、p-PI3K、p-Akt蛋白表达的电泳图见图7,表达水平的测定结果见表4。
3.6 ST的细胞毒性考察结果
与空白对照组比较,ST组WS1细胞的增殖率差异无统计学意义(P>0.05),且SCL-1细胞的增殖率显著降低(P<0.05);而ZD1839组、LY294002组WS1、SCL-1细胞的增殖率均显著降低(P<0.05)。与ST组比较,ZD1839组、LY294002组WS1细胞的增殖率均显著降低(P<0.05),而SCL-1细胞的增殖率差异无统计学意义(P>0.05)。以上结果提示,在等浓度下,ST的细胞毒性较阳性药EGFR抑制剂ZD1839和PI3K/Akt抑制剂LY294002小,说明ST是一种药效明显且较为安全的药物。各药物对WS1细胞和SCL-1细胞增殖影响的测定结果见表5。
4 讨论
当前,皮肤鳞状细胞癌的治疗方法主要是手术、放化疗结合等[1-2]。然而,患者術后的复发率较高,且存在较多的并发症[13]。中药在皮肤鳞状细胞癌中晚期甚至是术后恢复不良患者的治疗中发挥着重要作用,其具有毒副作用小等优势,能够适当地延长患者的生存期等[14]。本研究通过CCK-8实验、EDU染色实验、细胞划痕实验验和Transwell小室侵袭实验发现,使用5、10、20 μmol/L的ST处理后,SCL-1细胞的增殖、迁移和侵袭能力均显著减弱,且其作用具有一定的浓度依赖性趋势。EMT过程中常见的标志物改变有上皮性蛋白(如E-cadherin、紧密连接蛋白、细胞角蛋白)表达下调,间质性蛋白(如N-cadherin、纤维连接蛋白、波形蛋白)表达上调[15]。本研究通过Western blot实验及免疫荧光实验发现,ST能够显著上调SCL-1细胞中EMT相关蛋白E-cadherin的表达,并下调N-cadherin蛋白的表达,且其作用具有一定的浓度依赖性趋势。
相关临床研究显示,2例患有慢性粒细胞白血病且同时患有皮肤鳞状细胞癌的患者在使用EGFR抑制剂伊马替尼治疗后疾病得到了缓解,提示EGFR可能与皮肤鳞状细胞癌的发生与发展密切相关[16]。本研究通过Western blot实验发现,ST能够抑制SCL-1细胞中EGFR蛋白的表达。EGFR信号通路可影响PI3K/Akt等多种下游效应分子的活化,由EGFR介导的p-PI3K(PI3K的活化形式)及其下游分子p-Akt(Akt的活化形式)增多能够显著促进皮肤鳞状细胞癌的多种恶性生物学行为(如异常增殖、EMT以及远处转移等)[17-18]。本研究结果显示,ST还能够显著抑制SCL-1细胞中p-PI3K、p-Akt的表达。
为进一步探讨ST对SCL-1细胞恶性生物行为学的抑制是否是通过EGFR/PI3K/Akt信号通路来介导的,本课题组以认可度高的EGFR激动剂NSC228155和PI3K/Akt激动剂SC79为研究工具[19],通过CCK-8实验、细胞划痕实验和Transwell小室侵袭实验发现,NSC228155、SC79均能够减弱ST对SCL-1细胞增殖、迁移和侵袭能力的抑制作用。此外,与最为经典的EGFR通路抑制剂ZD1839和PI3K/Akt通路抑制剂LY294002相比[15],ST对SCL-1细胞增殖的抑制作用没有差异,但其对正常WS1细胞的毒副作用明显要小。
综上所述,ST对人皮肤鳞状细胞癌SCL-1细胞的增殖、EMT和转移均有明显的抑制作用,且其对正常WS1细胞的毒副作用较小;ST抑制细胞增殖和转移的作用可能是与抑制EGFR/PI3K/Akt信号通路的活化有关,但其具体的作用机制还需进一步深入研究。
参考文献
[ 1 ] WALDMAN A,SCHMULTS C. Cutaneous squamous cell carcinoma[J]. Hematol Oncol Clin North Am,2019,33(1):1-12.
[ 2 ] QUE S,ZWALD F O,SCHMULTS C D. Cutaneous squamous cell carcinoma:incidence,risk factors,diagnosis,and staging[J]. J Am Acad Dermatol,2018,78(2):237- 247.
[ 3 ] 杨惠铃,李继功,温宁.上皮间质转化参与口腔鳞状细胞癌侵袭转移机制的研究进展[J].中华口腔医学杂志,2015,11(13):352-359.
[ 4 ] 刘海霞,陈必良,李佳,等. EMT参与肿瘤侵袭转移的研究进展[J].现代生物医学进展,2014,14(14):2790-2793.
[ 5 ] 庞翠,张菊,刘文超,等. EMT研究进展[J].现代肿瘤医学,2016,24(15):2484-2487.
[ 6 ] SABBAH D A,HAJJO R,SWEIDAN K. Review on epidermal growth factor receptor(EGFR)structure,signaling pathways,interactions,and recent updates of EGFR inhibitors[J]. Curr Top Med Chem,2020,20(10):815-834.
[ 7 ] MEI X L,ZHONG S. Long noncoding RNA LINC00520 prevents the progression of cutaneous squamous cell carcinoma through the inactivation of the PI3K/Akt signa- ling pathway by downregulating EGFR[J]. Chin Med J(Engl),2019,132(4):454-465.
[ 8 ] LEE M S,JEONG M,LEE H,et al. PI3K/Akt activation induces PTEN ubiquitination and destabilization accele- rating tumourigenesis[J]. Nat Commun,2015,143(4):444- 455.
[ 9 ] CHEN S,JIN Y,ZHU Z,et al. In vivo study on site of action of sinapine thiocyanate following acupoint herbal patching[J]. Evid Based Complement Alternat Med,2019,14(23):175-179.
[10] LI Y,ZHANG X,YANG W,et al. Mechanism of the protective effects of the combined treatment with rhynchophylla total alkaloids and sinapine thiocyanate against a prothrombotic state caused by vascular endothelial cell inflammatory damage[J]. Exp Ther Med,2017,13(6):3081- 3088.
[11] 黃涵柽,张祝,张希洲,等.芥子碱硫氰酸盐抑制IR小鼠血脂血糖升高、动脉粥样硬化及肝细胞脂肪变性[J].中国病理生理杂志,2018,34(1):1-8.
[12] 陈腾祥,王婧雅,曾智锐,等.芥子碱硫氰酸盐对肝癌细胞SMMC-7721增殖、迁移和侵袭的影响及机制[J].中国药理学通报,2020,6(12):1731-1738.
[13] VASILIKI A P,STEVEN J,et al. Phase Ⅰ study of vandetanib with radiation therapy with or without cisplatin in locally advanced head and neck squamous cell carcinoma[J].Head Neck,2016,38(3):439-447.
[14] ASLAM A M,PATEL A N. Facial cutaneous squamous cell carcinoma[J]. BMJ,2016,352(1):1513-1517.
[15] SINGH D,ATTRI B,GILL R,et al. Review on EGFR inhibitors:critical updates[J]. Mini Rev Med Chem,2016,16(14):1134-1166.
[16] BASKAYNA G,KREUZER K,SCHWARZ M,et al. Squamous cutaneous epithelial cell carcinoma in two CML patients with progressive disease under imatinib treatment[J]. Eur J Haematol,2003,70(4):231-234.
[17] URIBE P,GONZALEZ S. Epidermal growth factor receptor(EGFR)and squamous cell carcinoma of the skin:molecular bases for EGFR-targeted therapy[J]. Pathol Res Pract,2011,207(6):337-342.
[18] 薛迪,刘宇超,贾永明,等.基于PI3K/Akt/GSK3信号通路的芥子酸抗Aβ1-42致PC12细胞损伤的机制研究[J].中国药房,2020,31(20):519-523.
[19] 赵思婷,王洋洋,陈玉甜,等. PI3K-Akt激动剂对INS-1细胞的作用及机制研究[J].国际医药卫生导报,2019,13(17):223-229.
(收稿日期:2020-10-13 修回日期:2021-02-01)
(编辑:林 静)

