miR-200b靶向MAP2对缺氧缺糖诱导的大鼠皮质神经细胞损伤的影响
王宏宇 董俊兴 陈阵仁 任皓楠
1 材料与方法
1.1 材料
1.1.1 动物
新生24 h 内,质量约为(5.5±0.5)g 的SD 大鼠(批号:061012),雌雄兼用。
1.1.2 试剂
胎牛血清(FBS)、马血清和DEME/F12K 培养基、B27 无血清添加剂购自美国Gibco 公司;连二亚硫酸钠、胰蛋白酶、阿糖胞苷购自Sigma-Aldrich 公司;双荧光素酶报告系统(Dual-Luciferase Reporter Assay System)购自美国Promega 公司;Total RNA提取试剂盒、Real-time PCR 试剂盒、反转录试剂盒(RT-PCR)和Lipofectamine 2000 转染试剂盒购自宝生物工程(大连)有限公司;引物、miR-200b mimics(miR-200b)、抑制剂(anti-miR-200b)、对照物(miR-NC、anti-miR-NC)及MAP2 野生型(WT-MAP2)和突变型(MUT-MAP2)报告载体购自上海吉玛制药有限公司;MAP2 抗体、calpain1 抗体、pro-caspase3抗体、cl-caspase3 抗体和GAPDH 抗体购自美国Santa 公司;CCK8 试剂盒、细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;流式细胞仪购自BD 公司,Real-time PCR 仪购自美国Bio-Rad 公司。
1.2 方法
1.2.1 大鼠皮质神经细胞的分离培养[5]
根据文献[5]的方法,取大鼠大脑皮质组织,剪碎后用0.25%的胰蛋白酶消化,离心沉淀细胞,然后用含15%马血清及1%B27 的DEME/F12K 培养基悬浮细胞,培养液中添加100 U/mL 青霉素-100 μg/mL 链霉素,置于37℃5% CO2培养箱中培养,48 h 后加入终浓度为10 μmol/L 阿糖胞苷抑制胶质细胞生长,待神经细胞生长至7 天时,用特异性烯醇化酶(NSE)免疫细胞化学染色进行鉴定,显微镜下观察,当大部分细胞被染为棕黄色时表明分离成功,此时状态的细胞用于后续实验。
1.2.2 细胞缺氧模型构建[6]
取培养7 d 的神经细胞,吸去原来的培养基,用无糖Earle's 液清洗2 遍,然后换成换含0.5 mmol/L 连二亚硫酸钠的无糖Earle's 液继续培养48 h,即为缺氧模型组;其中常规培养48 h 的细胞作为对照组。
在玉米种植的过程中,首先要选择合适的种植区域,保证土壤环境,耕层深厚,土地肥沃,具有良好的保水保肥和排水的能力。另外在选茬的过程中,还可以选择大豆、马铃薯与玉米地进行轮换,提高土壤的肥力和活性。要采取伏秋整地的方法,保证对土壤进行深层翻动,并且要及时起垄,保证垄距在130cm至140cm左右通过隔一垄破一垄改成大垄的方式,符合玉米大垄双行密植高产栽培技术的要求。另外要积极推行轮番耕作制度,尤其是在3-4年轮作周期中,能够保证土壤的肥力。
1.2.3 细胞转染和Real-time PCR检测RNA的表达
取对数生长期模型组细胞,根据Lipo-fectamine 2000 转染试剂盒说明书进行操作,将各组载体(anti-miR-NC、anti-miR-200b、miR-NC、miR-200b)转染入缺氧模型组大鼠皮质神经细胞中,分别作为miR-NC 组、miR-200b 组、anti-miR-NC 组、anti-miR-200b 组。
转染48 h 后,收集细胞,提取细胞总RNA,反转录合成cDNA,以cDNA 为模板按照Real-time PCR 试剂盒的说明书进行反应,合成miR-200b、calpain1mRNA 和MAP2mRNA。用2-ΔΔCt方法进行含量数据分析。
1.2.4 细胞凋亡率及细胞存活率测定
收集各组大鼠皮质神经细胞,接种培养细胞,PBS 缓冲液洗涤2 次,按照凋亡试剂盒及CCK8 的试剂盒说明书操作,检测并计算细胞凋亡率及存活率。
1.2.5 双荧光素酶报告系统实验
使用PCR 扩增包含miR-200b 结合位点的MAP2 序列片段,并克隆至荧光素酶表达载体中,获得MAP2 野生型载体(WT-MAP2),将MAP2 序列ACAGUAUUA 突变为AACCAGAAC,获得MAP2 突变型载体(MUT-MAP2),将WT-MAP2 和MUT-MAP2 双荧光素酶报告载体分别与miR-NC或miR-200b 用Lipofectamine 2000 脂质体共转染至培养好的大鼠皮质神经细胞。根据说明书,检测细胞相对萤火虫荧光素酶活性。
1.2.6 Western blot 检测MAP2 和凋亡相关蛋白
收集各组大鼠皮质神经细胞,破碎细胞,收集蛋白进行SDS-PAGE,然后转PVDF 膜,5%脱脂奶粉室温封闭2 h,加入一抗(MAP2 抗体1∶1 000,calpain1 抗体1∶1 000,pro-caspase3 抗体1∶1 000,cl-caspase3 抗体1∶2 000 和GAPDH 抗体1∶3 000),4℃过夜孵育,TBST 洗膜3 次,加入稀释的酶标二抗室温孵育2 h,以GAPDH 为内参照,分析蛋白水平。
1.3 统计学处理
采用SPSS 19.0 软件进行数据分析,计数资料以()表示;两组间比较用t检验,多组间的比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 缺氧缺糖损伤模型的建立及miR-200b、cal-pain1 和MAP2 的表达
与对照组相比,缺氧缺糖模型组大鼠皮质神经元细胞中miR-200b 和calpain1mRNA 水平均升高(P<0.05),MAP2mRNA 水平降低(P<0.05),细胞存活率降低(P<0.05),细胞凋亡率显著升高,差异有统计学意义(P<0.05)。见表1。
表1 缺氧缺糖对大鼠皮质神经元细胞及miR-200b、calpain1 和MAP2 表达的影响(±s,n=9)Table 1 Effects of hypoxia and glucose deficiency on the expression of miR-200b,calpain 1 and MAP2 in rat cortical neurons(±s,n=9)
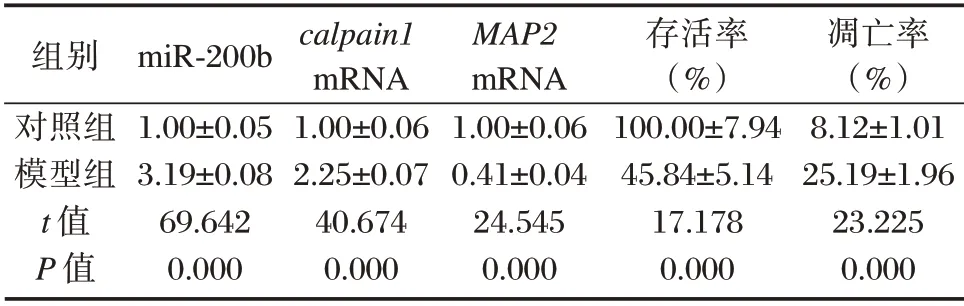
表1 缺氧缺糖对大鼠皮质神经元细胞及miR-200b、calpain1 和MAP2 表达的影响(±s,n=9)Table 1 Effects of hypoxia and glucose deficiency on the expression of miR-200b,calpain 1 and MAP2 in rat cortical neurons(±s,n=9)
组别对照组模型组t 值P 值miR-200b 1.00±0.05 3.19±0.08 69.642 0.000 calpain1 mRNA 1.00±0.06 2.25±0.07 40.674 0.000 MAP2 mRNA 1.00±0.06 0.41±0.04 24.545 0.000存活率(%)100.00±7.94 45.84±5.14 17.178 0.000凋亡率(%)8.12±1.01 25.19±1.96 23.225 0.000
2.2 抑制miR-200b 对缺氧缺糖诱导的大鼠皮质神经细胞的影响
转染anti-miR-200b 抑制miR-200b,结果发现,与anti-miR-NC 组相比,anti-miR-200b 组大鼠皮质神经元细胞中miR-200b 含量降低,差异有统计学意义(P<0.05),细胞存活率升高,凋亡率降低,pro-caspase3 含量升高,cl-caspase3 蛋白含量降低,差异有统计学意义(P<0.05)。见图1、表2。
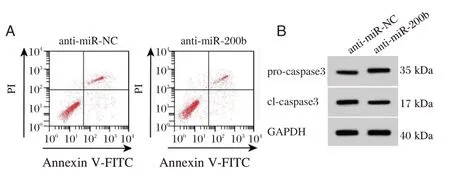
图1 抑制miR-200b 对缺氧缺糖诱导的大鼠皮质神经细胞凋亡及caspase3 蛋白表达的影响Figure 1 Effects of miR-200b inhibition on apoptosis and expression of caspase3 proteins in rat cortical neurons induced by hypoxia and glucose deprivation
表2 抑制miR-200b 对缺氧缺糖诱导的大鼠皮质神经细胞的影响(±s)Table 2 Effect of miR-200b inhibition on rat cortical neurons induced by hypoxia and glucose deficiency(±s)
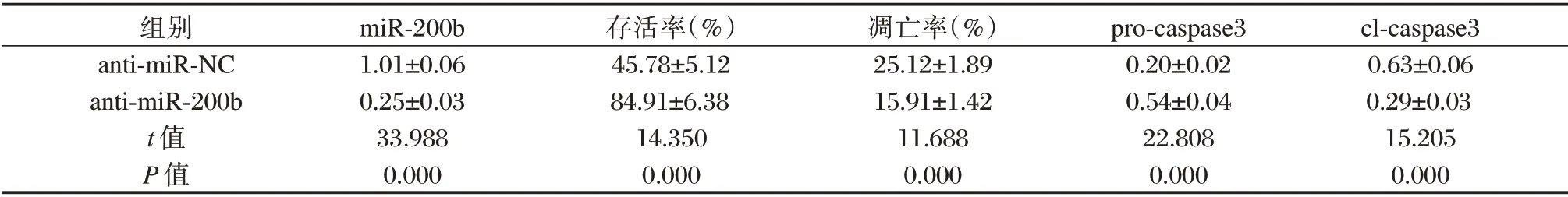
表2 抑制miR-200b 对缺氧缺糖诱导的大鼠皮质神经细胞的影响(±s)Table 2 Effect of miR-200b inhibition on rat cortical neurons induced by hypoxia and glucose deficiency(±s)
组别anti-miR-NC anti-miR-200b t 值P 值miR-200b 1.01±0.06 0.25±0.03 33.988 0.000存活率(%)45.78±5.12 84.91±6.38 14.350 0.000凋亡率(%)25.12±1.89 15.91±1.42 11.688 0.000 pro-caspase3 0.20±0.02 0.54±0.04 22.808 0.000 cl-caspase3 0.63±0.06 0.29±0.03 15.205 0.000
2.3 过表达miR-200b 对缺氧缺糖诱导的大鼠皮质神经细胞的影响
与miR-NC 组相比,miR-200b 组细胞中miR-200b 含量、细胞凋亡率和cl-caspase3 含量升高,细胞存活率和pro-caspase3 蛋白含量降低,差异有统计学意义(P<0.05)。见图2、表3。
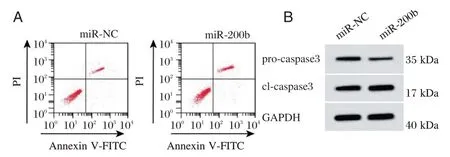
图2 过表达miR-200b 对缺氧缺糖诱导的大鼠皮质神经细胞凋亡的影响Figure 2 Effects of miR-200b over-expression on apoptosis and expression of caspase3 proteins in rat cortical neurons induced by hypoxia and glucose deprivation
表3 过表达miR-200b 对缺氧缺糖诱导的大鼠皮质神经细胞的影响(±s,n=9)Table 3 Effect of over-expression of miR-200b on the hypoxic injury of rat cortical neurons(±s,n=9)
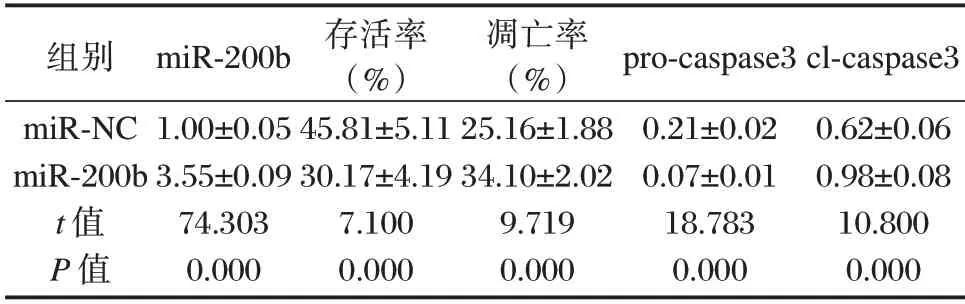
表3 过表达miR-200b 对缺氧缺糖诱导的大鼠皮质神经细胞的影响(±s,n=9)Table 3 Effect of over-expression of miR-200b on the hypoxic injury of rat cortical neurons(±s,n=9)
组别miR-NC miR-200b t 值P 值miR-200b 1.00±0.05 3.55±0.09 74.303 0.000存活率(%)45.81±5.11 30.17±4.19 7.100 0.000凋亡率(%)25.16±1.88 34.10±2.02 9.719 0.000 pro-caspase3 0.21±0.02 0.07±0.01 18.783 0.000 cl-caspase3 0.62±0.06 0.98±0.08 10.800 0.000
2.4 抑制、过表达miR-200b 对缺氧缺糖诱导的大鼠皮质神经细胞中calpain1 和MAP2 表达的影响
与anti-miR-NC 组相比,anti-miR-200b 组细胞中,calpain1mRNA 和蛋白含量均降低,MAP2mRNA 和蛋白含量均升高,差异有统计学意义(P<0.05);与miR-NC 组相比,miR-200b 组细胞中cal-pain1mRNA 和蛋白含量均升高,MAP2mRNA 和蛋白含量均降低,差异有统计学意义(P<0.05)。见表4。
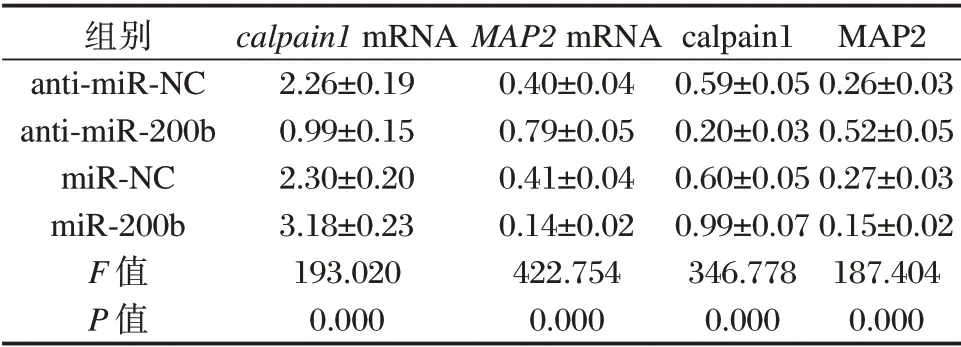
表4 calpain1 和MAP2 的表达Table 4 Expression of calpain1 and MAP2
2.5 miR-200b 靶向MAP2
MAP2 的3’UTR 序列中含有与miR-200b 互补的序列,见图3。双荧光素酶报告系统结果如表5所示,过表达miR-200b 组野生型WT-MAP2 的萤火虫荧光素酶相对活性显著下降,差异有统计学意义(P<0.05);而突变型MUT-MAP2 的荧光素酶相对活性比较差异无统计学意义(P>0.05)。见表5。
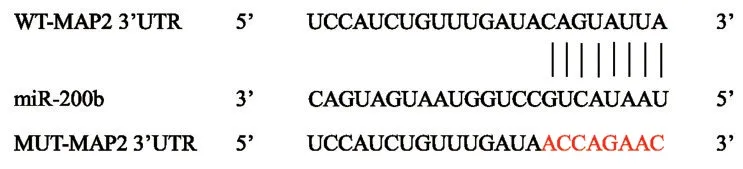
图3 MAP2 的3’UTR 中含有与miR-200b 互补核苷酸序列Figrue 3 The sequence of MAP2 3’UTR contains complementary nucleotide sequences with miR-200b
表5 双荧光素酶报告实验(±s,n=9)Table 5 Dual luciferase reporter assay(±s,n=9)
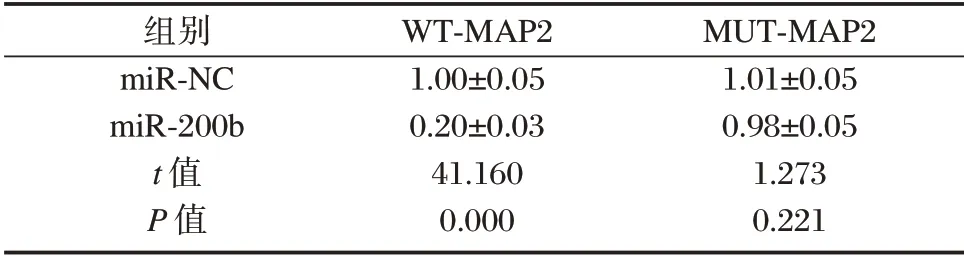
表5 双荧光素酶报告实验(±s,n=9)Table 5 Dual luciferase reporter assay(±s,n=9)
组别miR-NC miR-200b t 值P 值WT-MAP2 1.00±0.05 0.20±0.03 41.160 0.000 MUT-MAP2 1.01±0.05 0.98±0.05 1.273 0.221
3 讨论
miRNA 在多种缺氧相关疾病中表达出现异常,参与疾病细胞的炎症、细胞存活、分化和凋亡等过程[7]。神经元的凋亡时脑缺氧缺血的主要标志,报道表明,miR-200b 与缺氧诱导的损伤密切相关,miR-200b 与miR-200 家族的miR-429 及miR-200a 在化学缺氧诱导剂氯化钴处理分化的嗜铬细胞瘤(PC12)细胞12h 后含量显著降低,miR-200b过表达抑制了Notch1 信号通路,并抑制了氯化钴诱导的PC12 细胞凋亡[8]。研究表明,在高压氧联合神经脂苷钠治疗仔鼠脑缺氧缺血损伤中,miR-200b 抑制剂对疗效具有协同作用,miR-200b 激动剂对疗效具有抑制作用[9]。miR-200b-3p 在缺氧缺血处理后早期大鼠脑内表达上调,抑制miR-200b-3p可靶向Slit2 减轻新生大鼠缺氧缺血性脑损伤[3]。本研究结果说明miR-200b 可减轻缺氧缺糖诱导的神经细胞损伤。但其作用机制尚不清楚。
本研究通过TargetScan 预测发现,MAP2 与miR-200b 可能存在靶向关系,miR-200b 可能通过靶向MAP2 参与调控缺氧缺糖诱导的神经细胞损伤。MAP2 又称微管相关蛋白蛋白2(microtubule-associated protein 2),主要存在于神经元中,在构成细胞骨架、神经元塑形等功能中发挥作用,其缺失导致神经功能障碍[10],也是神经元损伤的评价指标之一[11]。研究表明,MAP-2 在大鼠神经细胞缺氧缺糖(OGD)损伤后1 h 表达降低,伤后12 h 达低谷,24 h 表达升高[12]。MAP-2 是钙蛋白酶-1(cal-pain1)的特异性底物,calpain1 参与突触可塑性和神经元变性,通常具有神经保护作用[13]。在大鼠海绵神经元缺氧模型中,缺氧3 h 后,MAP2 因水解含量降低,calpain1 水平增加,细胞骨架发生破坏[14]。MAP2 和calpain1 在神经细胞缺氧损伤中均发生变化。本研究结果说明miR-200b 负调控MAP2 的表达。本研究通过双荧光素酶报告系统发现,miR-200b 可靶向结合MAP2。综合结果表明,miR-200b 靶向负调控MAP2 的表达。
综上,在大鼠皮质神经细胞缺氧缺糖模型中,miR-200b 靶向MAP2 调控大鼠皮质神经细胞存活和凋亡。miR-200b 和MAP2 可能是脑缺氧损伤的分子靶点。

