PCT、乳酸清除率及CRP与食管癌术后肺炎并ARDS预后关系
黄英明 邹龙涛 袁小锦 江雯妍 黎坚向 何伊里 谢显龙
手术后肺炎是指术后肺通气不足,膈肌活动差,咳嗽反射受损或抑制,支气管痉挛和脱水,引起支气管分泌物滞留而导致的肺段不张[1]。食管癌术后肺炎严重者可并发急性呼吸窘迫综合征(Acute Respiratory Distress Syndrome,ARDS),严重威胁其生命安全[2]。及时评估食管癌术后肺炎合并ARDS 患者病情发展情况,对改善患者预后有重要意义。降钙素原(Procalcitonin,PCT)在危重感染病情评估具有重要意义,已成为公认的诊断感染性休克的有效生物学标志物[3]。乳酸是细胞发生无氧代谢时的产物,被作为判断危重症患者无氧代谢和组织灌注的敏感指标[4]。本研究就PCT、乳酸清除率及C 反应蛋白(C-reactive pro-tein,CRP)对食管癌术后肺炎合并ARDS 患者预后的预测进行研究,现报道如下。
1 一般资料
1.1 资料与方法
选取2015年1月至2019年8月本院接收的694例食管癌术后患者临床资料,纳入标准:①满足食管癌诊断标准[5],年龄在18 岁以上;②临床资料完整者;排除标准:①入组前3月内有抗生素、糖皮质激素、免疫抑制剂等药物使用史者;②合并慢性阻塞性肺疾病、肺结核等肺部疾患者;③合并除食管癌以外的恶性肿瘤疾病者。根据纳入排除标准,最终纳入689 例,男457 例,女232 例;平均年龄(52.36±4.97)岁。根据肺炎诊断标准[6]分为A 组(发生肺炎者n=200)和B 组(未发生肺炎者,n=489)。A 组中合并ARDS 者86 例(A1 组),未合并ARDS 者114 例(A2组)。根据病历资料中的生存及死亡情况,将A1 组分为死亡组(n=34)和生存组(n=52)。选取680 例同期于本院接受健康体检结果正常者且临床资料完整者作为C 组,其中男360 例,女320 例;平均年龄(53.41±5.01)岁。A、B 及C 组间一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 检测方法
1.2.1 PCT、CRP 检测
收集所有研究对象入组后清晨空腹血5 mL,离心(3 500 r/min,5 min,r=8 cm)后取分离血清,置于罗氏E411 全自动电化学发光分析仪中检测PCT 水平。通过酶联免疫吸附法(Enzyme Linked Immune Sorbent Assay,ELISA)法测定各组CRP浓度,由北京美康生物技术研究中心有限责任公司提供检测所用的试剂,根据ELISA 试剂盒说明书步骤操作。正常值范围:PCT≤0.05 ng/mL、CRP:0.068~8.2 mg/L[7]。
1.2.2 早期乳酸清除率检测
所有受试者分别于入组时及入组24 h 时,采用GEM Premier 3000 仪器检测动脉血乳酸水平,并计算24 h 乳酸清除率,24 h 乳酸清除率=(初始血乳酸值-24 h 后血乳酸值)/初始血乳酸值×100%[8]。以24 h 乳酸清除率为10%为界限,清除率≥10%为高清除率,清除率<10 为低清除率[9]。
1.3 统计学方法
采用SPSS 18.0 软件进行统计分析,计数资料以n(%)表示,采用χ2检验,计量资料以()表示,组间比较行t检验,多组间比较行F检验;采用多元Logistic 回归分析影响分析影响食管癌术后肺炎合并ARDS 患者预后的独立危险因素,以P<0.05 为差异有统计学意义。
2 结果
2.1 A、B 及C 组间PCT、乳酸清除率及CRP 水平比较
三组PCT、CRP 水平比较:A 组>B 组>C 组,24 h 乳酸清除率比较:A 组
表1 A、B、C 组间PCT、乳酸清除率及CRP 水平比较(±s)Table 1 comparison of PCT,lactate clearance rate and CRP levels among A,B,C group(±s)
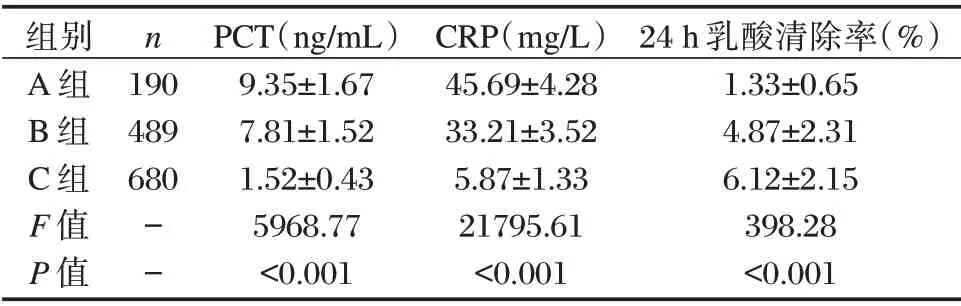
表1 A、B、C 组间PCT、乳酸清除率及CRP 水平比较(±s)Table 1 comparison of PCT,lactate clearance rate and CRP levels among A,B,C group(±s)
组别A 组B 组C 组F 值P 值n 190 489 680--PCT(ng/mL)9.35±1.67 7.81±1.52 1.52±0.43 5968.77<0.001 CRP(mg/L)45.69±4.28 33.21±3.52 5.87±1.33 21795.61<0.001 24 h 乳酸清除率(%)1.33±0.65 4.87±2.31 6.12±2.15 398.28<0.001
2.2 A1、A2组PCT、乳酸清除率及CRP水平比较
A1 组PCT 及CRP 水平比高于A2 组,24 h 乳酸清除率低于A2 组,差异均有统计学意义(P<0.05)。见表2。
表2 A1、A2组PCT、乳酸清除率及CRP水平比较(±s)Table 2 Comparison of PCT,lactate clearance rate and CRP levels between A1,A2 group(±s)
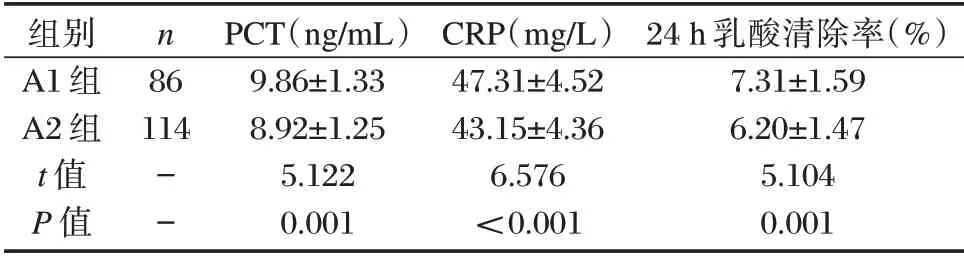
表2 A1、A2组PCT、乳酸清除率及CRP水平比较(±s)Table 2 Comparison of PCT,lactate clearance rate and CRP levels between A1,A2 group(±s)
组别A1 组A2 组t 值P 值n 86 114--PCT(ng/mL)9.86±1.33 8.92±1.25 5.122 0.001 CRP(mg/L)47.31±4.52 43.15±4.36 6.576<0.001 24 h 乳酸清除率(%)7.31±1.59 6.20±1.47 5.104 0.001
2.3 影响分析影响食管癌术后肺炎合并ARDS 患者预后的单因素分析
生存组呼吸≥30 次/min、心率≥100 次/min、氧合指数<150 mmHg、呼吸困难病程≥12 h、合并多器官功能障碍综合征者及开放式手术者较死亡组少,PCT、CRP 较死亡组低,24 h 乳酸清除率较死亡组高,差异均有统计学意义(P<0.05)。见表3。
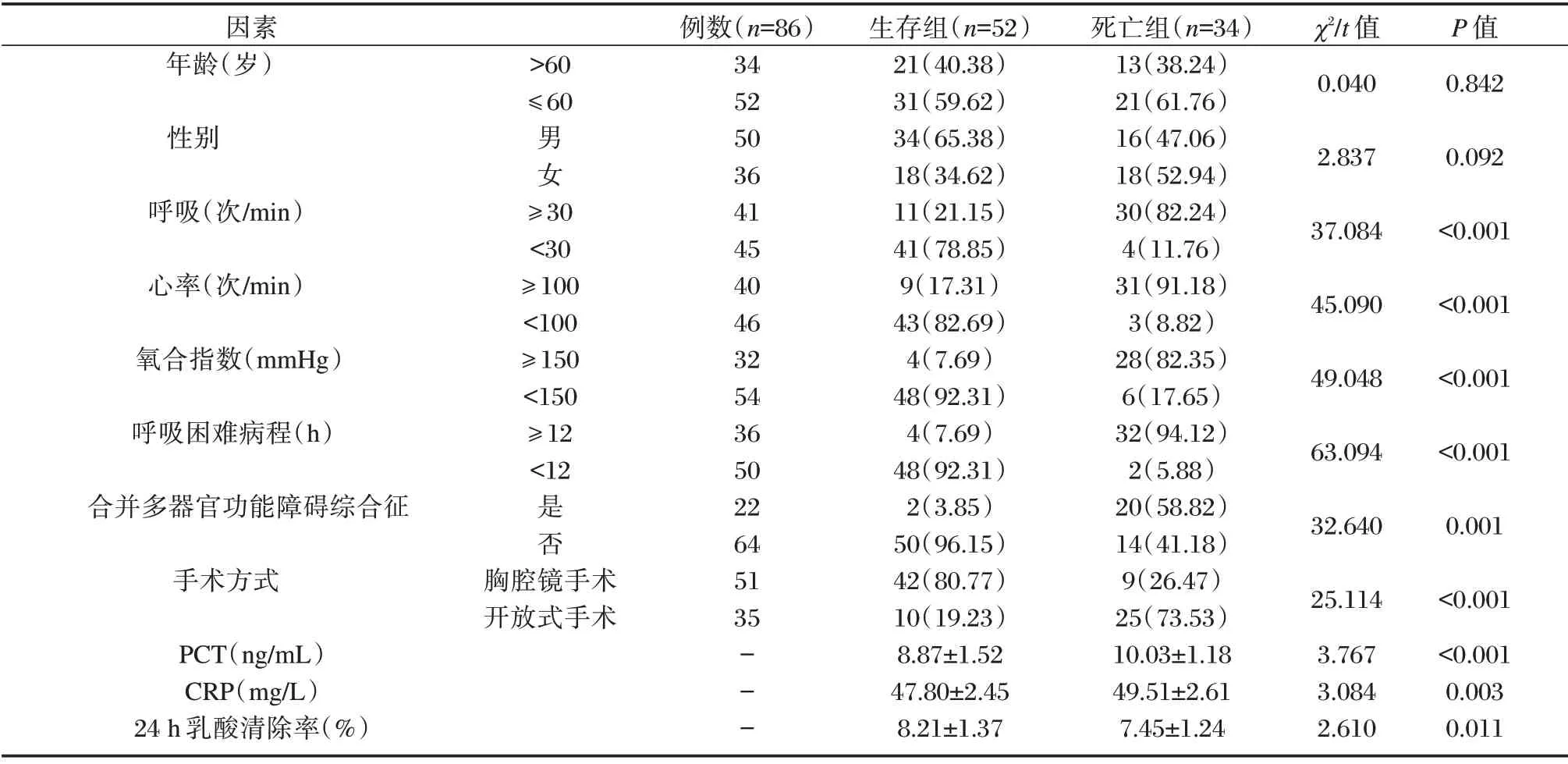
表3 影响分析影响食管癌术后肺炎合并ARDS 患者预后的单因素分析Table 3 single factor analysis of influencing factors on prognosis of patients with pneumonia and ARDS after esophageal cancer surgery
2.4 影响分析影响食管癌术后肺炎合并ARDS 患者预后的多因素分析
氧合指数(<150)、呼吸困难病程(≥12 h)、合并多器官功能障碍综合征、手术方式(开放式手术)、PCT(异常)、CRP(异常)及24 h 乳酸清除率(低)为影响食管癌术后肺炎合并ARDS 患者预后的独立危险因素(P<0.05)。见表4。
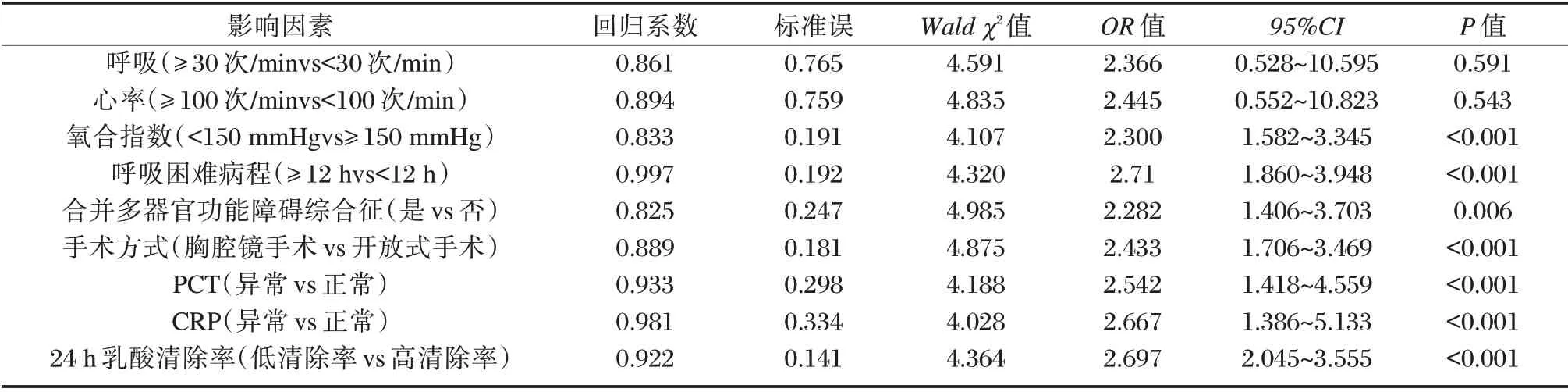
表4 影响分析影响食管癌术后肺炎合并ARDS 患者预后的多因素分析Table 4 multivariate analysis of prognostic factors in patients with pneumonia and ARDS after esophageal cancer surgery
3 讨论
研究显示,食管癌术后肺炎合并ARDS 患者的预后相对较差,且此种情况具有较高的致死率[10],因此对此类患者进行预后状态及其高危因素的研究是改善预后的必要基础与前提。
既往文献提出,患者一般状况、手术创伤、围术期管理及术后并发症等均可诱发食管癌术后肺炎合并ARDS 的发生,并影响患者预后[11]。本研究结果显示:PCT(异常)、CRP(异常)及24 h 乳酸清除率(低)、氧合指数(<150)、呼吸困难病程(≥12 h)、合并多器官功能障碍综合征、手术方式(开放式手术)是影响食管癌术后肺炎合并ARDS 患者预后生存的独立危险因素。
促炎因子和抑炎因子的失衡在ARDS 发生、发展过程中至关重要,在ARDS 发生、发展过程中可合并CRP、白细胞介素-6、白细胞介素-8、肿瘤坏死因子-α 等细胞因子浓度急剧升高,进而放大炎性发炎,引发瀑布式级联反应,加重病情进展。PCT 主要是由甲状腺C 细胞产生的无激素活性的降钙素前肽物质,是由116 个氨基酸残基组成的分子量为13 KD 的糖蛋白。由于ARDS 患者常合并有脓毒症,细菌细胞壁的脂多糖可刺激外周血单核细胞产生PCT,机体可释放的肿瘤坏死因子-α、白细胞介素-6 等大量炎性因子可促进PCTmRNA 的大量表达,因此可表现为血浆PCT 水平异常升高[12]。CRP是白细胞介素-6 诱导肝脏合成的一种急性时相非特异性蛋白,是急性炎症反应的重要标记物[13]。在感染和组织损伤时血浆浓度急剧升高,并可于24 h~72 h 内达到峰值。研究显示,CRP 可激活补体,产生大量炎症介质并释放氧自由基,加剧炎性反应;一旦感染被有效控制,CRP 可在48 h 内迅速下降,故临床将其作为判断感染及创伤损害危重程度和预后的评价指标[14]。本研究发现,在A1 组及死亡组中可见PCT、CRP 水平显著升高,进一步佐证两者均与食管癌术后肺炎合并ARDS患者病情发展密切。
ARDS 的病理基础为炎症细胞介导肺炎症反应致肺毛细血管膜损伤,临床以微血管通透性增高而导致的肺泡含蛋白质肺水肿等为主要病理特征[15]。ARDS 发生时,患者出现呼吸窘迫和难以纠正的低氧血症,组织氧供应严重不足,机体内环境和代谢发生紊乱,导致产生大量的乳酸[16]。因此,近年来血乳酸含量在评估ARDS 患者病情演变中的临床应用价值日益增高。本研究结果提示检测24 h 乳酸清除率可有效反映机体的循环功能和组织灌注情况。
综上所述,PCT、CRP、24 h 乳酸清除率食管癌术后肺炎合并ARDS 患者中呈异常表达,三者异常表达是食管癌术后肺炎合并ARDS 患者预后生存的独立危险因素,对患者的生存评估具有一定的临床价值。

