耐盐型纤维素酶产生菌的驯化与筛选
王希桐,杨庆昊,王宇航,张霞玲,吴 涵,王孟琦,周贵忠
(青岛科技大学 环境与安全工程学院,山东 青岛266042)
现如今,随着人口的增长和经济的飞速发展,人们的需水量急剧上升,加之现代工业逐步发展,水资源短缺和水污染也变成了世界性难题。造纸、纺织、畜牧等行业会产生高盐度且含有大量纤维素的工业废水[1]。这些废水含有大量无机盐和有机物,具有色度高、可生化性差的特点[2-3]。纤维素作为一种天然高分子有机物,大量存在于水体中会造成水体富营养化,引起水生植物剧烈生长,溶解氧降低,进而水体呈厌氧状态散发恶臭。因此,寻找一种高效处理含纤维素的高盐度工业废水的方法意义重大[4]。
目前,针对此类废水一般采用混凝法、电化学方法、盐析法、萃取法、吸附法、吹脱和汽提法、微波诱导催化法等,但是混凝法、电化学方法、盐析法沉淀后形成的淤泥不易妥善处理,萃取法、吸附法消耗大量化学药剂,吹脱和汽提法耗能严重,微波诱导催化法还需进行后续生化处理,所以难以在实际生产中运用[3-6]。生物处理是目前处理此类废水最常用的方法,它具有应用范围广、适应性强等特点,效果较好[6]。许多研究表明,采用生物法处理废水的关键是要驯化出耐受某特定环境的微生物,以实现对有机物的良好降解[7-9]。
对于纤维素的降解主要依靠于纤维素酶,纤维素酶是降解纤维素的一组酶的总称,作用于纤维素以及纤维素衍生物,将纤维素分解成寡糖或单糖。在自然界中存在大量细菌、真菌、放线菌等微生物扮演者“分解者”的角色,一部分具有降解纤维素的能力,而且少数植物和昆虫也能产生纤维素酶,所以纤维素酶的来源和分布范围很广泛[10]。
海洋被誉为“微生物宝库”,有着丰富的生物资源。海洋微生物经过数亿年的转化已经完全适应了天然高盐环境,从海洋样品中筛选出的菌株耐盐度即为当地海水盐度。海草本身含有纤维素,从新鲜海草表面和腐烂的海草中大概率存有能降解纤维素的菌株。从海水、海草、海泥中取样,进一步驯化与筛选,便可得到耐盐型产纤维素酶菌株。因此,本研究对从青岛栈桥景区取得的海洋样品中的微生物进行驯化研究,以期筛选出高效降解纤维素的耐盐性菌株并应用于含纤维素高盐度废水的处理中。
1 实验部分
1.1 实验材料
1)海沙与海泥:在潮水褪去以后,为了避免污染,在尽可能远离海岸的地方取样。用铁铲除去顶部10 c m左右的海沙与海泥的混合物,样品放置于灭菌的自封袋内,标明采样的时间和地点[11]。
2)海草:从海边岩石上取各类海草、海藻、青苔封装于灭菌自封袋内,标明采样时间地点。
3)海水:取远离海岸的海平面10 c m以下的清澈海水,用干净的塑料桶盛装,封口后贴标签,标明采样的时间和地点。经测定,海水盐度约为3%。
1.2 主要试剂
葡萄糖、羧甲基纤维素钠(CMC-Na)、牛肉膏、蛋白胨、酵母膏、可溶性淀粉、琼脂、(NH4)2SO4、KH2PO4、Na2HPO4、MgSO4·7 H2O、FeSO4·7 H2O、K2Cr2O7、HgSO4、DNS试剂、0.1%刚果红染液、1%孟加拉红溶液、磷酸缓冲溶液(p H=6)。
1.3 模拟废水
向海水样品中按每1 L海水加入1 g葡萄糖,0.11 g(NH4)2SO4,0.045 3 g KH2PO4。随着培养的不断进行,逐渐用羧甲基纤维素钠(CMC-Na)代替葡萄糖,以C源占比10%的比例逐渐上升,直至100%。
1.4 培养基
1.4.1 富集培养基
LB培养基:牛肉膏(5 g·L-1),蛋白胨(10 g·L-1),p H为7~7.2,使用海水定容。
马丁氏培养基:葡萄糖(10 g·L-1),蛋白胨(5 g·L-1),KH2PO4(1 g·L-1),MgSO4·7 H2O(0.5 g·L-1),1%孟加拉红(3.3 mL·L-1),使用海水定容。
高氏培养基:可溶性淀粉(20 g·L-1),KNO3(1 g·L-1),K2HPO4(0.5 g·L-1),MgSO4·7 H2O(0.5 g·L-1),FeSO4·7 H2O(0.01 g·L-1),p H为7.4~7.6。
1.4.2 鉴别培养基
CMC固体培养基:CMC-Na(10 g·L-1),Mg-SO4·7 H2O(0.5 g·L-1),KH2PO4(1 g·L-1),Na2HPO4(1 g·L-1),酵母膏(5 g·L-1),蛋白胨(10 g·L-1),琼脂(20 g·L-1),p H为7.2~7.4,海水定容。
1.4.3 深层发酵培养基
CMC-Na(10 g·L-1),MgSO4·7 H2O(0.5 g·L-1),KH2PO4(1 g·L-1),Na2HPO4(1 g·L-1),酵母膏(5 g·L-1),蛋白胨(10 g·L-1),p H为7.2~7.4,海水定容,高压蒸汽灭菌(20 min,121℃)。锥形瓶接种菌株,在30℃恒温、摇床转速150 r·min-1的条件下培养2 d。
1.5 菌群驯化
将采集回的海泥、海沙放入2 L烧杯中加入海水,保持水泥比1∶1,进行曝气培养。以葡萄糖为碳源,以NH4Cl为氮源,以KH2PO4为磷源,以海水为溶剂,每天按照营养比例n(C)∶n(N)∶n(P)=100∶5∶1向烧杯中加入营养液,进行换水,持续2周。
CODCr定义为在一定条件下,经重铬酸钾氧化处理,水样中的溶解性物质和悬浮物所消耗的重铬酸钾相对应的氧的质量浓度,1 mol重铬酸钾(1/6 K2Cr2O7)相当于1 mol氧(1/2 O)。当CODCr去除率趋于稳定时,认定烧杯中的微生物正常存活,且具有耐盐特性(盐度3%)。
之后用CMC-Na逐渐取代葡萄糖作为碳源,CMC-Na占比以每次10%的程度递增,每个浓度梯度培养1周。当碳源全部替换为CMC-Na,CODCr去除率趋于稳定时,则认为菌群驯化成功。
1.6 快速消解分光光度法测定废水中化学需氧量(CODCr)
按行业标准HJ/T 399—2007配制试剂并选择试剂用量。取4支消解管(1支空白+3支平行试样),空白试样中依次加入2 mL蒸馏水、1 mL重铬酸钾溶液(0.12 mol·L-1)与硫酸汞溶液(0.24 g·mL-1)混合液、4 mL硫酸银-硫酸溶液(10 g·L-1),混匀;被测试样消解管中用2 mL水样代替蒸馏水,其余不变,混匀。在快速消解仪中,将消解管中的溶液在150℃温度下消解2 h后取出,使用COD测定仪进行测定。取三组数据的平均值作为出水CODCr,并计算CODCr的去除率。
1.7 菌种的分离、纯化
将烧杯中的泥水分别接种至富集培养基,细菌采用LB培养基,真菌用马丁氏培养基,放线菌用高氏培养基进行培养[11]。采用平板划线分离法在CMC固体培养基上进行分离、纯化,根据菌落大小、颜色、形状、隆起程度、透明程度和表面光泽等形态特征对菌株进行区分,并挑取单菌落制成斜面培养基放于冰箱4℃冷藏。
1.8 刚果红染色法初筛
刚果红染液可以与培养基中的多糖结合形成红色混合物,对纤维二糖和葡萄糖无作用。而产纤维素酶的微生物可以降解多糖底物,通过Na Cl溶液的作用可以将染液洗脱,从而产生透明圈[12]。将配制的CMC固体培养基进行高压蒸汽灭菌(20 min,120℃),冷却后制成平板。将菌种接种于平板上,30℃恒温培养2 d后取出,向培养基表面滴加0.1%的刚果红染液浸泡15 min,然后用适量1 mol·L-1Na Cl溶液洗脱20 min,观察有无透明水解圈出现。出现水解圈的菌株即为所需要的耐盐型产纤维素酶菌。记录水解圈直径(D)和菌株的直径(d),D/d的值作为初筛的依据。
1.9 粗酶液的制备
将菌株接种在深层发酵培养基中,在30℃恒温、摇床转速150 r·min-1条件下培养2 d,取上清液4 mL于离心管中,4 000 r·min-1离心10 min,上清液即为粗酶液。
1.10 DNS法测定FPA酶活
以规格为(6.0 c m×1.0 c m)的What man No.1滤纸条为底物,加入定量粗酶液和DNS试剂后,测定FPA酶活。
1.11 绘制葡萄糖标准曲线
配制1.0 mg·mL-1的葡萄糖标准溶液50 mL,取若干25 mL比色管,按表1所示配制混合溶液。混匀后沸水浴5 min,立即放入冰水中冷却至室温,用蒸馏水定容至25 mL。以1号标准溶液为对照,在540 nm波长下测定溶液吸光度。以吸光度为纵坐标,葡萄糖含量为横坐标,绘制标准曲线,见图1。
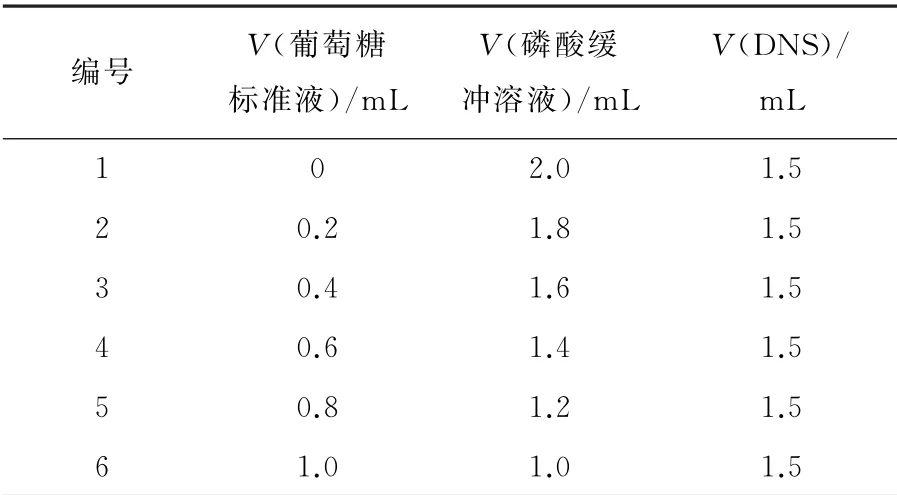
表1 葡萄糖标准溶液配制Table 1 Glucose standar d solution preparation
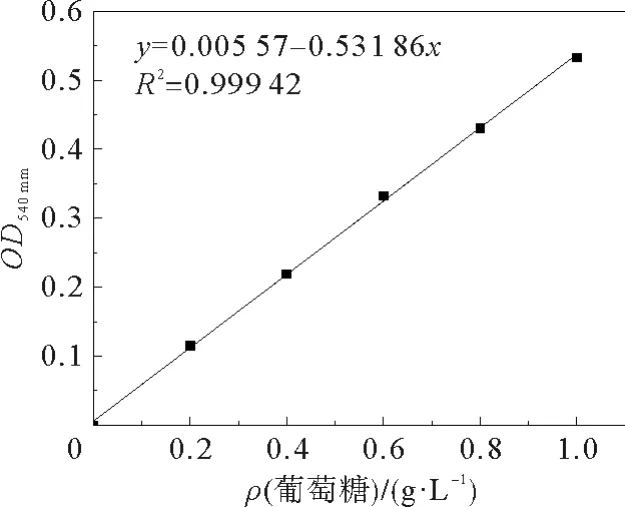
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
其中R2=0.999 42>0.95,说明在540 n m波长处,吸光度与溶液中葡萄糖含量存在可靠的线性关系,该组数据可以作为葡萄糖标准曲线。
1.12 FPase酶活测定
将FPA酶活定义为酶水解1 h后每分钟产生1 μmol葡萄糖所需的酶量[12]。测定FPA酶活时样品中包含规格为6.0 c m×1.0 c m(50 mg)的Whatman No.1滤纸条、1 mL粗酶液、1 mL p H=6的磷酸缓冲溶液。将样品与空白(滤纸条+2 mL缓冲溶液)50℃恒温水浴1 h后各加入1.5 mL DNS试剂,沸水浴5 min后冷却、定容至25 mL,静置20 min后于540 n m波长处测定吸光度。计算酶活[12]。
2 结果与讨论
2.1 污泥驯化
当营养液中的碳源全部由葡萄糖替换为CMCNa后,开始每2 d对出水CODCr进行监测,持续两周,期间CODCr去除率变化情况见图2。在第3 d时CODCr去除率有下降趋势,且出现絮凝性变差的情况,原因是碳源全部改为CMC-Na,微生物无法短时间适应。之后CODCr去除率逐渐回升,在第13 d的时候达到最高值62.4%。在第15、17 d测量时发现CODCr去除率有所下降,并且出现污泥沉降性能变差的情况,污泥量因此有所减少。经分析可能是由于驯化期间没有新污泥的加入,且持续时间过长,微生物传代次数过多,导致降解能力有所衰退。为保存菌种,在第17 d时将菌株分离出来,结束驯化过程。
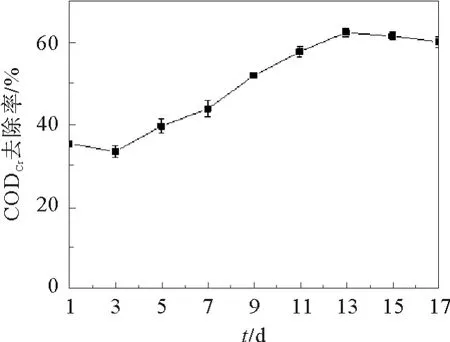
图2 CODCr去除率变化情况Fig.2 CODCr removal rate changes
2.2 菌种的初筛
经分离、纯化后获得10株耐盐菌,对于其是否具有降解纤维素的性能还需进行检验。
刚果红染色后会在产纤维素酶菌株周围出现以菌株为中心的透明圈,因此可以通过染色后菌株周围是否产生透明圈来判断是否该菌株具备降解纤维素的能力[10]。使用刚果红染液染色后共有7株菌出现了透明水解圈,分别命名为1~7号菌株。实验测定了水解圈直径D和菌落直径d,通过D/d的值来初步表示菌株降解纤维素的能力。该值越大,说明菌株的产酶能力越高,降解纤维素的能力越强,反之则越弱,结果见表2。
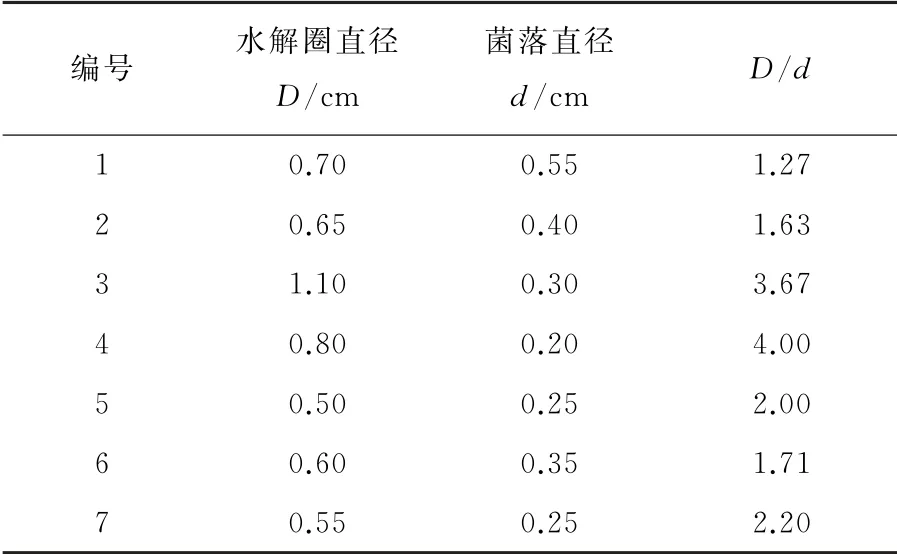
表2 CMC-Na固体培养基不同菌株的水解能力Table 2 Hydr olysis ability of different strains of CMC-Na solid mediu m
由表2可知,分离得到的10株菌种,只有7种菌产生了透明水解圈,即初步判定具有降解纤维素的能力,但D/d的值存在较大差异,比值最小1.27,最大4.00。数据初步表明,3号和4号菌株显示出了良好的降解能力,D/d的值分别为3.67和4.00。其次是5号和7号,D/d的值分别为2.00和2.20。以上4株菌株在后续实验中需要重点关注,其余菌株降解能力一般。虽然1号菌株在培养基上的生长速度很快,菌落直径达到0.55 c m,但D/d的值只有1.27,为7株菌种内降解能力最弱的一种。
在实验过程中,同一株菌,菌落大小不同,水解圈大小和染色效果也不同,而且存在测量误差。所以在选择测量对象的时候要尽量选取界限分明、染色效果好、大小适中的单菌落,同一直径测量3次取平均值,最终计算得出D/d的值进行比较。
另外,一株菌是否具备降解纤维素的能力不能只靠是否产生透明圈来判断。某些菌株会分泌色素或者降解色素的活性物质,同样会在培养基中产生透明圈,即假阳性结果。因此,需要对透明圈实验中的阳性菌株进行定量筛选,以纤维素总酶活(FPA酶活)为指标,进行酶活测定[12]。
2.3 菌种的复筛
将7种菌株各取一环接种至深层发酵培养基中,置于30℃,转速150 r·min-1的恒温水浴摇床中发酵2 d后取出,DNS法测定各菌株的FPA酶活数据,见表3。实验结果表明:7个菌株都有降解纤维素的酶,只不过存在能力大小的差异。4号菌的FPA酶活最高,是实验的优良菌种,其他菌种FPA酶活都在0.05 U·mL-1左右,能力相差不大。综合菌落形状、水解圈大小、产酶能力3项指标,2、3、4、6号菌株为实验的目标菌株,同时具备耐盐度3%和降解纤维素的能力,4号菌为最佳菌株。由于高盐度对微生物活性的抑制作用,实验中测定得到的FPA酶活普遍低于同类研究中的酶活数据。如想提高其酶活,可在后续实验中通过改变p H值、温度、摇床转速、发酵时间等因素进行改善。
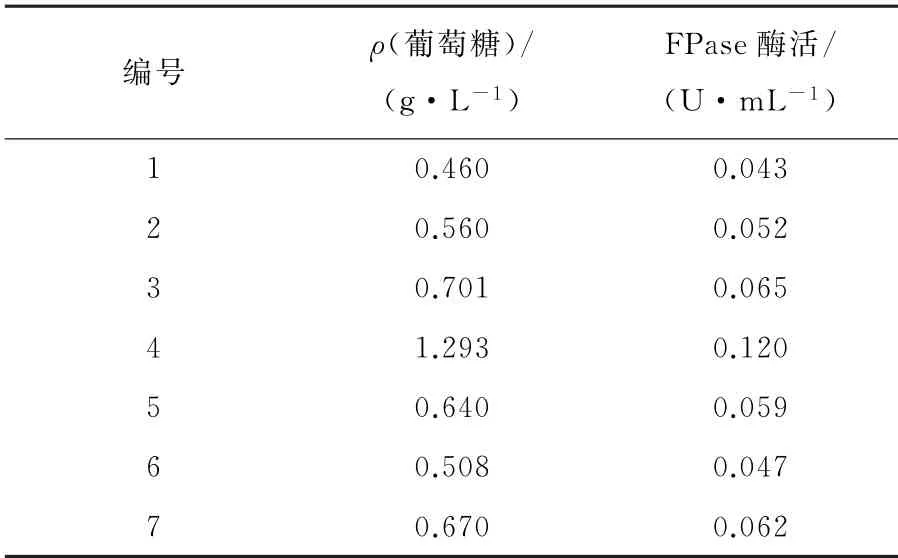
表3 各菌株FPase酶活测定Table 3 FPase enzy me activity of each strain
3 结 论
前期通过控制反应条件对海洋中原始菌种进行驯化。经过约2个月的驯化,污泥颜色从灰黑色逐渐变为黄褐色,CODCr去除率稳定在65%左右。对驯化后的菌株进行筛选得到4株目标菌株,其耐盐度为3%。2号菌株FPase酶活为0.052 U·mL-1,菌落特征为白色、形状规则、边缘整齐、扁平状、较小;3号菌株FPase酶活为0.065 U·mL-1,菌落特征为白色,形状规则,边缘整齐,凹陷状,较大;4号菌株FPase酶活为0.120 U·mL-1,菌落为中间淡黄色四周透明的较大规则圆形,边缘有褶皱;6号菌株FPase酶活为0.047 U·mL-1,菌落特征为中间乳白色,四周透明,规则圆形,边缘整齐,黏稠。4株菌后期可以进行酶系互补实验和拮抗实验,用以构建混合菌剂,提升降解纤维素的能力。

