丛枝菌根真菌对玉米籽粒产量和氮素吸收的影响
张学林 李晓立 何堂庆 张晨曦 田明慧 吴 梅 周亚男 郝晓峰 杨青华
丛枝菌根真菌对玉米籽粒产量和氮素吸收的影响
张学林*李晓立 何堂庆 张晨曦 田明慧 吴 梅 周亚男 郝晓峰 杨青华
河南农业大学农学院 / 省部共建小麦玉米作物学国家重点实验室 / 河南粮食作物协同创新中心, 河南郑州 450002
明确丛枝菌根真菌(Arbuscular Mycorrhizae Fungi, AMF)在玉米籽粒产量和氮素吸收方面的作用, 能够为农田生物肥料配施、养分利用效率提高、作物抗逆能力增强和作物产量增加提供理论依据。2016和2017年2个玉米生育期, 采用分室(生长室和菌丝室)箱体装置, 设置氮肥用量(N180: 180 kg hm–2; N360: 360 kg hm–2)、小麦秸秆(无秸秆: S0; 有秸秆: S1)和丛枝菌根真菌(M0: 根和AMF不能从生长室进入菌丝室; M1: 只有AMF能从生长室进入菌丝室; M2: 根和AMF均能从生长室进入菌丝室)三因素试验, 测定玉米籽粒产量、植株生物量、植株氮素积累量和根系性状。结果表明, 氮肥用量、秸秆和丛枝菌根真菌均显著影响玉米籽粒产量及其氮素积累量。与N180相比, N360处理显著增加玉米产量及其氮素积累量; 有秸秆处理籽粒产量比无秸秆处理降低6%, 而土壤无机氮增加129%。N180条件下, M1和M2处理玉米产量均值分别比M0增加38%和82%; N360条件下分别增加16%和48%, 其中, 在N180条件下M1对籽粒的贡献量高于N360。秸秆存在与否, AMF均能增加玉米穗长、行粒数和根系总根长; 其中, 有秸秆条件下AMF提高根系生物量及其氮素积累量的能力显著高于无秸秆处理。氮肥用量和秸秆互作条件下, M1和M2处理的行粒数、穗粒数、根、茎、叶生物量及其氮素积累量、根系总根长均显著高于M0; 而土壤无机氮含量显著低于M0, 其中, 在N180和有秸秆条件下, AMF对这些性状的贡献量较大。相关分析和结构方程结果表明, 氮肥用量和AMF均显著提高玉米产量。本研究表明, 不同氮肥用量条件下、小麦秸秆存在与否, 丛枝菌根真菌均能够改善玉米根系特性, 增强氮素吸收能力, 改善穗部性状, 增加玉米籽粒产量。
作物秸秆; 丛枝菌根真菌; 氮肥管理; 玉米产量; 养分吸收
丛枝菌根真菌(Arbuscular Mycorrhizae Fungi, AMF)是一种广泛分布在土壤中的真菌, 它能够与80%以上的陆生植物形成菌根共生体, 菌根共生体向寄主植物提供磷、氮等营养物质和水分, 同时依靠寄主提供的碳水化合物维持生存[1-3]。AMF与寄主的这种共生关系, 不仅改善寄主植物根际土壤环境, 促进养分吸收、增加寄主生物量, 而且提高了寄主应对生物及非生物胁迫的能力[4-6], 因此, AMF在农田系统中的作用越来越受到关注。
国内外科研工作者采用盆栽和大田试验, 广泛研究了AMF在作物产量和养分, 尤其是氮素吸收方面的作用。Tanaka和Yano[7]利用15N同位素示踪技术和分室隔网装置, 研究了寄主植物根外菌丝对土壤养分的吸收利用; Hodge等[8]研究发现AMF根外菌丝可以吸收多种简单形态的无机氮和有机氮, 显著影响作物对氮素的吸收与同化; 李侠和张俊伶[9]采用空气隔板分室-半液培系统比较了2种丛枝菌根根外菌丝吸收不同形态氮素的能力, 发现丛枝菌根根外菌丝吸收传递15N的能力因菌种和氮素形态而异; 刘文科和杜连凤[10]比较了不同AMF对3种土壤类型玉米籽粒氮素积累量的影响。AMF调控寄主作物氮素吸收的作用受到自然因素和栽培管理措施的影响[11-14]。
氮肥用量和秸秆是影响AMF作用的主要措施。普遍研究认为, 丛枝菌根真菌在低养分条件下, 能扩大寄主根系侵染率, 增加土壤中的孢子数, 增强寄主氮素吸收能力, 促进寄主植物的营养吸收, 提高其生物量[2,8]; 增施氮肥会减少菌根定殖和孢子形成, 抑制AMF菌丝的发育, 降低AM真菌群落的丰度和多样性[15-16], 进而抑制寄主植物氮素吸收; 然而也有研究认为, 增施氮肥条件下, AMF对寄主植物有中性或者正效应[17-19]。Wang等[20]发现, 低氮条件下AMF减少玉米氮素吸收, 降低玉米产量。作物秸秆含有大量作物生长所需的矿质元素, 是一种重要的农业可再生资源[21-23], 秸秆还田并接种丛枝菌根真菌能促进秸秆分解、加速可利用性养分的释放[24-26]。Hodge和Fitter[8]发现AMF增强了有机物的降解, 提高了寄主植物氮素的吸收; 王维华等[27]采用盆栽研究发现, 小麦、玉米、三叶草秸秆接种AMF后能不同程度增加土壤养分和宿主植物的生物量。目前, 国内外有关AMF与作物产量及其氮素吸收利用方面的研究结果不一致, 作用机制尚不明确[28]。本试验采用分室箱体装置, 研究氮肥用量和秸秆有无条件下接种AMF对玉米产量和氮素吸收的独立作用, 以期为充分发挥AMF在粮食生产、养分管理等方面的作用提供理论依据。
1 材料与方法
1.1 试验地点和材料
于2016年和2017年6月至10月, 在河南省西平县二郎乡张尧村(114°02′E, 33°20′N, 平均海拔49 m)室外开展试验, 土壤类型为沙姜黑土。供试土壤取自长期定位试验不施肥处理0~20 cm耕层, 土壤自然风干后过2 mm筛备用。供试土壤基本理化性质为: 全氮2.76 g kg–1, 有机质8.17 g kg–1, 碱解氮0.11 g kg–1, 速效磷0.02 g kg–1, 速效钾0.33 g kg–1, pH 6.81, 沙粒39.09%, 壤粒21.35%, 黏粒39.56%。
供试菌种为摩西球囊霉(), 由北京市农林科学院植物营养与资源研究所“AMF种质资源库” (Bank of Glomeromycota in China, BGC)提供, 以玉米为寄主植物进行扩繁, 产生的菌剂包括相应的培养基质、孢子、根外菌丝以及植物根段等, 其中, 菌剂孢子密度为30个 g–1。前茬小麦收获后收集秸秆, 105℃下杀青30 min, 65℃烘干后, 剪成1~2 cm段备用。供试玉米品种为伟科702, 购自河南金苑种业有限公司。
1.2 试验设计
本试验为氮肥用量、秸秆和菌根真菌(mycorrhizae: M)三因素设计, 其中, 氮肥用量为180 kg hm–2(N180)和360 kg hm–2(N360)两个水平; 秸秆因素为无秸秆(S0)和有秸秆(S1)两个水平。为区分寄主玉米产量是由于AMF的直接作用, 还是菌丝共同体的作用, 参照前人方法[9,29], 采用分室箱体培养装置, 整个分室箱体(长×宽×高)大小为60 cm × 20 cm × 20 cm, 中间用有孔挡板隔开分为生长室和菌丝室, 生长室一侧种植玉米, 并接种50 g AMF菌剂混合物; 另一侧为菌丝室, 主要用于测定和验证菌根的功能。根据中间挡板薄膜通透性, 菌根因素设置3个水平, 对照(M0): 生长室和菌丝室之间用网孔0.45 μm薄膜隔离, 玉米根和AMF只能在生长室生长, 不能通过挡板进入菌丝室; M1处理: 生长室和菌丝室之间用网孔20 μm薄膜隔开, 只允许AMF菌丝通过挡板进入菌丝室; M2处理: 生长室和菌丝室之间用网孔0.46 cm尼龙网隔开, AMF和根均可通过挡板进入菌丝室。每个处理4次重复。试验开始前, 基于每个箱体风干土总重24 kg, 按照每公顷土壤2,000,000 kg, 小麦秸秆全量还田为6750 kg hm–2, 计算出每个箱体的秸秆还田量, 与风干土混合均匀分布于箱体生长室和菌丝室。供试玉米品种挑选大小均匀一致的种子, 10% H2O2表面消毒后, 蒸馏水冲洗干净, 于每年6月10日播种, 每个生长室播种4粒种子, 于三叶期留苗2株。50%氮肥、100%磷肥(90 kg hm–2)和100%钾肥(120 kg hm–2)作为底肥, 于播种前与土壤充分混合施入, 50%的氮肥于大喇叭口期溶于蒸馏水追施; 玉米成熟期(10月5日左右)收获, 并进行相关参数的测定分析。
1.3 测定分析
玉米成熟期收获的果穗进行室内考种和计产; 植株生物量分为根、茎、叶和籽粒等部分, 烘箱105℃杀青30 min, 70℃烘干至恒重, 称重后粉碎, 用H2SO4-H2O2消煮, 流动分析仪(AA3, SEAL-Analytical, Germany)测定各器官全氮含量。成熟期生长室与菌丝室玉米根系用水冲洗干净后, 采用EPSON EXPRESSION 10000XL根系扫描仪(Seiko Epson Corp., Japan)与WinRHIZO软件(Pro 2013e, Regent Instruments Inc., Canada)扫描和分析玉米总根长、根系表面积、平均根系直径和根体积。丛枝菌根真菌侵染率采用脱色-酸性品红染色法: 取成熟期不同处理的玉米根系, 洗净切成0.5~1.0 cm长根段, 放入试管并加入5% KOH溶液, 90℃水浴保持20 min, 之后清水反复清洗除去碱液, 加入2% HCl酸化5~10 min, 过滤后加入0.1%酸性品红乳酸甘油染色液, 于90℃水浴保持20~30 min滤掉染色液, 加入乳酸脱色后在载玻片上染色固定, 采用显微镜进行镜检观察, 记录染色结果。由于处理间根系侵染率差异不显著, 所以未呈现数据。成熟期从菌丝室取土, 并采用KCL浸提、流动分析仪分析土壤无机氮含量。部分计算公式如下:
收获指数(%) = 玉米籽粒产量/玉米地上部生物量´100;
各器官氮素积累量(mg plant–1) = 各器官生物量×该器官全氮含量;
AMF贡献量(%) = (M1处理 – M0处理) / M0处理´100。
1.4 统计分析
采用GLM-ANOVA分析氮肥用量、秸秆和菌根真菌处理之间, 玉米籽粒产量、植株生物量、氮素积累量和根系特性的差异显著性, 并采用LSD (least significant difference)进行多重比较。采用Pearson Correlation分析玉米籽粒产量、收获指数和籽粒氮素积累量与根系性状、穗部性状、各器官生物量及其氮素积累量之间的相关性。所有数据均采用SPSS 19.0进行统计分析, 并采用SigmaPlot 12.5进行作图。结构方程模型(structural equation model, SEM)采用R studio软件lavaan包, 分析氮肥用量、秸秆还田和菌根真菌对籽粒产量的影响。
2 结果与分析
2.1 玉米籽粒产量、氮素积累量和穗部性状
由表1可知, 2016和2017两个试验年度氮肥用量、秸秆和丛枝菌根真菌均显著影响玉米籽粒产量、收获指数(2017年秸秆作用除外)以及籽粒氮素积累量。与N180均值相比, 2个试验年度N360水平玉米籽粒产量均值增加37% (图1)。与M0相比, M1和M2两个处理籽粒产量均值分别增加24%和59%, 收获指数增加7%和9%, 籽粒氮素积累量增加27%和52%。其中, N180条件下, M1和M2两个处理产量均值增加38%和82%, 收获指数增加12%和15%, 籽粒氮素积累量增加38%和62%; 而N360条件下M1和M2两个处理籽粒产量均值增加16%和48%, 收获指数增加3%和5%, 籽粒氮素积累量增加22%和50%; AMF在N180和N360条件下对籽粒的贡献量分别为38%和16%。说明不同氮肥用量条件下AMF均能增加玉米籽粒产量、收获指数和籽粒氮素积累量。其中, 低氮肥用量条件下, AMF对产量、收获指数和籽粒氮素积累量的贡献量相对较高, 而且M2处理对玉米产量和收获指数的作用高于M1处理。
与S0均值相比, S1处理2个试验年度籽粒产量均值降低6%。无秸秆条件下, M1和M2两个处理2个试验年度产量均值分别比M0增加27%和63%, 收获指数增加7%和10%, 籽粒氮素积累量增加24%和51%; 而有秸秆条件下, M1和M2两个处理籽粒产量分别增加27%和67%, 收获指数增加8%和10%,籽粒氮素积累量增加30%和55%, 其中, 以N180和有秸秆条件下, AMF对产量、收获指数和籽粒氮素积累量的贡献量最高, 分别为44%、13%和39%。这表明小麦秸秆还田略微降低玉米产量, 而AMF在玉米产量、收获指数和氮素吸收方面的促进作用不受秸秆有无的影响。
*、**和***分别表示0.05、0.01和0.001水平差异性。
*,**, and***indicate the significant difference at the 0.05, 0.01, and 0.001 probability levels, respectively.
M0、M1、M2分别代表对照、菌丝室只有AMF菌丝、菌丝室有根和菌丝。N180S0、N180S1、N360S0、N360S1分别代表施氮量180 kg km-2条件下无秸秆、180 kg km–2条件下有秸秆、360 kg km–2条件下无秸秆、360 kg km–2条件下有秸秆处理。同一年度中, 同列数据后不同字母表示处理间< 0.05水平差异显著性。
M0 represents the control; M1 represents that only AMF hyphae can enter the hyphal chamber from the growth chamber; M2 represents that both roots and AMF can enter the hyphal chamber from the growth chamber. N180S0, N180S1, N360S0, N360S1 represent nitrogen level of 180 kg hm–2without straw, 180 kg hm–2and straw, 360 kg hm–2without straw and 360 kg hm–2with straw, respectively. In the same year, different lowercase letters within a column indicate significantly differences at< 0.05 among the treatments.
由表2可知, 丛枝菌根真菌显著影响玉米行粒数和穗粒数, 其中, N180条件下M1和M2两个处理2个试验年度行粒数均值分别比M0增加7%和29%, 穗粒数增加5%和39%; N360条件下行粒数分别增加5%和20%、穗粒数增加2%和20%。无秸秆条件下, M1和M2两个处理的行粒数分别增加9%和17%, 穗粒数增加5%和21%; 有秸秆条件下, 行粒数增加3%和31%, 穗粒数增加3%和38%。说明AMF能够通过改善玉米行粒数、穗粒数提高产量, 其中, N180和无秸秆条件下AMF的改善作用更大, 但M2处理对玉米穗部性状的改善作用高于M1处理。
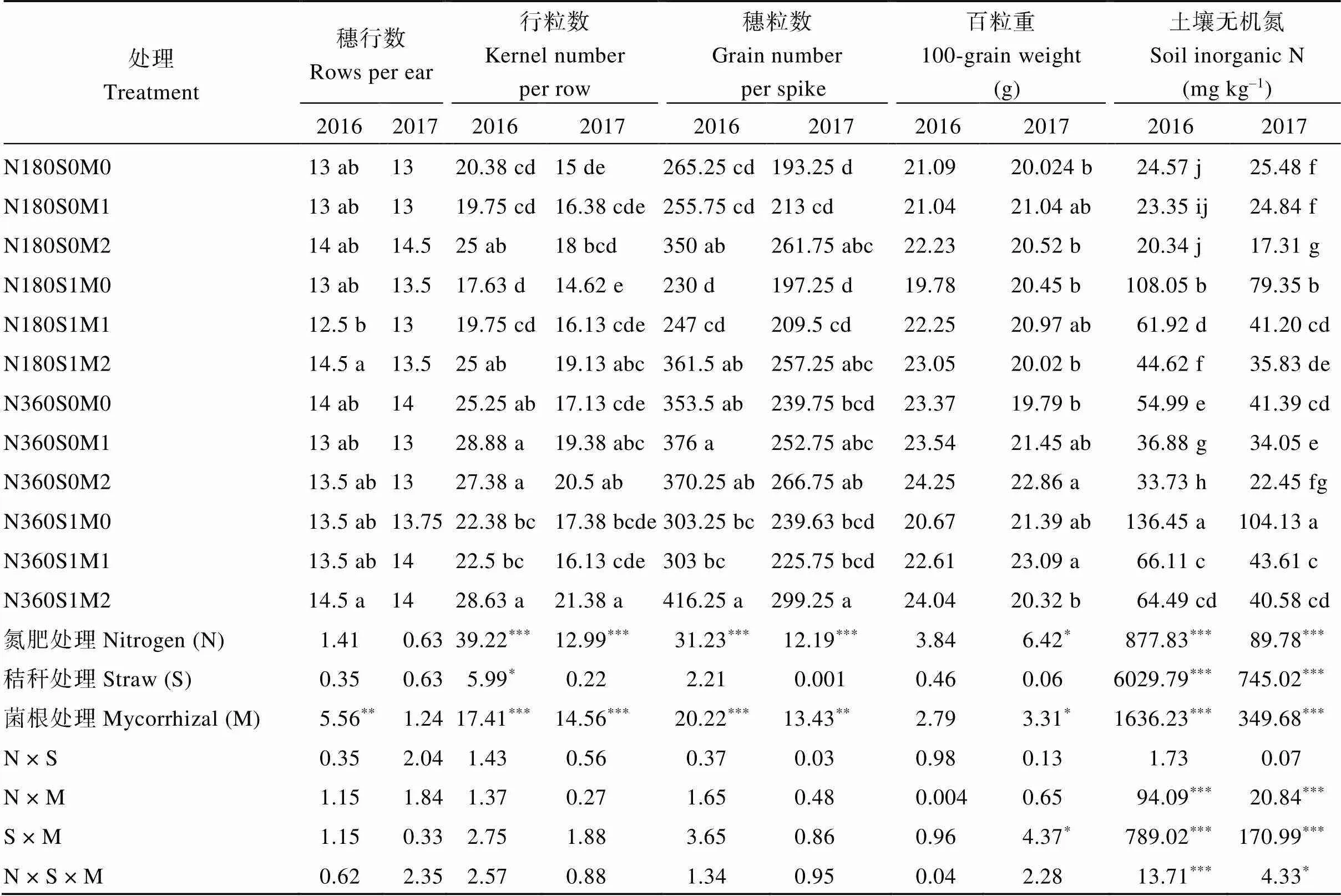
表2 氮肥用量、秸秆和菌根真菌对玉米穗部性状和土壤无机氮含量的影响
处理同图1。同一列不同字母表示处理之间< 0.05水平的差异显著性。*、**和***分别表示0.05、0.01和0.001水平差异性。
Treatments are the same as those given in Fig. 1. Different lowercase letters in the same column indicate significant differences at< 0.05 among the treatments.*,**, and***indicate significant differences at the 0.05, 0.01, and 0.001 probability levels, respectively.
2.2 玉米生物量及其氮素积累量
由表1可知, 氮肥用量和丛枝菌根真菌(2016年茎氮素积累量除外)均显著影响玉米根、茎和叶生物量及其氮素积累量(图2和图3); 而秸秆的作用不显著(2017年根、茎生物量除外)。与M0相比, M1和M2处理2个试验年度的根系生物量均值分别增加10%和37%, 茎生物量增加11%和38%, 叶生物量增加7%和31%, 根系氮素积累量增加3%和35%, 茎氮素积累量增加13%和29%, 叶氮素积累量增加11%和34%, 其中N180条件下M1和M2两个处理根生物量均值分别比M0增加13%和52%, 茎生物量增加7%和39%, 叶生物量增加10%和35%, 根系氮素积累量增加9%和69%, 茎氮素积累量增加11%和34%, 叶氮素积累量增加16%和32%; 而N360条件下M1和M2的根生物量增加9%和27%, 茎生物量增加14%和36%, 叶生物量增加4%和28%, 根氮素积累量增加0.05%和13%, 茎氮素积累量增加16%和29%, 叶氮素积累量增加8%和37%。这表明接种丛枝菌根真菌能显著提高玉米地上地下部生物量及其氮素积累量, 其中M2处理提高幅度更大; 不同氮肥用量条件下AMF对玉米地上、地下生物量及其氮素积累量的影响程度不同, 其中, 在N180条件下AMF提高玉米生物量及其氮素积累量的能力高于N360。
无秸秆条件下, M1和M2两个处理2个试验年度根生物量分别比M0增加9%和28%, 茎生物量增加13%和40%, 叶生物量增加10%和29%, 根系氮素积累量增加1%和44%, 茎氮素积累量增加19%和39%, 叶氮素积累量增加2%和27%; 而有秸秆条件下, 根生物量分别增加14%和51%, 茎生物量增加8%和35%, 叶生物量增加4%和34%, 根氮素积累量增加7%和39%, 茎氮素积累量增加8%和25%, 叶氮素积累量增加22%和41%。有秸秆条件下AMF提高根系生物量及其氮素积累量的能力显著高于无秸秆处理, 说明AMF可能参与了秸秆的分解, 并通过增加根系养分积累, 促进更多的养分转运给寄主。
处理同图1。同一年度中, 同列数据后不同字母表示处理间< 0.05水平差异显著性。
Treatments are the same as those given in Fig. 1. In the same year, different lowercase letters within a column indicate significant differences at< 0.05 among the treatments.
2.3 玉米根系性状和土壤无机氮
与N180相比, N360处理显著增加玉米根系总根长、根系表面积、根直径、根体积(图4); 而有秸秆处理比无秸秆处理均降低。不同氮肥用量和有无秸秆条件下, M2处理玉米根系总根长、根系表面积、根直径、根体积均值均显著高于M0。与M0相比, M1处理和M2处理2个试验年度的根系总根长分别增加7%和22%, 根表面积增加3%和28%, 根直径增加3%和33%, 根体积增加2%和48%, 其中N180条件下M1处理根系总根长增加6%, 根系表面积增加5%, 根直径增加2%, 根体积增加2%; N360条件下M1处理根系总根长增加10%, 根系表面积增加2%, 根直径增加4%, 根体积增加2%。无秸秆和有秸秆条件下, M1处理的根系总根长比M0均增加8%, 而根表面积、根直径和根体积的增加量均小于4%。说明不同氮肥用量和有无秸秆条件下, AMF主要促进了玉米根系总根长的增加, 其中M2处理对玉米根系性状的改善作用高于M1处理。
处理同图1。同一年度中, 同列数据后不同字母表示处理间< 0.05水平差异显著性。
Treatments are the same as those given in Fig. 1. In the same year, different lowercase letters within a column indicate significantly differences at< 0.05 among the treatments.
方差分析表明(表2), 氮肥用量、秸秆和丛枝菌根真菌显著影响土壤无机氮含量。与N180相比, N360水平2个试验年度土壤无机氮含量均值增加34%; 有秸秆处理比无秸秆处理增加138%, 说明增施氮肥和秸秆还田均可以增加土壤可利用性氮素含量。与M0相比, M1处理和M2处理2个试验年度土壤无机氮含量均值分别减少42%和52%, 其中N180条件下M1和M2分别减少25%和40%; 而N360条件下减少40%和50%; 无秸秆条件下M1和M2两个处理分别减少15%和33%, 而有秸秆条件下减少50%和57%。AMF处理中土壤无机氮含量减少, 说明AMF能够从菌丝室吸收转运土壤中可利用性氮素, 而且这种转运不受氮肥用量和秸秆有无的影响; N360和添加秸秆处理结果进一步表明, 土壤中可利用性氮素含量增加, AMF转运的养分就增多。
2.4 玉米籽粒产量与其他性状的相关性
相关分析结果表明(表3), 2个试验年度玉米籽粒产量和氮素积累量均与穗长、穗行数(2017年除外)、行粒数、穗粒数、植株生物量及其氮素积累量(2016年茎除外)、根系总根长、根系表面积、根系直径和根系体积呈显著正相关。结构方程结果(图5)表明, 氮肥用量和菌根真菌均对根系总根长、玉米植株生物量、穗粒数和收获指数有显著正向效应, 并提高了玉米产量; 而秸秆还田对这些参数有负效应。
处理同图1。同一年度中, 同列数据后不同字母表示处理间< 0.05水平差异显著性。
Treatments are the same as those given in Fig. 1. In the same year, different lowercase letters within a column indicate significant differences at< 0.05 among the treatments.
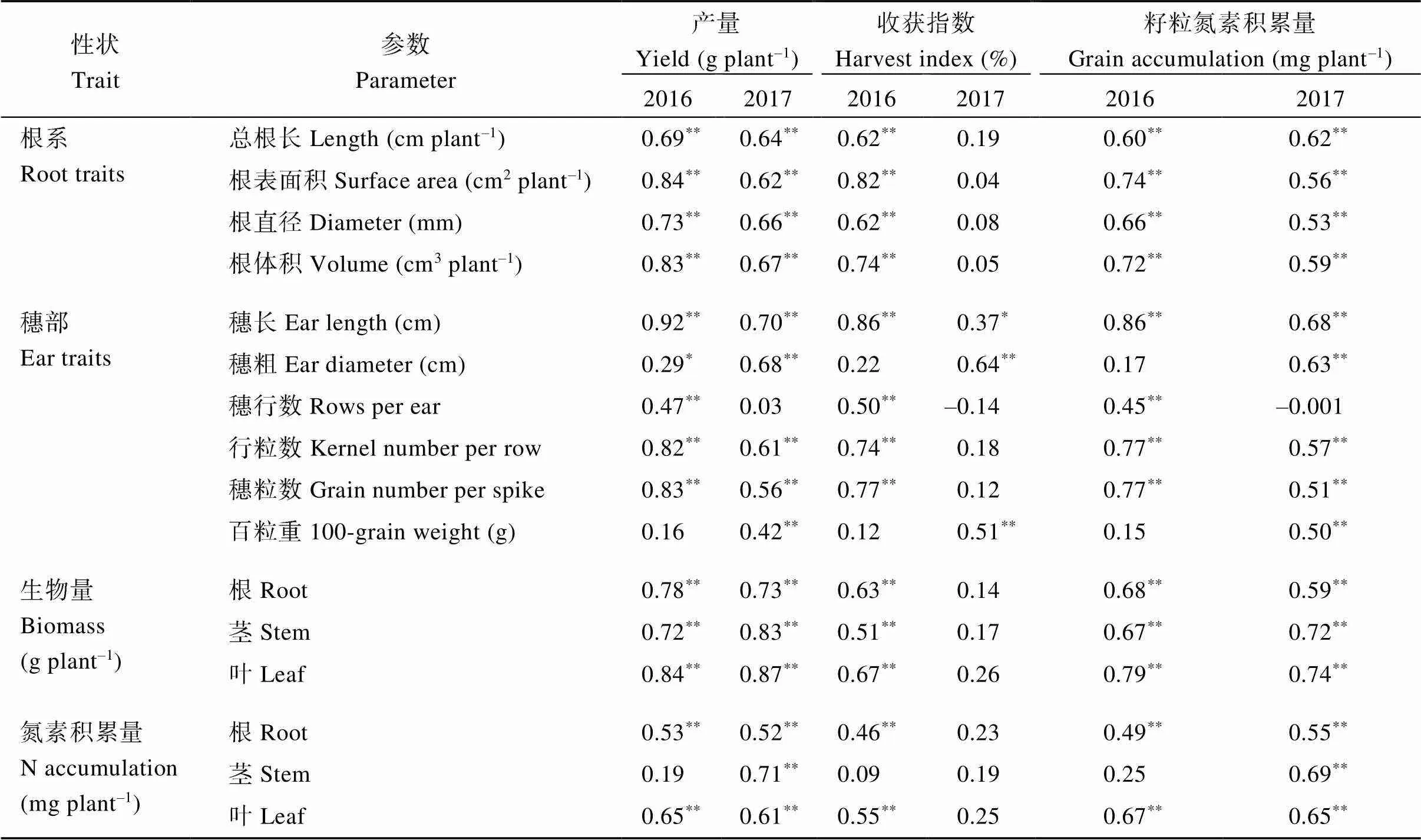
表3 玉米籽粒产量、收获指数以及籽粒氮素积累量与玉米根系性状、穗部性状、生物量及其氮素积累量的皮尔逊相关系数
*、**和***分别表示0.05、0.01和0.001水平相关性。
*,**, and***indicate the significant correlations at the 0.05, 0.01, and 0.001 probability levels, respectively.
实线和虚线分别表示正路径和负路径, 数值表示路径系数;2值表示相关系数。
The solid and dashed lines represent the positive and negative paths, respectively. The values indicate the path coefficients, and2value indicates the correlation coefficient.
3 讨论
本研究发现, 接种丛枝菌根真菌可以显著提高玉米籽粒产量及其氮素积累量, 其贡献量最高可达38% (表1和图1)。Frey等[30]采用分室培养系统和同位素示踪技术研究发现, 丛枝菌根真菌菌丝体吸收转运给寄主植物的氮素可达植物总吸收氮量的30%[4]; Tanaka和Yano[7]认为玉米中高达75%的氮是通过丛枝菌根真菌吸收而获得的。丛枝菌根真菌提高作物产量及其氮素累积量的途径, 可以通过其根外菌丝吸收土壤养分产生直接影响[28]。根外菌丝是丛枝菌根真菌定殖在寄主植物皮质细胞内形成的丛枝结构共生体[31-33]。玉米接种丛枝菌根真菌后形成一个大的外胚根菌丝网络, 并在土壤内扩散, 可以从根周围数厘米处吸收土壤中的养分, 扩大了对土壤氮元素的吸收范围[33-35]; 根外菌丝还能穿入到根系耗竭区外, 吸收植物根系不能达到的、在土壤中移动性很小的营养元素[8,36-37]。本试验中菌丝室内土壤无机氮含量显著降低, 也表明丛枝菌根真菌可以直接从土壤中吸收养分并转运给寄主植物[27]。
丛枝菌根真菌增加玉米产量的另一个原因, 是通过改善寄主植物根系特性产生间接影响[28]。姜德峰等[38]发现, 丛枝菌根真菌能显著提高玉米根系活力和吸收能力, 改善玉米矿质营养, 促进玉米生长发育。与非菌根化玉米相比, 丛枝菌根真菌与玉米形成菌根后根条数、根系总根长和生物量均明显增加[39]; 根系形态发生变化, 主要是因为丛枝菌根真菌侵染玉米根系过程中, 刺激根系产生较多的内源生长素IAA, 促进细胞伸长生长、细胞分裂和促进发根, 因此菌根化玉米根系发根量增加, 根条数增多, 作物根系能够接触, 并吸收更多的养分[40-41]。这与本试验中丛枝菌根真菌处理的玉米根系总根长增加, 养分吸收范围扩大的结果基本一致。本研究还发现丛枝菌根真菌增加了玉米行粒数和穗粒数, 改善了玉米穗部性状, 这可能也是导致丛枝菌根真菌增加玉米产量的原因。
不同氮肥用量条件下, 丛枝菌根真菌促进寄主产量增加的能力存在差异[5,11]。本研究发现, N180和N360条件下, 接种丛枝菌根真菌均能够显著增加玉米籽粒产量, 其中, N180条件下对作物产量的贡献量相对较高。这可能是较低养分条件下有利于菌根定殖、孢子形成和菌丝的发育[15-16]。N360条件下, 丛枝菌根真菌提高作物产量也表明, 即使是在高土壤养分条件下, 丛枝菌根真菌也能够与玉米根系建立良好的共生关系, 促进养分吸收, 提高其产量。秦子娴等[13]也发现, 土壤高有效磷条件下接种丛枝菌根真菌, 能够增加玉米生物量。丛枝菌根真菌提高玉米产量和养分吸收的作用不受土壤肥力高低的制约, 为其作为生物肥料在养分管理方面的应用拓宽了范围。
小麦秸秆还田可能会降低后茬玉米产量, 主要是因为小麦秸秆碳氮比高、氮含量低、分解较慢, 秸秆分解过程中微生物需要固持土壤中可利用性氮素, 降低了可利用性氮素的供应量[23,42-43]。但添加秸秆同时接种丛枝菌根真菌, 增加玉米产量及其氮素积累量, 一方面是丛枝菌根真菌可以直接参与秸秆分解, 吸收并转运部分小分子态有机氮或铵态氮给寄主植物吸收利用[9,20]。Whiteside等[44]应用量子点标记证明, 丛枝菌根真菌可以直接吸收、转运有机态氮, 并且在根外菌丝和植物根系中已经观察到量子点标记的有机态氮。另一方面是丛枝菌根真菌通过改变土壤酶活性, 改善分解秸秆的土壤微生物区系, 进而调控根际微生物的协同作用, 形成更多的可利用性养分[45]。这与本试验中有秸秆并接种丛枝菌根真菌后土壤无机氮含量增加的结果一致。王维华等[27]也发现, 秸秆还田并接种丛枝菌根真菌, 能不同程度的增加土壤铵态氮、速效钾和有机质含量, 这些养分可以被丛枝菌根真菌利用促进寄主产量增加。本试验中玉米根系性状的变化表明, 有秸秆条件下, 丛枝菌根真菌主要是通过促进根系总根长增加, 扩大养分吸收范围, 为产量增加提供保障。
氮肥用量和秸秆互作条件下丛枝菌根真菌显著增加玉米产量, 一方面, 增施氮肥与丛枝菌根真菌均能够给玉米植株提供更多的养分, 促进玉米产量的增加; 而且增施氮肥补充了秸秆分解过程中微生物对氮素的需求, 有效减轻秸秆还田负效应; 另一方面, 秸秆还田分解能够提供给丛枝菌根真菌更多可利用性养分; 秸秆还田还可以有效改善土壤物理结构, 给作物生长创造合适的耕作层[21-23]。丛枝菌根真菌结合适宜的氮肥用量和作物秸秆, 能够提高土壤肥力、促进作物生长、增加作物产量, 因此, 生产上采用适当的农艺措施, 可以充分发挥丛枝菌根真菌在作物生产方面的生理生态作用[38]。
4 结论
不同氮肥用量条件下, 玉米接种丛枝菌根真菌均能够增加其籽粒产量; 小麦秸秆存在与否, 不影响丛枝菌根真菌在玉米增产方面的作用; 添加秸秆条件下, 丛枝菌根真菌主要通过增加玉米根系总根长, 扩大养分吸收面积, 改善玉米穗部性状, 进而增加玉米籽粒产量及其氮素积累量; 其中氮肥180 kg hm–2和有秸秆条件下, 丛枝菌根真菌对玉米产量的贡献最大。
[1] Veresoglou S D, Chen B D, Rillig M C. Arbuscular mycorrhiza and soil nitrogen cycling., 2012, 46: 53–62.
[2] 金海如, 刘洁, 刘静, 黄晓伟. 丛枝菌根真菌氮吸收、运转和传递机理的总述. 中国科学: 生命科学, 2012, 42: 355–364. Jin H R, Liu J, Liu J, Huang X W. Forms of nitrogen uptake, translocation, and transfer via arbuscular mycorrhizal fungi: a review.(Vitae)2012, 42: 355–364 (in Chinese with English abstract).
[3] 张亮, 王晓娟, 王强, 王茜, 张云飞, 金樑. 同位素示踪技术在丛枝菌根真菌生态学研究中的应用. 生态学报, 2016, 36: 2787–2797. Zhang L, Wang X J, Wang Q, Wang Q, Zhang Y F, Jin L. The role of the isotope tracer technique in ecological research of arbuscular mycorrhizal fungi., 2016, 36: 2787–2797 (in Chinese with English abstract).
[4] Pellegrino E, Öpik M, Bonari E, Ercoli L. Responses of wheat to arbuscular mycorrhizal fungi: a meta-analysis of field studies from 1975 to 2013., 2015,84: 210–217.
[5] Zhang S J, Lehmann A, Zheng W S, You Z Y, Rillig M C. Arbuscular mycorrhizal fungi increase grain yields: a meta-analysis., 2019, 222: 543–555.
[6] 陈永亮, 陈保冬, 刘蕾, 胡亚军, 徐天乐, 张莘. 丛枝菌根真菌在土壤氮素循环中的作用. 生态学报, 2014, 34: 4807–4815. Chen Y L, Chen B D, Liu L, Hu Y J, Xu T L, Zhang X. The role of arbuscular mycorrhizal fungi in soil nitrogen cycling., 2014, 34: 4807–4815 (in Chinese with English abstract).
[7] Tanaka Y, Yano K. Nitrogen delivery to maize via mycorrhizal hyphae depends on the form of N supplied., 2005, 28: 1247–1254.
[8] Hodge A, Fitter A H. Substantial nitrogen acquisition by arbuscular mycorrhizal fungi from organic material has implications for N cycling., 2010, 107: 13754–13759.
[9] 李侠, 张俊伶. 丛枝菌根根外菌丝对不同形态氮素的吸收能力. 核农学报, 2007, 21: 195–200. Li X, Zhang J L. Uptake of different forms of nitrogen by hyphae of arbuscular mycorrhizal fungi., 2007, 21: 195–200 (in Chinese with English abstract).
[10] 刘文科, 杜连凤. 不同类型土壤上接种丛枝菌根真菌对玉米氮素吸收的影响. 玉米科学, 2007, 15(6): 103–105. Liu W K, Du L F. The effects of six arbuscular mycorrhizal fungi on N uptake of maize in three different type soils., 2007, 15(6): 103–105 (in Chinese with English abstract).
[11] 冯固, 白灯莎, 杨茂秋, 李晓林, 张福锁, 李生秀. 盐胁迫下AM真菌对玉米生长及耐盐生理指标的影响. 作物学报, 2000, 26: 743–750. Feng G, Bai D S, Yang M Q, Li X L, Zhang F S, Li S X. Influence of inoculating arbuscular mycorrhizal fungi on growth and salinity tolerance parameters of maize plants., 2000, 26: 743–750 (in Chinese with English abstract).
[12] 郭静, 罗培宇, 杨劲峰, 李冬冬, 黄月玥, 韩晓日. 长期施肥对棕壤丛枝菌根真菌群落结构及其侵染的影响. 中国农业科学, 2018, 51: 4677–4689. Guo J, Luo P Y, Yang J F, Li D D, Huang Y Y, Han X R. Influence of long-term fertilization on community structures and colonization of arbuscular mycorrhizal fungi in a brown soil., 2018, 51: 4677–4689 (in Chinese with English abstract).
[13] 秦子娴, 朱敏, 郭涛. 干旱胁迫下丛枝菌根真菌对玉米生理生化特性的影响. 植物营养与肥料学报, 2013, 19: 510–516. Qin Z X, Zhu M, Guo T. Influence of mycorrhizal inoculation on physiological and biochemical characteristics of maize () under water stress.,2013, 19: 510–516 (in Chinese with English abstract).
[14] 朱先灿, 宋凤斌, 徐洪文. 低温胁迫下丛枝菌根真菌对玉米光合特性的影响. 应用生态学报, 2010, 21: 470–475. Zhu X C, Song F B, Xu H W. Effects of arbuscular mycorrhizal fungi on photosynthetic characteristics of maize under low temperature stress., 2010, 21: 470–475 (in Chinese with English abstract).
[15] Toljander J F, Santos-Gonzáles J C, Tehler A, Finlay R D. Community analysis of arbuscular mycorrhizal fungi and bacteria in maize mycorrhizosphere in a long-term fertilization trial., 2008, 65: 323–338.
[16] Bakhshandeh S, Corneoa P E, Mariotte P, Kertesza M A, Dijkstra F A. Effect of crop rotation on mycorrhizal colonization and wheat yield under different fertilizer treatments., 2017, 247: 130–136.
[17] Tian H, Drijber R A, Zhang J L, Li X L. Impact of long-term nitrogen fertilization and rotation with soybean on the diversity and phosphorus metabolism of indigenous arbuscular mycorrhizal fungi within the roots of maize (L.)., 2013, 164: 53–61.
[18] Williams A, Borjesson G, Hedlund K. The effects of 55 years of different inorganic fertiliser regimes on soil properties and microbial community composition., 2013, 67: 41–46.
[19] Duffková R, Fučík P, Jurkovská L, Janoušková M. Experimental evaluation of the potential of arbuscular mycorrhiza to modify nutrient leaching in three arable soils located on one slope., 2019, 143: 116–125.
[20] Wang X X, Wang X J, Sun Y, Cheng Y, Liu S T, Chen X P, Feng G, Kuyper T W. Arbuscular mycorrhizal fungi negatively affect nitrogen acquisition and grain yield of maize in a n deficient soil., 2018, 9: 418.
[21] 毕于运, 高春雨, 王亚静, 李宝玉. 中国秸秆资源数量估算. 农业工程学报, 2009, 25(12): 211–217. Bi Y Y, Gao C Y, Wang Y J, Li B Y. Estimation of straw resources in China., 2009, 25(12): 211–217 (in Chinese with English abstract).
[22] Soon Y K, Lupwayi N Z. Straw management in a cold semi-arid region: impact on soil quality and crop productivity., 2012, 139: 39–46.
[23] 张学林, 周亚男, 李晓立, 侯小畔, 安婷婷, 王群. 氮肥对室内和大田条件下作物秸秆分解和养分释放的影响. 中国农业科学, 2019, 52: 1746–1760. Zhang X L, Zhou Y N, Li X L, Hou X P, An T T, Wang Q. Effects of nitrogen fertilizer on crop residue decomposition and nutrient release under lab incubation and field conditions., 2019, 52: 1746–1760 (in Chinese with English abstract).
[24] Hodge A, Campbell C D, Fitter A H. An arbuscular mycorrhizal fungus accelerates decomposition and acquires nitrogen directly from organic material., 2001, 413: 297–299.
[25] 郭涛, 罗珍, 朱敏, 王晓峰. 丛枝菌根真菌对玉米秸秆降解的影响及其作用机制. 生态学报, 2014, 34: 4080–4087.Guo T, Luo Z, Zhu M, Wang X F. Compare different effect of arbuscular mycorrhizal colonization on maize straw degradation., 2014, 34: 4080–4087 (in Chinese with English abstract).
[26] Gui H, Hyde K, Xu J C, Mortimer P. Arbuscular mycorrhiza enhance the rate of litter decomposition while inhibiting soil microbial community development., 2017, 7: 42184.
[27] 王维华, 孙丹丹, 郑锦龙, 刘润进. AM真菌与作物秸秆对土壤养分和植物生长的影响. 青岛农业大学学报(自然科学版), 2018, 35(2): 83–89. Wang W H, Sun D D, Zheng J L, Liu R J. Effects of arbuscular mycorrhizal fungi and plant straw on soil nutrients and plant growth.(Nat Sci Edn), 2018, 35(2): 83–89 (in Chinese with English abstract).
[28] Köhl L, Marcel G A, Van D H. Arbuscular mycorrhizal fungal species differ in their effect on nutrient leaching., 2016, 94: 191–199.
[29] 王强, 王茜, 董梅, 王晓娟, 张亮, 金樑. 分室培养装置在丛枝菌根真菌研究中的应用及其发展. 植物生态学报, 2014, 38: 1250–1260. Wang Q, Wang Q, Dong M, Wang X J, Zhang L, Jin L. Application and progress of split-compartment facility in studies of arbuscular mycorrhizal fungi., 2014, 38: 1250–1260 (in Chinese with English abstract).
[30] Frey B, Schüepp H. Acquisition of nitrogen by external hyphae of arbuscular mycorrhizal fungi associated withL., 1993, 124: 221–230.
[31] Smith S E, Smith F A. Roles of arbuscular mycorrhizas in plant nutrition and growth: new paradigms from cellular to ecosystem scales., 2011, 62: 227–250.
[32] 祝英, 刘英霞, 巩晓芳, 陈应龙, 任爱天, 刘润进, 金樑, 熊友才. 3种丛枝菌根真菌与3种寄主植物的共生关系. 微生物学通报, 2016, 43: 527–533. Zhu Y, Liu Y X, Gong X F, Chen Y L, Ren A T, Liu R J, Jin L, Xiong Y C. Symbiosis between three arbuscular mycorrhizal fungi and three host plants., 2016, 43: 527–533 (in Chinese with English abstract).
[33] Walder F, Niemann H, Natarajan M, Lehmann M F, Boller T, Wiemken A. Mycorrhizal networks: common goods of plants shared under unequal terms of trade., 2012, 159: 789–797.
[34] Miransari M. Arbuscular mycorrhizal fungi and nitrogen uptake., 2011, 193: 77–81.
[35] Cavagnaro T R, Barrios-Masias F H, Jackson L E. Arbuscular mycorrhizas and their role in plant growth, nitrogen interception and soil gas efflux in an organic production system., 2012, 353: 181–194.
[36] Campos-Soriano L, Segundo B S. New insights into the signaling pathways controlling defense gene expression in rice roots during the arbuscular mycorrhizal symbiosis., 2011, 6: 553–557.
[37] Bonfante P, Genre A. Mechanisms underlying beneficial plant-fungus interactions in mycorrhizal symbiosis., 2010, 48: 1–11.
[38] 姜德峰, 蒋家慧, 李敏, 刘润进, 李晓林. AM菌对玉米某些生理特性和籽粒产量的影响. 中国农业科学, 1998, 31(1): 15–20. Jiang D F, Jiang J H, Li M, Liu R J, Li X L. Effects of arbuscular mycorrhizal fungi on physiological characteristics and grain yield of maize., 1998, 31(1): 15–20 (in Chinese with English abstract).
[39] 黄京华, 刘青, 李晓辉, 曾任森, 骆世明. 丛枝菌根真菌诱导玉米根系形态变化及其机理. 玉米科学, 2013, 21(3): 131–135. Huang J H, Liu Q, Li X H, Zeng R S, Luo S M. Mechanism of maize root morphology change induced by arbuscular mycorrhizal fungi., 2013, 21(3): 131–135 (in Chinese with English abstract).
[40] Liu R J, Li M, Meng X X, Liu X, Li X L. Effects of AM fungi on endogenous hormones in corn and cotton plants., 2000, 19: 91–96.
[41] Kaldorf M, Ludwig-Muller J. AM fungi might affect the root morphology of maize by increasing indole-3-butyric acid biosynthesis., 2000, 109: 58–67.
[42] Craine J M, Morriw C, Fierer N. Microbial nitrogen limitation increases decomposition., 2007, 88: 2105–2113.
[43] Hobbie S E. Nitrogen effects on decomposition: a five-year experiment in eight temperate sites., 2008, 89: 2633–2644.
[44] Whiteside M D, Treseder K K, Atsatt P R. The brighter side of soils: quantum dots track organic nitrogen through fungi and plants., 2009, 90: 100–108.
[45] 贾艳艳, 顾大路, 杨文飞, 吴传万, 孙爱侠, 诸俊, 王伟中, 杜小凤. 丛枝菌根真菌对还田麦秆分解及玉米生物量的影响. 江苏农业学报, 2019, 35: 612–617.Jia Y Y, Gu D L, Yang W F, Wu C W, Sun A X, Zhu J, Wang W Z, Du X F. Effects of arbuscular mycorrhizal fungi colonization on wheat-straw decomposition and maize biomass., 2019, 35: 612–617 (in Chinese with English abstract).
Effects of arbuscular mycorrhizal fungi on grain yield and nitrogen uptake in maize
ZHANG Xue-Lin*, LI Xiao-Li, HE Tang-Qing, ZHANG Chen-Xi, TIAN Ming-Hui, WU Mei, ZHOU Ya-Nan, HAO Xiao-Feng, and YANG Qing-Hua
Agronomy College, Henan Agricultural University / Co-construction State Key Laboratory of Wheat and Maize Crop Science / Collaborative Innovation Center of Henan Grain Crops, Zhengzhou 450002, Henan, China
Clarifying the role of arbuscular mycorrhizae fungi (AMF) in yield of maize grain and associated nitrogen (N) uptake can inform the application of organic fertilizer in farmland, thus, improving nutrient use efficiency, enhancing crop resistance to biotic or abiotic stress, and increasing overall crop yield. A 3-factor experiment was designed and carried out during the maize growing season in 2016 and 2017. The factors were as follows: (1) N fertilizer addition (180 kg hm–2[N180] and 360 kg hm–2[N360]), (2) wheat straw addition (without straw: S0 and with straw: S1), and (3) three mycorrhizal treatments, including a control (M0, roots and AMF could not enter the hyphal chamber from the growth chamber), an AMF treatment (M1, only AMF can enter the hyphal chamber from the growth chamber), and a root treatment (M2, both roots and AMF can enter the hyphal chamber from the growth chamber). Maize grain yield, plant biomass, N uptake, and root variables were measured. All three factors had a significant effect on maize yield and N uptake. N360 treatment of N fertilizer significantly increased maize yield and their N accumulation compared with N180 treatment. In the case of straw treatment, the grain yield reduced by 6% than that of the treatment without straw, whereas soil inorganic N increased by 129%. For the N180 treatment, mean maize yield of M1 and M2 treatments were 38% and 82% higher than M0, respectively; for the N360 treatment, these were 16% and 48%, respectively. The contribution of AMF to grain yield was higher for N180 than for N360. The AMF treatment increased maize ear length, grain number per row, and total root length independent of straw addition, but the ability of AMF to improve root biomass and N uptake was significantly higher with straw addition than without straw. M1 and M2 treatments significantly increased grain number per row, grain number per spike, plant biomass, N accumulation, and total root length relative to the M0, whereas inorganic soil N declined significantly. The contribution of AMF to maize yield was higher than M0 under conditions of both N180 and straw addition. Correlation analysis and structural equation revealed that N application and AMF significantly increased maize yield. The results showed that AMF could improve maize root properties, enhance N absorption capacity, improve ear traits, and increase maize grain yield under different N application rates and straw conditions.
crop residue; arbuscular mycorrhizal fungi; nitrogen fertilizer management; maize yield; nutrient absorption
10.3724/SP.J.1006.2021.03050
本研究由河南省自然科学基金项目(182300410013), 国家重点研发计划项目(2018YFD0200605)和河南农业大学科技创新基金(30500712)资助。
This study was supported by the Natural Science Foundation of Henan Province (182300410013), the National Key Research and Development Program of China (2018YFD0200605), and the Science and Technology Innovation Fund of Henan Agricultural University (30500712).
张学林, E-mail: xuelinzhang1998@163.com, zxl1998@henau.edu.cn
2020-08-24;
2021-01-13;
2021-03-01.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20210301.1319.006.html

