Sirt1抑制由ox-LDL诱导的人冠状动脉内皮细胞的炎症反应
魏明慧,孙浩荣,王静文,薛明明*
(内蒙古医科大学,内蒙古 呼和浩特 010059)
动脉粥样硬化(atherosclerosis,AS)是心脏病、外周血管病、脑血管病等疾病的重要发病机制[1]。AS的发病率居高不下,是世界上最重要的公共卫生问题之一。中国AS的发病率也急剧上升[2]。研究表明炎症反应参与AS发病的各个阶段,在初期表现为急性渗出性炎症,在晚期以慢性增生性炎症为特征[3]。因此,抑制炎症可能成为治疗AS的有效方法。研究报道[4]氧化型低密度脂蛋白(oxidized lowdensity lipoprotein,ox-LDL)与AS、高血压、冠状动脉及外周动脉疾病、急性冠脉综合征等心血管疾病密切相关,是AS的独立危险因素。沉默信息调节因子(silent information regulator,Sirt)1作为SIRT蛋白家族中最具代表性的因子,具有脱乙酰酶活性,可修饰脂质,促进自噬,减轻炎症,改善血管内皮细胞功能[5]。本文利用人冠状动脉内皮细胞(human coronary endothelial cells,HCAEC)建立ox-LDL诱导的AS细胞模型,探讨Sirt1对HCAEC炎症反应的影响。以期为AS的治疗提供新的药物靶点和理论依据。
1 材料与方法
1.1 材料
HCAEC、ECM内皮细胞培养基购自美国Sciencell公司;ox-LDL购自上海翊圣生物科技有限公司;GV146-SIRT1过表达质粒(货号:POSE146071634)、GV102-SIRT1干扰质粒(货号:PIEE102071634)购自上海吉凯基因有限公司;总RNA提取试剂盒购自北京TIANGEN生化科技有限公司(货号:RP120227),Lipofectamine™2000 Transfection Reagent(货号:11668019)购自Thermo Fisher科技(中国)有限公司,Anti-GAPDH抗体-Loading Control(货号:ab9485)、重组Anti-SIRT1抗体[EPR18239](货号:ab189494)、重组Anti-ICAM1抗体[EP1442Y](货号:ab53013)均购自Abcam上海有限责任公司;Dylight800,Goat Anti-Rabbit IgG(货号:A23920)购自Abbkine公司;人hs-CRP ELISA试剂盒、人IL-1 ELISA试剂盒购自深圳达科为生物工程有限公司;TransStart Tip Green qPCR SuperMix、PrimeScript RT Master Mix、RNAiso Plus购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 细胞培养将HCAEC中加入含10%FBS的ECM培养基并置于37℃,5%CO2培养箱内,每隔24h采用半数换液原则弃掉一半培养基再加入一半新的含10%FBS的ECM培养基,当细胞融合度约为85%~90%并处于对数生长期时,以1:2的比例进行传代培养。
1.2.2 四噻唑蓝(MTT)比色法检测细胞生存率 将HCAEC以1×104/mL的浓度稀释,接种在96孔板中,每孔100μL。在37℃,5%CO2的条件下培养24h。用ECM培养基稀释250mg/Lox-LDL,制备25mg/L ox-LDL、50mg/Lox-LDL组、100mg/L ox-LDL组、200mg/L ox-LDL四个浓度,用ECM培养基稀释PBS磷酸盐缓冲液制备与200mg/Lox-LDL同等条件的PBS培养液。取出生长24h的贴壁细胞,弃去各孔中原培养液,每孔加入100L含各浓度ox-LDL的ECM培养基,每个浓度设置3个复孔,37℃、5%CO2条件下继续培养24h。在每孔中加入20μL 5mg/mL的MTT溶液;继续放入培养箱中避光培养4h,弃上清,各孔加入100μL DMSO,振荡10min;全波长酶标仪上测定每孔在450nm处OD值。根据公式:细胞存活率=(样本孔OD值—空白孔OD值)/(正常对照孔OD值—空白孔OD值)计算各浓度下细胞存活率。
1.2.3 细胞转染与实验分组 取对数生长期的HCAEC,以每孔2.5×105个细胞接种于24孔板中,每组三个复孔。正常对照组细胞常规培养;空质粒+正常对照组细胞转染空载质粒;空质粒+ox-LDL组转染空载质粒并用100 mg/L ox-LDL诱导HCAEC损伤,建立AS细胞模型;Sirt1过表达+ox-LDL组、Sirt1干扰+ox-LDL组分别转染Sirt1过表达和Sirt1干扰重组质粒并用100 mg/L ox-LDL诱导HCAEC损伤,建立AS细胞模型。用LipofectamineTM2000转染试剂介导质粒转染,48h后在荧光显微镜下观察各组细胞转染情况。
1.2.4 qRT-PCR检测Sirt1和ICAM-1的mRNA表达水平 提取各组细胞总RNA,逆转录的cDNA为模板,构建20μL的反应体系,使得正反向引物的终浓度为0.3M;设定95℃,15min预变性;95℃,10s,60℃,32s共40个循环进行变性、退火、延伸并采用7500 Fast检测系统、SuperReal PreMix Plus、表1中的引物序列进行聚合酶链式反应。使用2-ΔΔCt对qPCR结果进行定量,以GAPDH作为内参,每个样品重复3次。

表1 用于荧光定量聚合酶链式反应的引物序列Fig.1 Primers sequences used for reverse-transcription quantitative polymerase chain reaction analysis.
1.2.5 Western Blot分析Sirt1、ICAM-1的蛋白表达水平 用含有1%蛋白酶抑制剂(PMSF)的蛋白裂解液RIPA充分裂解细胞,并将裂解物在4℃下12000r离心20min取上清;将等量的蛋白以每孔10μg的量进行SDS-PAGE凝胶电泳,电转移到PVDF膜上;在室温下用5%脱脂牛奶封闭1.5h,并在4℃分别用Anti-GAPDH抗体-Loading Control(货号:ab9485)、重组Anti-SIRT1抗体[EPR18239(]货号:ab189494)、重组Anti-ICAM1抗体[EP1442Y](货号:ab53013)以1:1000的比例稀释后孵育过夜;最后将膜与Dylight800,Goat Anti-Rabbit IgG(货号:A23920)室温孵育2h,并用双色红外激光成像系统(LI-COR公司)进行扫膜成像;结果用目的基因的灰度值/GAPDH的灰度值表示。
1.2.6 ELISA法检测IL-1、hs-CRP表达 用无菌EP管收集各组的上清液,以10μL/孔加入样本孔内,再加入40μL样本稀释液;标准品孔各加不同浓度的标准品50μL;随后在每孔内加入辣根过氧化氢酶标记的检测抗体100μL 37℃水浴60min;弃去孔内液体,用洗涤液洗板5次;每孔加入底物A、B各50L37℃避光孵育15min;最后每孔加入50uL终止液,在450nm波长处测定各孔OD值;根据标准品孔的OD值绘制标准曲线,并将样本孔的OD值代入到标准曲线,计算样本孔IL-1、hs-CRP的浓度。
1.3 统计学分析
所有实验数据用来表示并利用SPSS 22.0进行统计学分析。多组间比较用单因素方差分析,组间的两两比较用独立样本t检验。P<0.05认为差异有统计学意义。
2 结果
2.1 100 mg/L ox-LDL成功诱导HCAEC构建AS细胞模型
将正常对照组的细胞存活率定为100%,而其他组的细胞存活率以对照组的百分比表示;MTT试验结果显示,与正常对照组相比,PBS对照组的细胞存活率无显著差异(P>0.05)。然而,随着ox-LDL浓度的进一步增加,细胞存活率逐渐降低,在200 mg/L ox-LDL组细胞存活率显著降低(P<0.05)(见图1)。这些结果表明ox-LDL以剂量依赖的的方式降低细胞存活率。因此,在以下实验中排除200mg/L ox-LDL组。为了进一步筛选出诱导炎症的最适ox-LDL浓度,通过qRT-PCR和Western Blot检测了诱导炎症部位黏连性的ICAM-1表达的变化;ELISA法检测各组细胞上清中炎症因子IL-1、hs-CRP的表达变化。与正常对照组相比,50 mg/L ox-LDL组ICAM-1的mRNA以及蛋白显著升高(P<0.05),而100 mg/L ox-LDL组升高更为显著(P<0.01)。然而,其他组与正常对照比较均无显著差异(见表2,图2)。与对照组相比,上清液中炎症因子IL-1、hs-CRP蛋白表达量在100 mg/L ox-LDL组均显著升高(P<0.01),IL-1蛋白表达量在50mg/L ox-LDL组也显著升高(P<0.05),但没有100 mg/L ox-LDL组升高明显,其余组与正常对照组间也无显著差异(见表3)。

图1 不同浓度ox-LDL对细胞存活率的影响Fig.1 Effects of different concentrations of ox LDL on cell viability
表2 各组HCAEC中ICAM-1的mRNA表达情况(±s)Tab.2 Expression of ICAM-1 mRNA in HCAECof each group(±s)
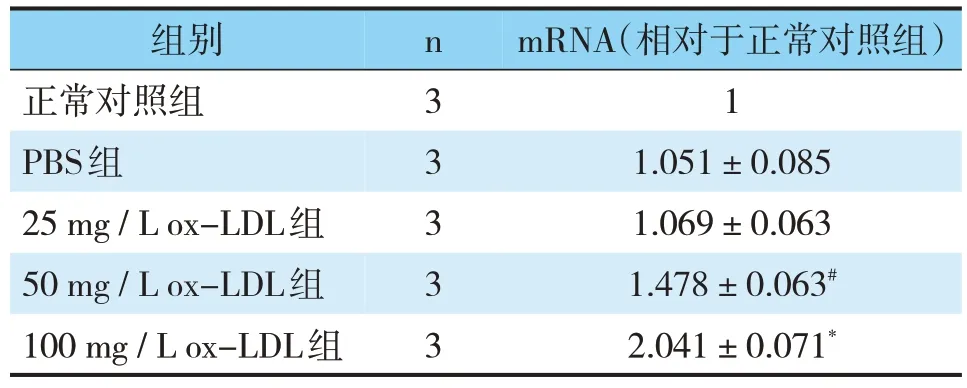
表2 各组HCAEC中ICAM-1的mRNA表达情况(±s)Tab.2 Expression of ICAM-1 mRNA in HCAECof each group(±s)
注:与正常对照组比较,#P<0.05,*P<0.01
组别nmRNA(相对于正常对照组)正常对照组31 PBS组31.051±0.085 25 mg/L ox-LDL组31.069±0.063 50 mg/L ox-LDL组31.478±0.063#100 mg/L ox-LDL组32.041±0.071*

图2 不同浓度ox-LDL对ICAM-1蛋白表达的影响Fig.2 Effects of different concentrations of ox-LDL on ICAM-1 protein expression
表3 各组细胞上清液中炎症因子的比较(±s)Tab.3 Comparison of inflammatory factors in cell supernatan(t±s)
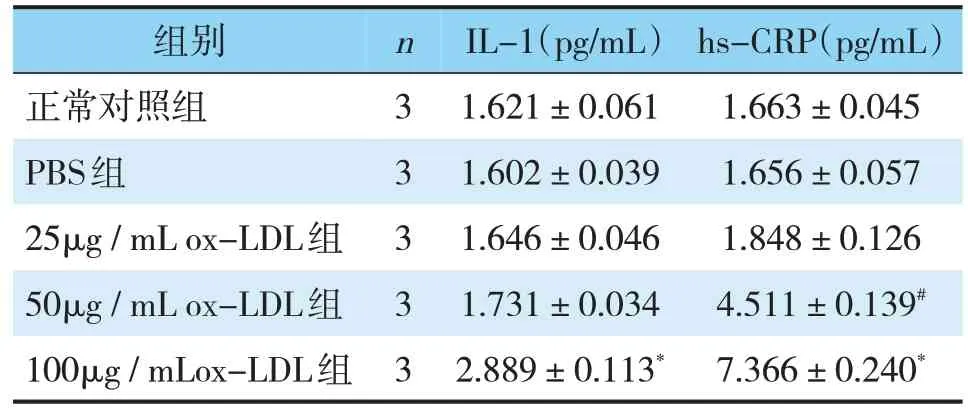
表3 各组细胞上清液中炎症因子的比较(±s)Tab.3 Comparison of inflammatory factors in cell supernatan(t±s)
注:与正常对照组比较,#P<0.05,*P<0.01
组别nIL-1(pg/mL)hs-CRP(pg/mL)正常对照组31.621±0.0611.663±0.045 PBS组31.602±0.0391.656±0.057 25μg/mL ox-LDL组31.646±0.0461.848±0.126 50μg/mL ox-LDL组31.731±0.0344.511±0.139#100μg/mLox-LDL组32.889±0.113*7.366±0.240*
2.2 Sirt1成功转入AS模型细胞并表达
重组质粒含有EGFP绿色荧光报告基因,转染48 h后转染了空质粒、Sirt1干扰、Sirt1过表达的细胞在荧光显微镜下可见绿色荧光标记。而正常对照组的细胞未见绿色荧光(见图3)。为了进一步验证目的基因Sirt1是否成功表达,通过qRT-PCR和Western Blot检测各组细胞Sirt1的表达情况。正常对照组细胞与转染空质粒的对照组间无显著差异(见表4,图4)。与转染空质粒的对照组相比,转染空质粒的模型组Sirt1 mRNA及蛋白表达量显著降低(P<0.05)。与转染空质粒的模型组相比,转染Sirt1过表达质粒的模型组Sirt1 mRNA及蛋白表达量显著升高(P<0.05),而转染干扰质粒的模型组Sirt1 mRNA及蛋白表达量则显著降低(P<0.05)。

图3 各组细胞质粒转染情况.标尺:500μm.Fig.3 Plasmid transfection in each group.Scale:500μm.
表4 各组细胞中Sirt1的mRNA和蛋白表达情况(±s)Tab.4 Expression of Sirt1 mRNAand protein in each group(±s)
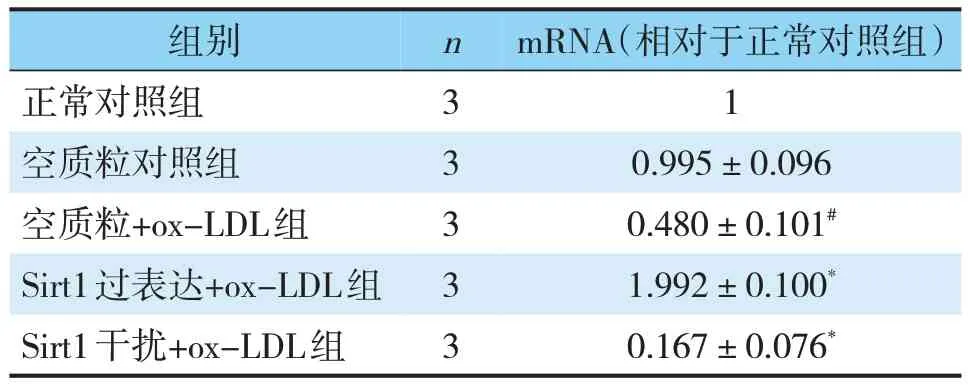
表4 各组细胞中Sirt1的mRNA和蛋白表达情况(±s)Tab.4 Expression of Sirt1 mRNAand protein in each group(±s)
注:与空质粒对照组比较,#P<0.05;与空质粒+ox-LDL组比较,*P<0.05
组别nmRNA(相对于正常对照组)正常对照组31空质粒对照组30.995±0.096空质粒+ox-LDL组30.480±0.101#Sirt1过表达+ox-LDL组31.992±0.100*Sirt1干扰+ox-LDL组30.167±0.076*

图4 各组细胞Sirt1蛋白的表达Fig.4 Expression of Sirt1 protein in each group
2.3 S irt1减轻ox-LDL诱导的HCAEC炎症反应
为了证实Sirt1对于ox-LDL诱导的HCAEC炎症反应的影响,通过qRT-PCR和Western Blot检测了促进炎症部位黏连的ICAM-1。正常对照组与空质粒对照组间无显著差异;与空质粒对照组相比,空质粒+ox-LDL组ICAM-1 mRNA表达水平显著升高(P<0.05);与空质粒+ox-LDL组比较,Sirt1过表达+ox-LDL组ICAM-1 mRNA表达水平显著降低,而Sirt1干扰+ox-LDL组则显著升高(P<0.05)。这些结果通过Western Blot得到了进一步证实(见图5)。此外通过ELISA法检测各组细胞上清中炎症因子IL-1、hs-CRP表达水平,与空质粒对照组相比,空质粒+ox-LDL组IL-1、hs-CRP表达水平升高(P<0.05);与空质粒+ox-LDL组比较,Sirt1过表达+ox-LDL组IL-1、hs-CRP表达水平显著降低,而Sirt1干扰+ox-LDL组IL-1、hs-CRP表达水平则显著升高(P<0.05)(见表6)。
表5 各组HCAEC中ICAM-1 mRNA及蛋白的表达情况(±s)Tab.5 Expression of ICAM-1 mRNA and protein in HCAEC of each group(±s)

表5 各组HCAEC中ICAM-1 mRNA及蛋白的表达情况(±s)Tab.5 Expression of ICAM-1 mRNA and protein in HCAEC of each group(±s)
注:与空质粒对照组比较,#P<0.05;与空质粒+ox-LDL组比较,*P<0.05
组别nmRNA(相对于正常对照组)正常对照组31空质粒对照组31.007±0.007空质粒+ox-LDL组32.182±0.496#Sirt1过表达+ox-LDL组30.542±0.150*Sirt1干扰+ox-LDL组36.574±0.524*

图5 各组细胞ICAM-1蛋白的表达Fig.5 Expression of ICAM-1 protein in each group
表6 各组HCAEC中IL-1、hs-CRP水平的比较(±s)Tab.6 Comparison of IL-1 and hs-CRP levels in HCAEC of each group(±s)
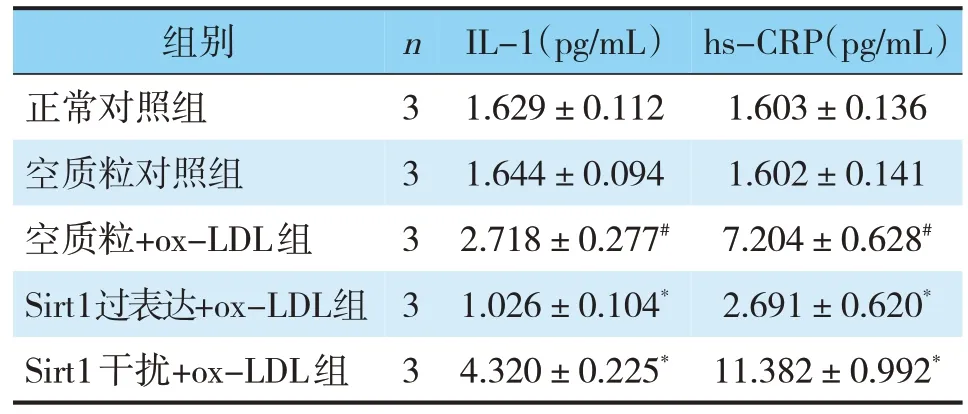
表6 各组HCAEC中IL-1、hs-CRP水平的比较(±s)Tab.6 Comparison of IL-1 and hs-CRP levels in HCAEC of each group(±s)
注:与空质粒对照组比较,#P<0.05;与空质粒+ox-LDL组比较,*P<0.05
组别nIL-1(pg/mL)hs-CRP(pg/mL)正常对照组31.629±0.1121.603±0.136空质粒对照组31.644±0.0941.602±0.141空质粒+ox-LDL组32.718±0.277#7.204±0.628#Sirt1过表达+ox-LDL组31.026±0.104*2.691±0.620*Sirt1干扰+ox-LDL组34.320±0.225*11.382±0.992*
3 讨论
尽管血液中存在大量的抗氧化剂,但ox-LDL不仅可以在动脉粥样硬化斑块中被发现,而且在血浆或血清中也大量存在,因此ox-LDL被作为心血管疾病的血清学标志物[6]。我们分别用25 mg/L、50 mg/L、100 mg/L、200 mg/L ox-LDL刺激HCAEC,结果发现在200 mg/L ox-LDL的诱导下显著降低了细胞的存活率,而100 mg/L ox-LDL能够诱导HCAEC产生炎症因子ICAM-1、IL-1、hs-CRP,并且没有显著影响细胞存活率。这与Zu F等人在ox-LDL诱导的微粒通过ICAM-1促进内皮单核细胞粘附的研究中相符[7]。因此我们选用100 mg/L ox-LDL刺激HCAEC,在体外建立AS细胞模型。
目前,Sirt1在脂肪组织炎症中起着屏障作用,在抗炎过程中占有重要地位[8]。在本研究中,我们选用Sirt1基因过表达和干扰重组质粒,选择毒性较小的脂质体转染法介导Sirt1转染于AS细胞模型,并通过质粒携带的EGFP绿色荧光标记及qRTPCR、Western blot实验判断Sirt1转染效率。白细胞介素-1(interleukin-1,IL-1)可以诱导人血管内皮细胞的各种炎症功能,包括促凝血活性、粘附分子表达增加、白细胞募集和单核细胞趋化蛋白-1的产生[9]。高敏C反应蛋白(high sensitive C-reactive protein,hs-CRP)由于其对心血管疾病早期预测的灵敏性高而得名[10]。hs-CRP被认为在早期AS患者中显著增加,并与疾病严重程度及其并发症相关,因此常被作为AS的预测因子[11]。细胞间黏附分子-1(intercellular cell adhesion molecule,ICAM-1)是一种介导黏附反应的重要分子。Marzolla等人研究发现,内皮细胞盐皮质激素受体可转录调控ICAM-1的表达促进由醛固酮诱导的动脉粥样硬化[12]。因此,本实验选用以上三种在AS的发生发展中具有代表性的炎症因子作为研究对象探讨Sirt1在HCAEC内发挥的抗炎作用。我们发现,Sirt1过表达能显著抑制炎症因子IL-1、hs-CRP及ICAM-1的表达,Sirt1干扰则显著促进了炎症因子IL-1、hs-CRP及ICAM-1的表达。因此我们认为Sirt1在体外AS模型细胞中发挥抗炎作用。
综上所述,体外实验结果表明Sirt1可能在HCAEC中抑制由ox-LDL诱导的炎症反应,进而对人冠状动脉内皮细胞起到保护作用。但其具体机制仍有待于我们的进一步研究。
——一道江苏高考题的奥秘解读和拓展

