p53、p16和Ki67在卵巢上皮性癌中的表达及其临床病理意义
曹 琛,李时荣,徐晓艳
(1.内蒙古医科大学,内蒙古 呼和浩特 010059;2.内蒙古医科大学附属医院病理科)
在妇科癌症中,卵巢癌是导致死亡的首要原因,大多数妇女出现临床症状就诊已为卵巢癌晚期(国际妇科和产科联合会[FIGO]第三阶段),这在40~60岁中年妇女中很常见,因为其临床缺乏特异性早期症状和成熟早期诊断方法,其发病率呈逐年升高和年轻化趋势,因其通常在晚期确诊,外科治疗被放化疗取代。五年存活率仅有29%[1],其中卵巢上皮性肿瘤在卵巢恶性肿瘤中最为普遍。常见的卵巢上皮性癌组织类型有浆液性、粘液性、子宫内膜样和透明细胞癌,其中浆液性癌最多见。研究新的诊断和预测指标以及早期治疗,对我们临床工作至关重要。p53是早期人类发现的抑癌基因,其发生突变在癌细胞中会预后不良。p16基因有调节细胞周期,抑制细胞增殖和分裂的功能。Ki67蛋白是一种与肿瘤细胞增殖有关的最具代表性的核抗原,有丝分裂与其功能密切相关。国内外均有对p53、p16和Ki67在卵巢上皮性癌中阳性表达的研究,但临床特异性不高,且没有对三者联合表达的分析,因此本研究采用免疫组织化学方法检测收集到标本的p53突变、p16和Ki67高表达情况,分析其与临床病理特征的关系和三者之间的相关性及三者联合诊断性能,探讨三种基因在卵巢上皮性癌恶变过程中参与性及临床意义,为卵巢上皮性癌的诊断和预后提供理论依据。
1 对象和方法
1.1 研究对象
收集保存于内蒙古医科大学附属医院病理科2016-01~2018-12蜡块标本,其中20例同时段因卵巢囊肿等原因接受治疗的卵巢良性肿瘤组织,平均年龄43岁。60例卵巢上皮性癌,按组织分型有40例浆液性囊腺癌、8例黏液性囊腺癌、7例子宫内膜样癌和5例透明细胞癌;按组织级别分有21例卵巢癌低级别和39例卵巢癌高级别;根据FIGO分级,34例归为Ⅰ期/Ⅱ期、26例归为Ⅲ/Ⅳ期。所有患者均确诊并行手术治疗,术前未接受过其他抗肿瘤治疗,且组织标本采集均经患者及家属知情同意,年龄25~69岁。
1.2 研究方法
1.2.1 试剂和仪器p53(MX008),p16(MX007)和Ki67(MX006)抗体工作液,EDTA抗原修复液,SP免疫组化试剂盒及DAB显色试剂盒均由福州迈新公司购得,以PBS代替一抗作空白对照,采用生物公司提供的阳性切片作为阳性对照。
1.2.2 p53,p16和Ki67的表达检测 用免疫组化法检测表达情况,通过经验丰富病理医生复查核实病理诊断与分级。搜集蜡块标本进行4μm连续石蜡切片,置于粘附载玻片留作免疫组化,于75℃恒温烤片机上烤片1h,二甲苯脱蜡,酒精梯度下行水化,按SP免疫组化试剂盒说明书操作,EDTA抗原修复液高温修复5min,湿盒放于37℃恒温箱孵育一抗,二抗,DAB显色,苏木素复染,盐酸分化,反蓝,酒精梯度上行脱水,二甲苯固定,封片,镜下观察。对p53、p16和Ki67表达与年龄,组织学类型,分级,FIGO分期的关系及其三者之间的相关性和联合诊断性能进行分析。
1.3 结果判定
1.3.1 p53基因判定方法p53阳性表达定位于胞核,随机在镜下选取5个高倍视野(400*),根据阳性细胞所占比例及阳性表达颜色1)0分:阳性细胞小于5%,无色2)1分:阳性细胞在5%~25%淡黄色3)2分:阳性细胞在25-50%,浅棕色4)3分:阳性细胞在50%~75%,深棕色5)4分:阳性细胞大于75%。两项乘积:≤4分野生型,高水平p53蛋白表达(>4分)和在卵巢癌中全阴性表达(0分,无义突变)作为突变型p53存在。
1.3.2 p16基因判定方法p16阳性表达为棕黄色,定位于胞质和胞核,镜下高倍视野(400*)斑驳弱阳性染色为低表达,弥漫强阳性染色为高表达。
1.3.3 Ki67的蛋白判定方法Ki67阳性表达定位于胞核,为褐黄色,镜下热点区域的高倍视野(400*)按阳性细胞比例判定增值率,≤50%为低表达,>50%为高表达。
1.4 统计学处理
统计学分析使用SPSS 22.0统计软件,采用χ2检验,Spearman等级相关方法对基因表达与临床病理指标关系及基因表达相互关系进行相关性分析。利用双侧检验,检验水准为α=0.05,P<0.05说明差异具有统计学意义。
2 结果
2.1 p53,p16和Ki67在不同卵巢组织的表达
卵巢癌组的p53突变率高于非卵巢癌组(见图1B),两类别的表达差异有统计学意义;在卵巢癌组中,p16和Ki67强阳性表达率明显高于非卵巢癌组(见图1C、D),表达差异有统计学意义(P<0.05)(见表1)。
2.2 p53、p16和Ki67在常见上皮性卵巢癌组织中的表达与临床病理特征的关系
p53、p16和Ki67在60例卵巢癌组织病患中的表达与年龄有显著相关性(P<0.05)。年龄越大,p53突变率越高、p16和Ki67的高表达率也越高。浆液性癌中p53突变率70%(见图1F),p16高表达率68%(见图1G),Ki67的高表达率70%(见图1H);p53在粘液性癌突变率13%(见图1J),p16高表达率13%(见图1K),Ki67的高表达率13%(见图1L);子宫内膜癌p53突变率14%(见图1N),p16高表达率43%(见图1O),Ki67的高表达率57%(见图1P);透明细胞癌p53突变率20%(见图1R),p16高表达率60%(见图1S),Ki67的高表达率60%(见图1T)。突变型p53表达多见于浆液性癌,p16弥漫阳性表达多见于浆液性癌和透明细胞癌,Ki67强阳性除粘液性癌基本在各类型上皮样癌均多见,其表达与组织分型有显著相关性(P<0.05)。Ⅰ~Ⅱ期p53突变率26%,p16强阳性率41%,Ki67的强阳性率44%;Ⅲ~Ⅳ期p53突变率85%,p16强阳性率77%,Ki67的强阳性率81%。组织级别和FIGO分期与它们的表达也密切相关(P<0.05),组织级别越高,分期越高,突变率高表达率越高(见表2)。
2.3 p53、p16和Ki67在卵巢上皮性癌组织中表达的相关性
在60例卵巢癌组织病例中,经相关分析p53突变与p16的高表达呈正相关(r=0.585,P=0.000<0.05)(见表3);p53突变与Ki67高表达有显著相关性且呈正相关(r=0.572,P=0.000<0.05)(见表4);Ki67与p16的高表达有显著性差异且呈正相关(r=0.590,P=0.000<0.05)(见表5)。
2.4 p53、p16和Ki67对卵巢上皮性癌诊断的性能
p53、p16和Ki67单项指标对卵巢上皮性癌诊断的灵敏度小于两项指标联合,两项指标又小于三项指标联合诊断灵敏度,且其中p53、p16和Ki67三项联合灵敏度最高(0.72)(见表6)。
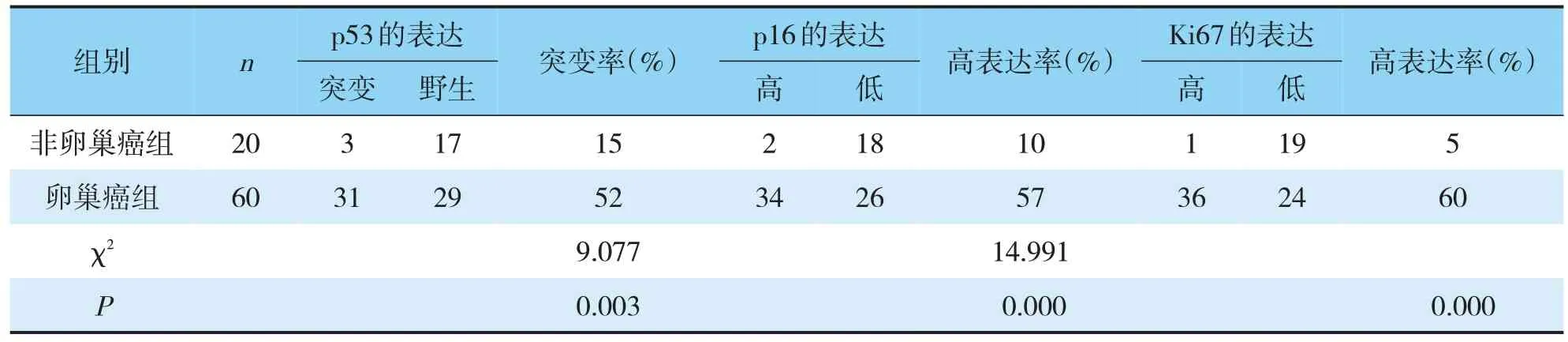
表1 在正常卵巢癌组织、卵巢癌组织中Ki67、p53和p16的表达Tab.1 Expression of Ki67,p53 and p16 in normal ovarian cancer tissues and ovarian cancer tissues
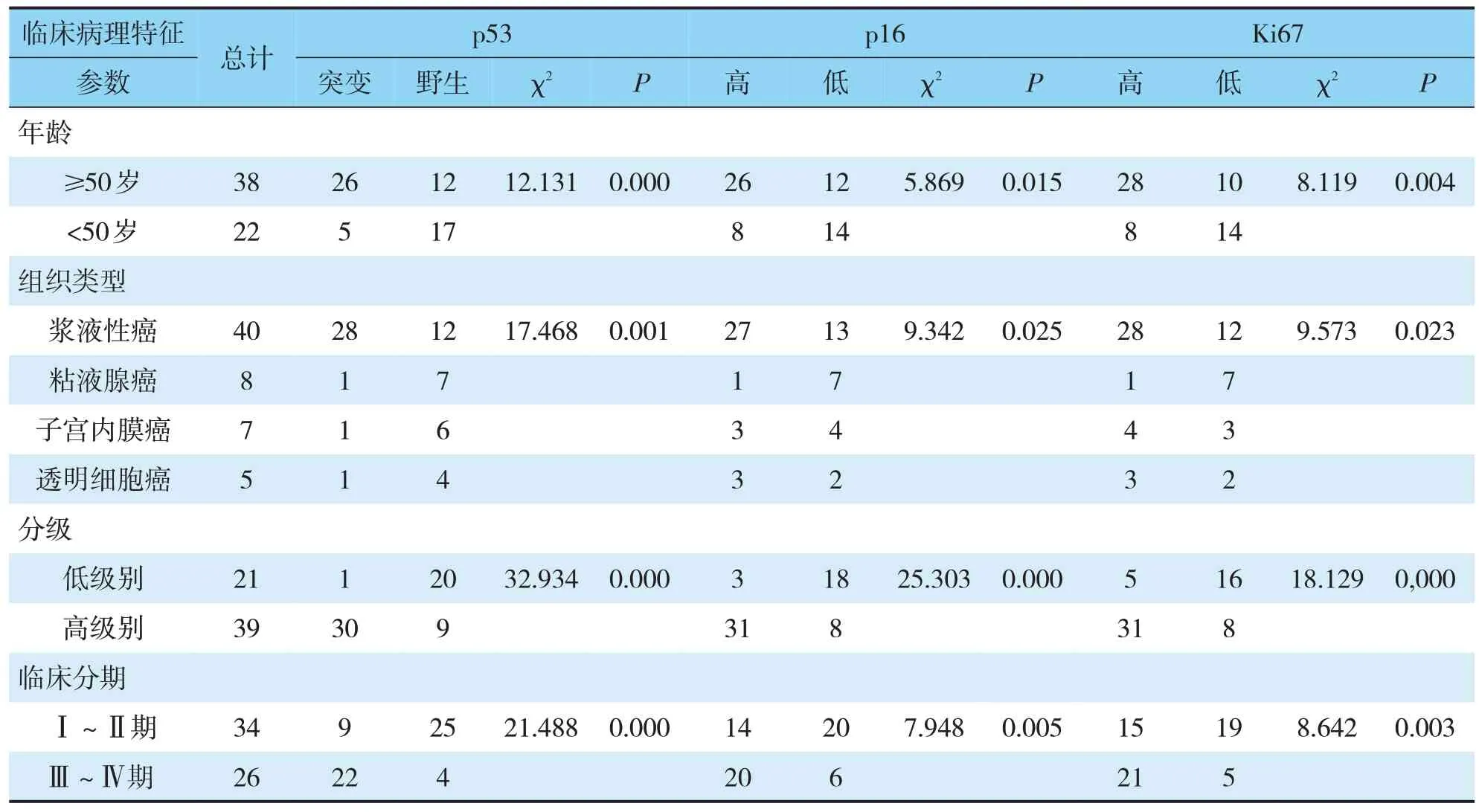
表2 p53、p16和Ki67在卵巢上皮性癌的表达与临床病理特征的关系Tab.2 Expression of p53,p16 and Ki67 in epithelial ovarian carcinoma and their relationship with clinicopathological features
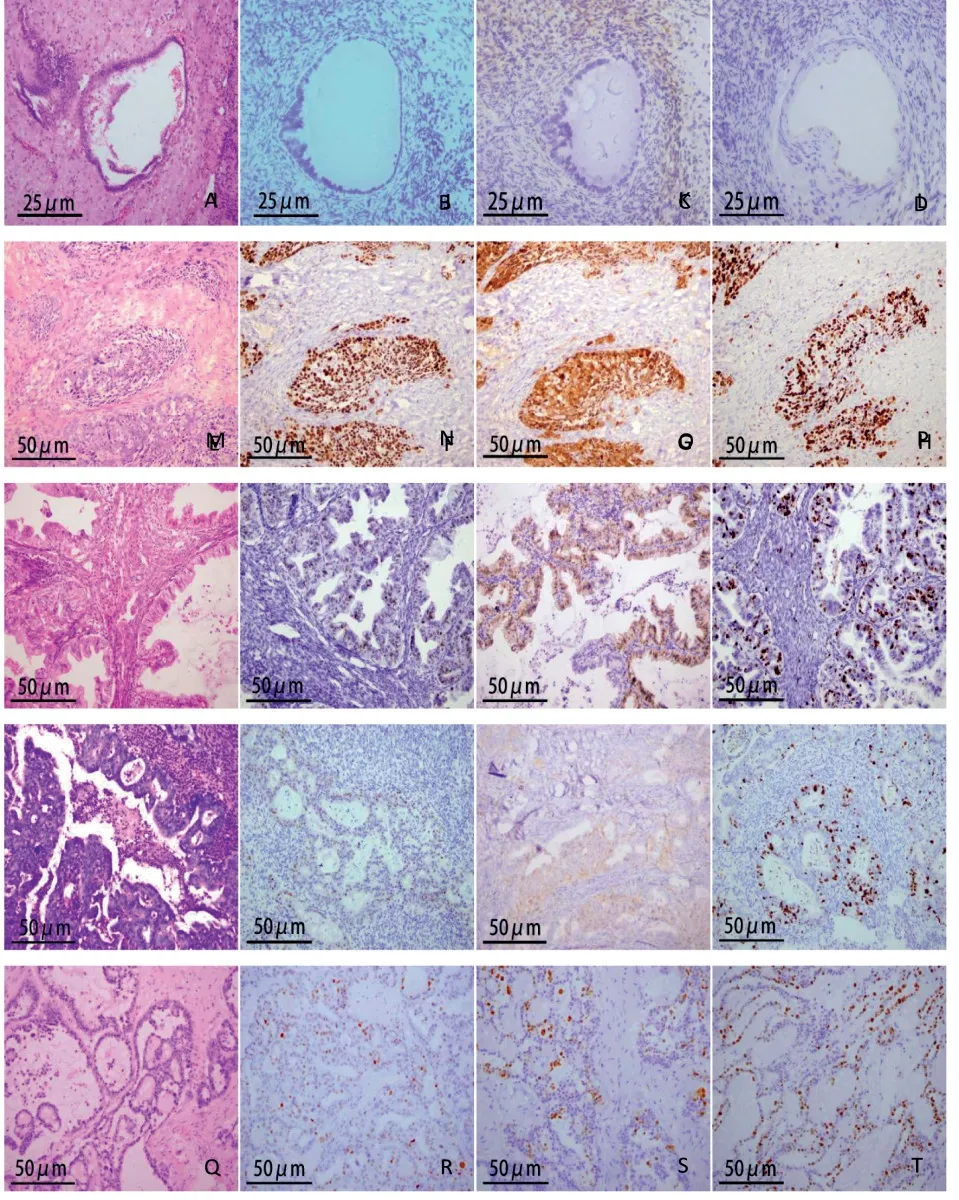
图1 p53、p16及Ki67在各型上皮性卵巢癌中表达的免疫组织化学分析Fig.1 Immunohistochemical analysis of the expression of p53,p16 and Ki67 in epithelial ovarian carcinoma

表3 p53与p16在卵巢上皮性癌中表达的相关性Tab.3 Correlation between p53 and p16 expression in epithelial ovarian cancer
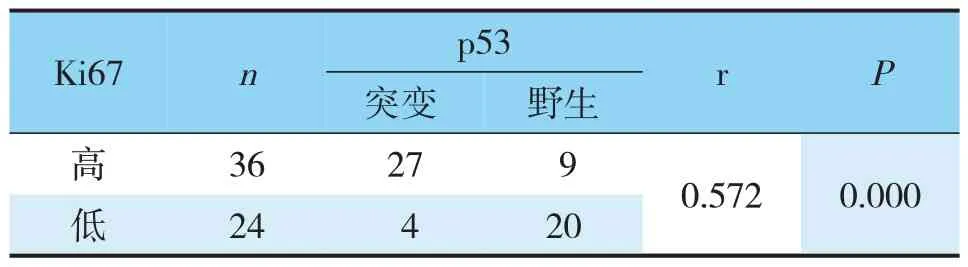
表4 Ki67与p53在卵巢上皮性癌中表达的相关性Tab.4 Correlation between Ki67 and p53 expression in epithelial ovarian cancer

表5 Ki67与p16在卵巢上皮性癌中表达的相关性Tab.5 Correlation between Ki67 and p16 expression in epithelial ovarian cancer
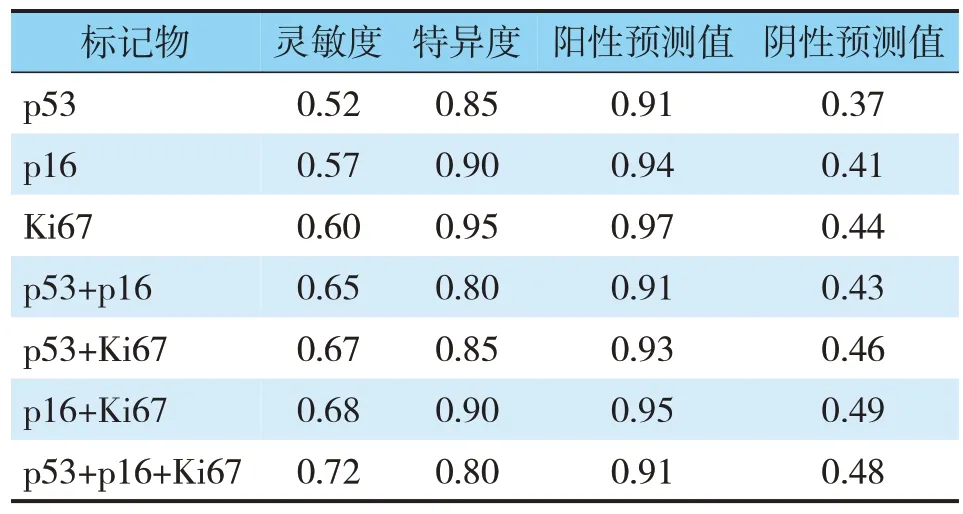
表6 p53、p16和Ki67对卵巢上皮性癌诊断的性能比较Tab.6 Comparison of p53,p16 and Ki67 in the diagnosis of epithelial ovarian cancer
3 讨论
卵巢癌是一种女性高死亡率的恶性肿瘤。其中绝大部分是卵巢上皮性癌,容易广泛转移和频繁复发,需要长期随访监测。大多数妇女是在晚期诊断出的。卵巢癌患者手术后最初对化疗有反应,但仅限于早期患者,大多数患者会由于卵巢癌细胞对治疗措施的抵抗性而复发,其无病间隔会逐渐缩短,而逐渐死于化疗耐药。卵巢上皮性癌患者5年生存率约为40%[2]。
p53基因(17p13)是人类癌症中最重要的肿瘤抑制因子,编码一种核转录因子,表达于DNA损伤、热休克、缺氧和癌基因过度表达等各种应激信号。p53基因可分为野生型和突变型,野生型p53有肿瘤抑制作用,p53突变后,p53保持基因组的完整性和稳定性,调节细胞周期凋亡和促进DNA修复,如果DNA无法修复导致细胞凋亡[3]。p53基因在卵巢上皮性癌中会经常发生突变,无义突变则可能把p53基因完整地废除掉,在镜下表现为完全阴性。Gudkov A V等[4]发现野生型p53有促进免疫方面的内在作用,在癌症发展中对慢性炎症有积极影响。Agupitan A D等[5]发现突变型p53通过对癌症的反应和炎症反应,破坏天然肿瘤免疫并且能调节浸润免疫细胞的活性,还可能影响凋亡后细胞的清除。Liu Z等[6]得出结果在某些情况下,突变型p 53可能是免疫治疗反应性的有用生物标志物,可作为免疫治疗的靶点来限制肿瘤生长和转移,并可能与更好的生存预后有关。研究[7]表明卵巢上皮性癌的形成和患者预后不良与p53基因的缺失或突变密切相关。
p16基因,位于染色体9q21,又因其在细胞G1-S期转变过程中发挥抑制细胞周期蛋白依赖性激酶(CDKs)的作用被称为细胞周期素依赖性激酶抑制剂2A蛋白,很多研究表明p16可作为家族性黑色素瘤的特异性抗体,是一种在许多肿瘤中表现为下调的肿瘤抑制蛋白。参与调节细胞周期、衰老、凋亡、细胞侵袭和血管生成[8]。有学者研究p16在SKOV-3卵巢上皮性癌细胞和卵巢癌组织中表达有明显降低。p16高表达可显著抑制卵巢癌细胞的侵袭扩散能力[9]。高p16表达与卵巢癌患者的预后呈正相关。研究[10]表明p16基因在卵巢上皮性癌发生发展发挥作用,可作为预后指标。
Ki67基因位于10q25号染色体上,只编码增殖细胞中存在的RNA产生蛋白质。Ki67是判断肿瘤细胞活跃程度的重要指标,仅在细胞核阳性表达,与核糖体转录有关,是一种细胞核内的非组蛋白。其代表有丝分裂的指数,在循环细胞除G0静息细胞外中均有表达。热点区强的深棕色核染色被大多数作者推荐来进行Ki67计数。国内外研究表明Ki67高表达在多种肿瘤中出现,与肿瘤进展和预后相关。增殖活性的升高反应恶性行为。Chen M[11]等人研究证明Ki67在卵巢上皮性癌中不仅是一个预后因素,而且是一个生物标志物来预测治疗结果。
为了更好地研究p53,p16和Ki67在常见卵巢上皮性癌的积极作用,本研究用p53突变率,p16和Ki67的高表达率来做结果判定。p53在卵巢上皮性癌中若阴若阳常表现为野生表达,只有弥漫强阳性和全阴性表达被认为是突变型p53。p16斑驳阳性和Ki67低表达对这四种常见卵巢上皮性癌的诊断意义不大。本研究结果表明,p53突变率、p16和Ki67高表达率在卵巢上皮性癌组织中明显高于非卵巢组织,说明检测这三种基因在判断卵巢上皮性癌恶性程度上有一定意义。年龄与p53、p16和Ki67基因表达有关,年龄越大,突变率高表达率越高。在浆液性癌中,p53突变率、p16及Ki67强阳性率均高;粘液性癌中多见野生型p53、p16斑驳阳性和Ki67弱表达;子宫内膜样癌中多见野生型p53、p16斑驳阳性和Ki67强阳性,透明细胞癌中多见野生型p53、p16弥漫阳性和Ki67强阳性。p53突变、p16和Ki67基因高表达与组织分级和临床分期相关,分级越高,分期越晚,突变率强阳性率越高。镜下观察卵巢浆液性癌中有三例是从低级别向高级别转化而来,可能与p53突变增多有关。p53与p16基因表达在卵巢上皮性癌中呈正相关,有研究[12]也表明在缺乏p53突变的晚期卵巢癌中,p16肿瘤抑制基因的表达缺失更为常见。同时分析Ki67与p53;Ki67与p16基因的表达在上皮性卵巢癌中的相关性差异有统计学意义,Ki67强阳性率越高,p53突变率或p16强阳性率也越高,表明抑癌基因的表达与细胞增殖活性有正相关性。计算p53、p16和Ki67对卵巢上皮性癌诊断的性能结果三者联合灵敏度最高。这些结果表明上皮性卵巢癌的发生发展及浸润转移与p53突变率、p16和Ki67的高表达率显著相关,与临床病理指标的关系密切,对临床诊断有很大积极意义。三者相互作用有关,联合起来可作为卵巢癌患者的治疗预测和诊断指标。

