MCM4/PCNA在胃癌组织中的表达及作为潜在生物标志物的可能性研究
李小龙 宋瑞 李思 李晓宁 郭兰栓
1保定市第一中心医院普通外一科 071000;2保定市第一中心医院普通外二科 071000
0 引言
胃癌是公认的高恶性度、进展迅速的消化道癌症[1]。根据美国2021年的统计数据,导致患者死亡的最常见原因仍然是心血管疾病,其次就是癌症,但两者差距正在逐渐缩小[2-3]。胃癌的死亡率很高,美国在2021年约有26 560例新发病例,包括男性16 160例,女性10 400例;死亡病例11 180例,包括男性6 740例和女性4 440例[4]。由于胃癌的进展迅速,许多患者在发病早期并无明显症状,往往在诊断时已达晚期,导致其5年生存率很低。近年来,随着医学技术的快速发展,胃癌患者的预后已经大大改善。以外科手术为基础,联合化学治疗、放射治疗、靶向治疗以及内分泌治疗的治疗方法使胃癌患者的5年生存率大大提高,有的患者甚至能完全康复[5]。但是,目前临床上对胃癌的诊断仍然缺乏灵敏的生物标志物,大部分胃癌患者是在具有明显症状之后通过胃镜检查确诊的,极易错过最佳的治疗时机[6-7]。因此,寻找灵敏且特异性高的胃癌诊断生物标志物对于胃癌的诊疗具有极其重要的意义。
微小染色体维持蛋白4(mini-chromosome maintenance 4,MCM4)是高度保守的MCM蛋白,其对于真核生物基因组复制的启动至关重要[8]。MCM蛋白形成的六聚体蛋白复合物是复制前复合物(preRC)的关键组成部分,可能参与复制叉的形成和其他DNA复制相关蛋白的募集。由MCM2、4、6和7组成的MCM复合物具有DNA解旋酶活性,可作为DNA解旋酶[9]。MCM4的紊乱与许多疾病的发生、发展显著相关。例如,Issac等[10]发现MCM4可能是反映乳腺癌诊断和治疗效果的一个良好指标;Xie等[11]发现MCM4在卵巢癌中上调并与患者的预后显著相关,是卵巢癌的一个独立预后因子;Yi等[12]发现MCM4是非小细胞肺癌发生、发展的一个驱动因子。上述研究结果表明,MCM4与众多肿瘤的发生、发展显著相关,靶向MCM4可能是治疗这些癌症的一个新的治疗方向。但MCM4与胃癌之间的关系尚不清楚。因此,研究MCM4与胃癌之间的关系,进一步分析MCM4作为胃癌生物标志物的可能性具有重要意义。
增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)主要存在于细胞核中,是DNA聚合酶delta的辅因子[13-14]。其编码的蛋白质充当同源三聚体,有助于增加DNA复制过程中前导链合成的持续合成能力。此外,PCNA还可作为对DNA损伤的响应,被泛素化并参与依赖RAD6的DNA修复途径[15]。很多研究结果证明,PCNA与许多肿瘤细胞的异常增殖明显相关,PCNA的紊乱可能是部分肿瘤发生的内在机制。Smith等[16]通过研究证明,可通过靶向PCNA抑制胰腺癌的进展。Cui等[17]确定PCNA在甲胎蛋白(alpha-fetoprotein,AFP)增高的肝细胞癌中显著上调,并与其发展演变明显相关。Cardano等[18]认为靶向PCNA对于抑制肿瘤细胞增殖是一个灵敏而有效的治疗策略。He等[19]的研究结果表明,lncRNA AK027294能通过上调PCNA的表达量,从而进一步促进胃癌的进展。这些研究结果提示,PCNA可促进胃癌的发生和发展。
本研究中,主要探讨MCM4与胃癌的关系,以及MCM4与PCNA的关系,以期为胃癌诊疗提供一个新的方向和有效的生物标志物或靶点。
1 资料与方法
1.1 临床资料
选择2011年5月至2021年5月,保定市第一中心医院收治的经手术治疗的胃癌患者69例。其中,男性35例,女性34例,年龄56.3岁±5.72岁。全部病例均经过临床病理证实,并具有完整的病例资料。收集患者的胃癌组织与癌旁正常组织的石蜡标本,并收集患者的相关临床资料,包括年龄、性别、肿瘤分级、肿瘤大小。本研究中对所有患者标本的实验研究均得到了患者的知情同意。此外,本研究基于1964年赫尔辛基宣言和随后所有修订案中规定的道德标准。
1.2 方法
1.2.1 主要材料与仪器
Anti-MCM4抗体、Anti-PCNA抗体(英国Abcom公司),3,3’-二氨基联苯胺(DAB)(北京康为世纪生物科技有限公司)。RM2235型石蜡切片机、光学显微镜(德国徕卡公司)。
1.2.2 免疫组织化学检测
根据免疫组织化学染色试剂盒的说明书进行免疫组织化学染色。将石蜡标本用切片机切片(厚度为4~5μm),将切片放入65℃的烤箱中烤片约45 min,以便于进一步脱蜡;水化处理时,将切片用二甲苯Ⅰ处理10 min,用二甲苯Ⅱ处理10 min,用无水乙醇处理5 min,用无水乙醇处理5 min,用95%的乙醇处理5 min,用85%的乙醇处理5 min,用75%的乙醇处理5 min;水化处理后,用磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤切片3次,每次约3 min;洗涤结束后,将切片置于装有枸橼酸盐缓冲液的修复盒中,在微波炉中高火加热5 min后断电,再次以中低火加热8~10 min,进行抗原修复;将修复盒取出,在室温下冷却至常温,整个过程中保持玻片被修复液浸泡;继续用PBS洗涤切片3次,每次3 min;将切片周围多余的水分用滤纸吸干,再在标本上滴加过氧化物;将切片放于湿盒中,室温孵育约15 min以消除内源性过氧化物酶;擦干切片周围多余的液体后,用PBS洗涤3次,每次约3 min;稍微用力甩干多余液体,滴加特异性一抗并均匀涂布,然后置于湿盒中在4℃冰箱中孵育过夜;次日,将湿盒取出复温,用PBS洗涤3次,每次约5 min;用滤纸擦干切片上的多余水分,然后在标本上滴加IgG二抗工作液,均匀涂布后置于湿盒中,于室温下孵育25 min左右,再以PBS洗涤3次,每次约3 min;滴加事先配制的DAB染色液,于室温下显色,控制反应时间在5~8 min,用自来水冲洗以终止染色;用滤纸吸干切片上的多余水分,滴加苏木素工作液,进一步复染细胞核,控制染色时间为5~10 s;用自来水再次终止染色,随后进行梯度脱水[75%乙醇10 s→85%乙醇10 s→95%乙醇10 s→无水乙醇10 s→无水乙醇5 min→二甲苯(Ⅲ)5 m in→二甲苯(Ⅳ)5 min];最后用中性树胶封片,在显微镜下观察。
1.2.3 临床样本生物信息学分析
通过基因表达谱交互分析(gene expression profiling interactive analysis,GEPIA)数据库,验证胃癌组织中MCM4 mRNA的表达水平(http://gepia.cancer-pku.cn/detail.php?gene=MCM4)和PCNA mRNA的表达水平(http://gepia.cancer-pku.cn/detail.php?gene=PCNA),并分析胃癌组织中MCM4与PCNA之间的关系。
1.3 统计学方法
采用Graphpad统计学软件处理数据。定量数据采用均值±标准差(Mean±SD)表示。比较临床病理特征与MCM4和PCNA表达间的关系时,采用χ2检验;两组间进行比较时使用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 MCM4在各种肿瘤组织中的表达
生物信息学分析结果显示,MCM4在结直肠癌、乳腺癌、前列腺癌和肺癌组织中免疫组化染色呈阳性(图1);MCM4在多数肿瘤中呈现中高度表达,尤其是胶质细胞瘤,而在肝细胞癌、前列腺癌以及子宫内膜癌中呈低表达(图2)。
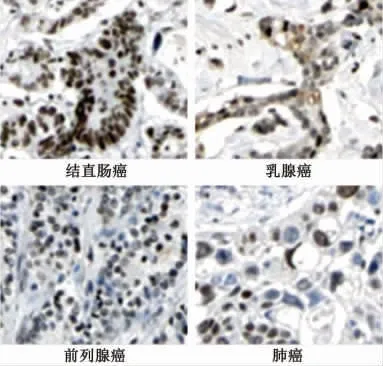
图1 微小染色体维持蛋白4(MCM4)在几种常见肿瘤中的免疫组化结果(×200)
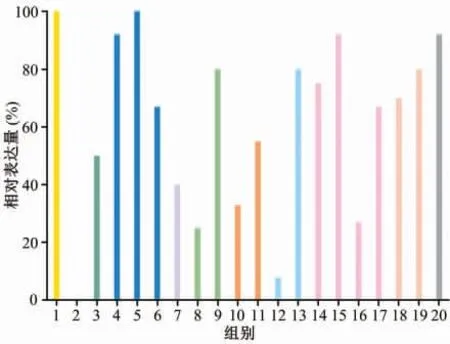
图2 微小染色体维持蛋白4(MCM4)在部分肿瘤中的表达情况
2.2 MCM4在胃癌组织中的表达情况
通过GPEIA数据库分析MCM4 mRNA在胃癌组织和癌旁正常组织中的表达情况,共分析胃癌组织408例及癌旁正常组织211例。结果表明,MCM4在胃癌组织中高表达(P<0.05)(图3)。该结果提示,MCM4可能是胃癌的一个独立生物标志物,可通过检测MCM4的表达量来预测胃癌的发生,还可进一步探索是否可通过靶向MCM4来治疗胃癌。

图3 微小染色体维持蛋白4(MCM4)的mRNA在胃癌组织和癌旁正常组织中的表达情况
为了进一步验证生物信息学分析结果,共对69例胃癌组织标本进行免疫组织化学染色,并分析MCM4的表达量。结果表明,MCM4在胃癌组织中的表达量明显高于癌旁正常组织(图4),这与生物信息学分析结果一致。为了进一步探讨MCM4的表达量与胃癌进展之间的关系,将69例胃癌组织标本根据染色强度分为高、低两组,分析比较MCM4高表达组和MCM4低表达组患者的临床病理特征差异,包括年龄、性别、肿瘤分级和肿瘤大小。表1中的数据表明,MCM4的表达与胃癌肿瘤大小明显相关(P=0.037),而与患者年龄、性别和肿瘤分级的关系无统计学意义(均P>0.05)。
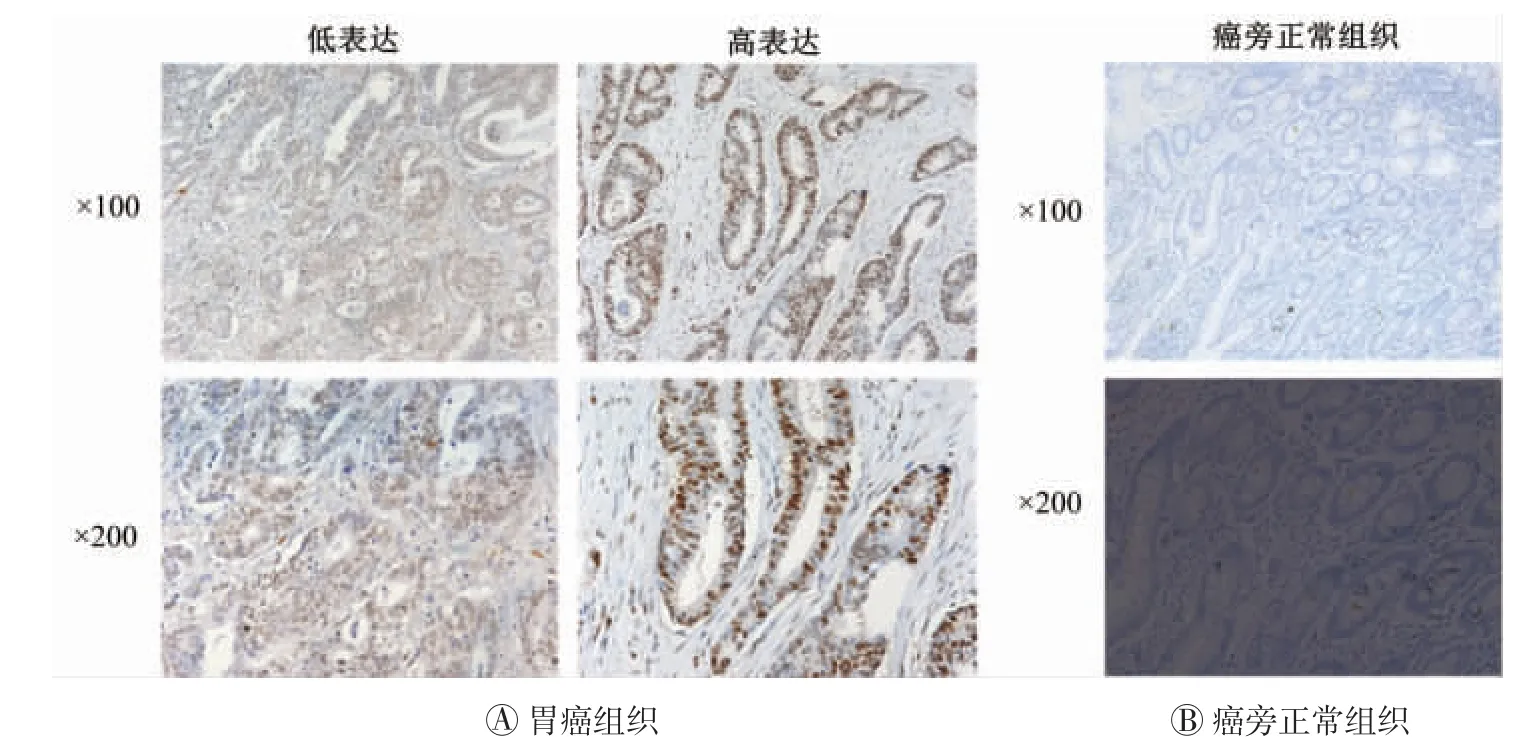
图4 胃癌组织和癌旁正常组织中微小染色体维持蛋白4(MCM4)的免疫组化结果
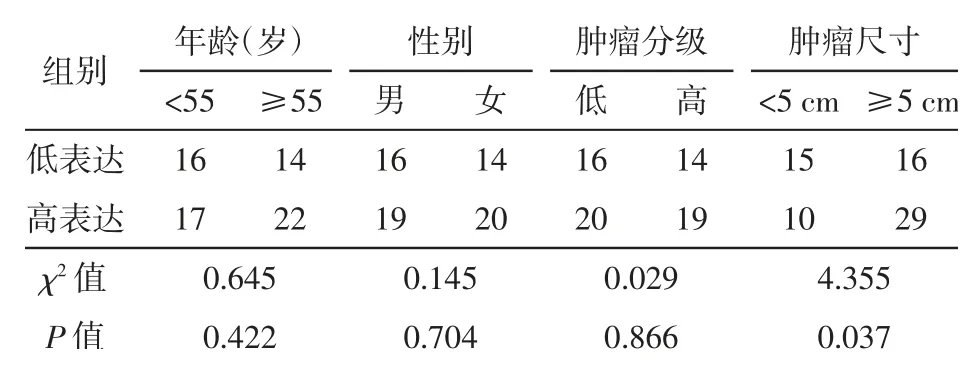
表1 微小染色体维持蛋白4(MCM4)的表达与胃癌患者临床病理特征的相关性分析(例)
2.3 MCM4与PCNA的关系
前文中的研究结果已经证实MCM4可促进胃癌的发生和发展。为了进一步探讨MCM4影响PCNA的方式,通过在线数据库分析了与MCM4相关的一系列因子。结果表明,MCM4与许多重要的蛋白和因子相关,如PCNA、细胞周期素A1(Cyclin A1)和细胞分化周期蛋白6(cell division cycle 6,CDC6)(图5)。PCNA是一个重要的增长相关因子,其紊乱会明显影响肿瘤的发生、发展。在本研究中,通过在线数据库预测了MCM4与PCNA的关联性,发现MCM4的表达量与PCNA表达量显著正相关(R=0.54,P<0.01;图6)。因此,利用GEPIA数据库进一步分析PCNA在胃癌组织中的表达情况。结果表明,在胃癌组织中,PCNA mRNA的表达量也明显高于癌旁正常组织(图7),进一步说明MCM4和PCNA具有密切的关系,MCM4表达上调可能通过进一步调节胃癌组织中PCNA的表达量,进而促进胃癌的发生、发展。但是,具体机制有待于进一步研究。
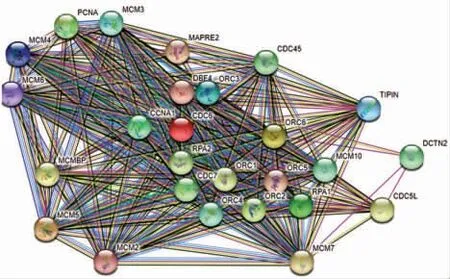
图5 与微小染色体维持蛋白4(MCM4)相关的蛋白和因子的网络分析结果
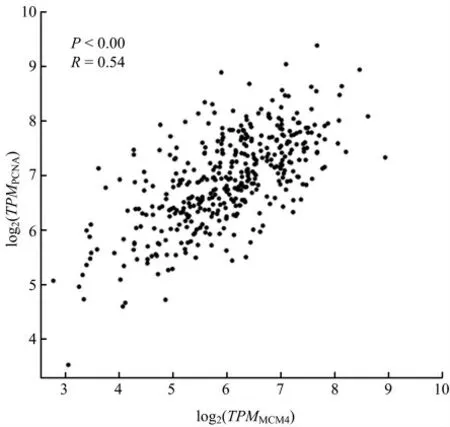
图6 微小染色体维持蛋白4(MCM4)与增殖细胞核抗原(PCNA)的相关性
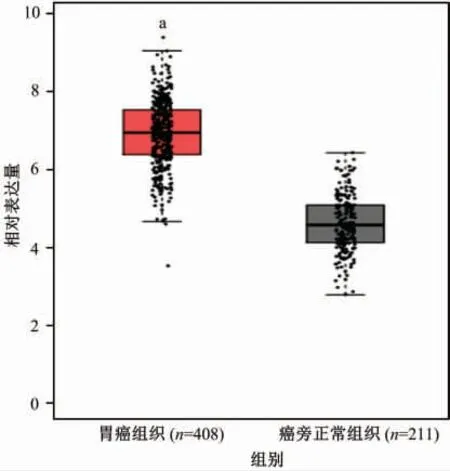
图7 增殖细胞核抗原(PCNA)的mRNA在胃癌组织和癌旁正常组织中的表达情况
2.4 MCM4与PCNA的免疫组化结果比较
为了进一步验证MCM4和PCNA的关系,将69例胃癌组织切片进行MCM4和PCNA的免疫组化染色。结果表明,胃癌组织中MCM4和PCNA蛋白均高表达(图8)。该结果与生物信息学分析结果一致,进一步说明二者之间存在紧密联系,并可能协同促进胃癌的发生和发展。
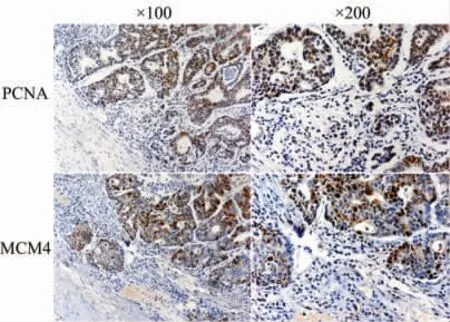
图8 胃癌组织中微小染色体维持蛋白4(MCM4)与增殖细胞核抗原(PCNA)的免疫组化结果
3 讨论与结论
胃癌是一种具有高致死率的恶性消化道肿瘤,其早期一般无明显症状,很多患者在确诊之时即为晚期,导致5年生存率很低。能诱发胃癌的因素很多,其中研究得比较多的是吸烟[20]、家族史[21]和不良饮食习惯[22],其中饮食中的各种毒素是显著因素。随着医疗技术的不断发展,胃癌患者的生存率已经大大得到提升,但发病人数不断增长,这与逐渐精密的检测仪器和不健康的生活方式明显相关[23]。
早期诊断和有效治疗是降低胃癌死亡率的最根本要素。因此寻找一种灵敏且有效的生物标志物对于提升胃癌的诊疗水平至关重要。研究结果表明,MCM4与多种肿瘤的发生、发展相关[24-25],靶向MCM4可抑制结直肠癌的发生、发展[26]。本研究结果表明,MCM4在很多肿瘤中显著上调,且MCM4在胃癌组织中的表达量明显高于癌旁正常组织,进一步分析患者的临床资料发现,MCM4的表达与胃癌肿瘤大小相关(P<0.05),而与患者性别、年龄及肿瘤分级的相关性无统计学意义(均P>0.05)。上述结果提示,MCM4可能是胃癌的一个独立预后因子。
此外,很多研究结果表明,PCNA与肿瘤的发生和发展相关,靶向PCNA能有效抑制肿瘤的进展。Li等[27]发现MicroRNA-204能有效通过靶向PCNA来抑制肺癌细胞的增殖和侵袭;Hou等[28]发现食管癌相关基因2(es ophageal cancer related gene 2,ECRG2)能通过上调p53和下调PCNA来增强顺铂对顺铂耐药食管癌细胞的作用;还有研究者发现PCNA与胃癌的发生、发展具有明显的关联性。在本研究中,通过GEPIA数据库证实MCM4与PCNA显著相关。此外,PCNA在胃癌组织中的表达量也明显高于癌旁正常组织,该结果与MCM4在胃癌组织中的表达情况一致。69例胃癌组织的MCM4与PCNA的免疫组化结果表明,在胃癌患者中,MCM4的表达情况与PCNA的表达情况一致,进一步证明了二者具有显著的相关性,二者可能协同促进胃癌的发生、发展。
综上所述,MCM4可能通过调节PCNA促进胃癌的发生、发展,MCM4和PCNA可能是胃癌的潜在生物标志物。本研究结果为研究靶向MCM4治疗胃癌提供了新的方向和思路。但由于本研究属于单中心小样本研究,在样本量方面存在不足。未来将进一步探究MCM4与胃癌之间的关系,通过基因操作技术构建MCM4表达载体,通过过表达或者敲低来改变MCM4的表达量,分析其对胃癌细胞的功能学影响。此外,将构建小鼠模型对本研究结果进行进一步的验证,以进一步揭示MCM4与PCNA的相互作用和MCM4、PCNA对于胃癌的具体作用机制。
利益冲突所有作者均声明不存在利益冲突

