脊髓灰质炎病毒受体与胃癌患者预后的关系
孙成相 丁志海
1天津医科大学中新生态城医院普外科 300480;2天津市海滨人民医院普外科 300280
0 引言
2018年的全球肿瘤统计报告显示,胃癌的死亡率逐渐上升,在肿瘤相关死亡率中位居第2[1]。精准的肿瘤分期和预后判断是肿瘤精准治疗的基础。美国肿瘤联合委员会制定的TNM(tumor-lymph nodemetastasis)分期系统已在多种肿瘤分期中运用,为肿瘤的治疗做出了重大贡献。随着诊断技术的进步和治疗手段的丰富,胃癌的TNM分期系统也在不断更新。外科手术是治疗局限性胃癌的主要方法,但即使在根治性切除后仍然可能复发和转移。众多的围手术期和辅助化疗方案的应用,已经使胃癌患者的生存期大大延长。实际上,包括一些临床验证的生物标志物在内的临床病理特征也应该考虑在治疗决策中,来提供更好的预后分析和精准的抗肿瘤策略。为了开展更加精准的治疗和预测胃癌患者的预后,临床需要更加详细和准确的策略[2-3]。
脊髓灰质炎病毒受体(poliovirus receptor,PVR),又称为CD155、Necl5或Tage4,位于人类19号染色体,有多种剪切变异体,其中最长的转录本由417个氨基酸组成。该基因编码的蛋白质隶属于免疫球蛋白超家族中的跨膜糖蛋白。其细胞外的结构域主要介导细胞与胞外基质的连接,细胞内的结构域主要与动力蛋白的轻链DYNLT1相互作用[4-5]。PVR在灵长类谱系中特异性表达,并且作为脊髓灰质炎病毒感染人体细胞的受体而备受关注[6]。对人体组织中的RNA测序后发现,PVR的mRNA在人体的多种组织和器官中表达,以肾上腺,肺和胎盘中表达量最高。近年来的研究结果表明,PVR在肿瘤的进展中也发挥着重要作用[7-9]。本研究中探究PVR与胃癌患者预后的关系。
1 资料与方法
1.1 临床资料
选择2015年1月至2016年12月在天津医科大学中新生态城医院和天津海滨人民医院接受胃切除术的胃癌患者73例。其中,男性44例,女性22例,年龄(45.6±4.73)岁。收集患者的胃癌组织与癌旁正常组织的石蜡标本,并收集患者的相关临床资料,包括年龄、性别、肿瘤级别、肿瘤大小、淋巴结转移情况和3年内肿瘤复发情况。纳入标准:术后经病理诊断明确为胃腺癌;无其他恶性肿瘤;在就诊医院接受胃切除术;年龄大于18岁;具有完整的病历资料。排除标准:术前接受过辅助化疗;就诊时已发生远处转移。
本研究涉及的所有患者资料及标本采集工作均得到了患者的知情同意。
1.2 方法
1.2.1 主要材料与仪器
PVR抗体、免疫组织化学染色试剂盒(英国Abcam公司),苏木素(北京索莱宝科技有限公司)。BX51体视显微镜(德国徕卡公司)。
1.2.2 免疫组织化学检测
石蜡标本由病理科按照常规方法制作并保存。按4μm的厚度切片,然后附着于防脱玻片上,在60℃的烘箱内烘烤2 h。将玻片从烘箱取出后立即置于二甲苯溶液中浸泡15 min(2次),期间晃动玻片数次以充分溶解石蜡。抖去多余液体后,对玻片进行梯度乙醇溶液脱水:无水乙醇浸泡5 min;无水乙醇浸泡5 min;95%乙醇浸泡5 min;75%乙醇浸泡5 min。脱水后,将玻片放置于流动的自来水中冲洗5 min。之后,将玻片浸入pH为6.0的枸橼酸盐缓冲液中,再放置于微波炉内使液体沸腾10 min,进行抗原修复。之后,等待溶液自然冷却至室温,再加入内源性过氧化物酶阻断剂,室温下孵育10 min。将玻片在磷酸缓冲盐溶液(phosphate buffer saline,PBS)中冲洗3次,每次5 min。滴加山羊血清,室温孵育15 min,封闭非特异性的结合位点。弃去血清后直接滴加经抗原稀释液稀释后的一抗(1∶100),置于湿盒内,置于4℃环境中孵育过夜。用PBS清洗后,加入生物素标记的羊抗兔二抗,室温孵育15 min。用PBS清洗后,加入辣根过氧化物酶标记的链霉卵白素工作液,室温孵育10 min。用PBS洗净后,滴加二氨联苯胺(diamio benzidine,DAB)显色液,每个玻片均显色2 min。用流动自来水冲洗玻片5 min后,用苏木素染料染色3 min,再用盐酸乙醇溶液分化,直至氨水返蓝。将玻片依次放入75%乙醇,95%乙醇,无水乙醇中各脱水2 min,再放于二甲苯中透明处理10 min。最后用中性树胶封片,倒置显微镜下观察。
根据免疫组织化学染色试剂盒的说明书对组织标本切片进行免疫组化染色。PVR的表达量由2名独立的病理医师根据免疫组织化学切片进行判断。显微镜观察时,每个切片随机选取5个视野,依照阳性细胞比例和和阳性染色强度2个指标评定组织切片中PVR的染色水平。阳性细胞比例评分标准:肿瘤细胞阳性百分数为0%时,记为0分,1%~29%时,记1分,30%~60%,记2分,>60%时,记3分。阳性染色强度评分标准:无染色记0分;弱染色记1分;中度染色记2分;高度染色记3分。以阳性细胞百分比评分和染色强度评分的乘积判断表达情况,其中结果≥6分为高表达组,结果<6分为低高表达组。
1.2.3 生物信息学分析
使用R语言,根据肿瘤基因组图谱(thecancer genome atlas,TCGA)中的胃癌患者数据绘制PVR基因表达箱式图。使用R语言中的RTCGA包和RTCGA.mRNA包获取各个样本中的PVR表达数据,使用dplyr包对获取的数据进行整理,使用ggplot2包和ggsignif包进行基因表达箱式图的绘制和统计检验。
通过基因表达谱交互分析(gene expression profiling interactive analysis,GEPIA)数据库(http://gepia.cancer-pku.cn/detail.php?gene=PVR)和癌症基因组图集(the cancer genome atlas,TCGA)数据库进行生物信息学分析。总生存期(overall survival,OS)定义为从随机化分组开始到任何原因引起患者死亡的时间;无病生存期(disease-free survival,DFS)定义为从随机分组开始到疾病复发或者由于疾病进展导致患者死亡的时间。使用Kaplan-Meier方法进行曲线绘制,以基因表达中位数来划分高表达和低表达,用虚线标记95%置信区间,并显示风险比(hazards ratio,HR)。
1.3 统计学方法
采用Graphpad统计学软件处理数据。PVR高表达和低表达患者的总生存期和无病生存期比较采用时序检验(Logrank)方法;比较患者PVR表达量和病理信息相关性时,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 PVR在胃癌组织中的表达及与预后的关系
利用TCGA数据库中的胃癌队列,分析PVR mRNA在胃癌组织中的表达情况,共纳入了408例胃癌标本和211例癌旁正常组织标本。如图1所示,PVR mRNA在胃癌标本中明显高表达,差异有统计学意义(P<0.05)。进而使用GEPIA分析了胃癌患者PVR表达量与患者预后之间的关系。由Kaplan-Meier生存曲线可知,PVR表达量较高的患者中,总生存率(P=0.011)和无病生存率(P=0.032)均较低(图2A和2B)。上述结果提示,PVR在胃癌组织中的表达水平较高,且PVR的表达与胃癌患者的生存期相关。
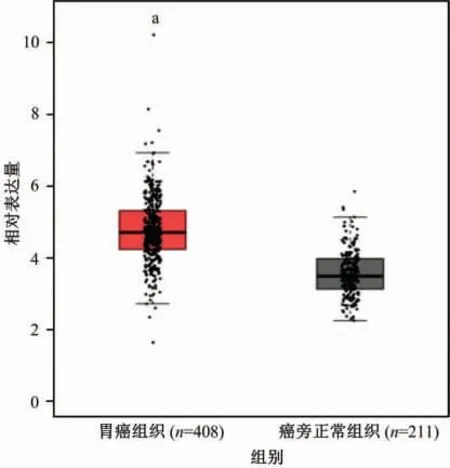
图1 胃癌组织中脊髓灰质炎病毒受体(PVR)的mRNA表达情况

图2 脊髓灰质炎病毒受体(PVR)的表达与胃癌患者生存期的相关性
2.2 PVR在胃癌组织中的表达
为了进一步探究PVR在胃癌进展中的作用。本研究中,运用免疫组化染色法检测73例胃癌组织中PVR的表达情况。结果显示,PVR主要表达在胃癌细胞的细胞膜上,在间质中不表达,而PVR在癌旁正常组织中基本不表达。
根据染色强度,将胃癌患者分为PVR高表达组和PVR低表达组(图3A)。比较后发现,PVR在癌旁正常组织中的表达量显著降低(图3B)。上述结果提示,PVR在胃癌的进展中发挥重要作用。
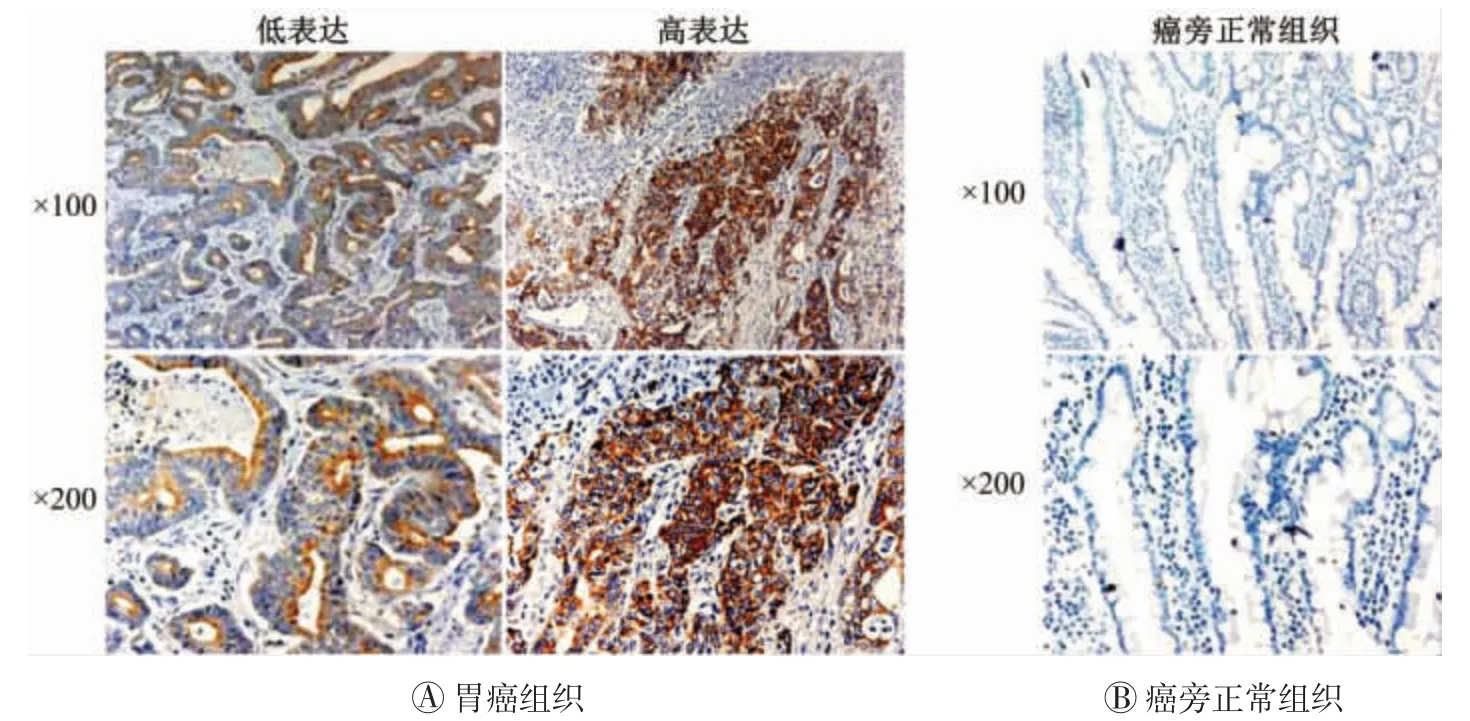
图3 胃癌组织和癌旁正常组织中脊髓灰质炎病毒受体(PVR)的免疫组化染色结果
2.3 PVR表达水平与胃癌患者的临床病理特征的相关性
为了阐明PVR在胃癌进展中的作用,分析比较了PVR高表达组和PVR低表达组患者的临床病理特征差异,包括年龄、性别、肿瘤级别、肿瘤大小、淋巴结转移情况和肿瘤复发情况。PVR高表达组和PVR低表达组患者在性别和年龄上的差异无统计学意义(均P>0.05),保证了两组具有可比性。分析结果显示,PVR表达与胃癌患者的肿瘤大小(P=0.001)和3年内复发情况(P=0.013)的相关性有统计学意义,而与肿瘤级别、淋巴结转移情况的相关性无统计学意义(均P>0.05)。(表1)
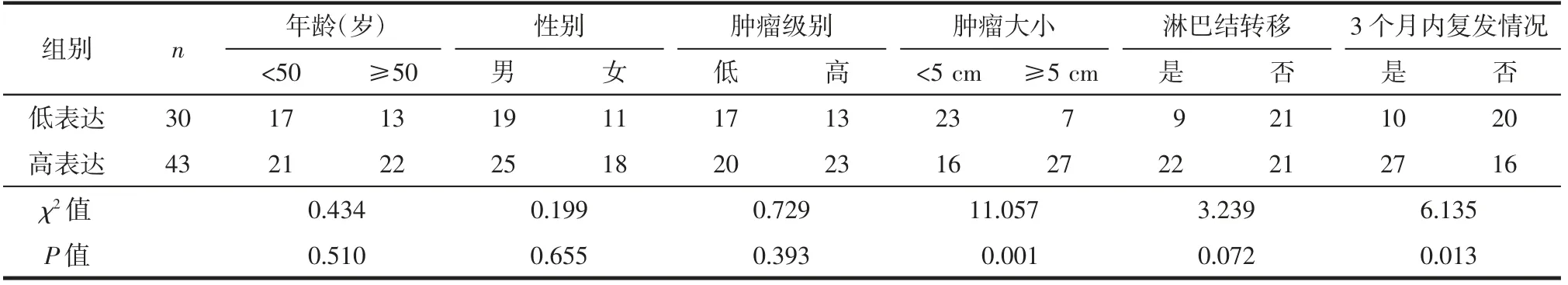
表1 脊髓灰质炎病毒受体(PVR)蛋白表达与胃癌患者临床病理特征的相关性分析(例)
3 讨论与结论
PVR最初被重视是因为其介导了脊髓灰质炎病毒感染人体细胞。近些年的大量研究结果表明,PVR不仅与病毒感染有关,而且与肿瘤的增值侵袭和免疫系统等也有紧密的联系。
本研究中通过生物信息学分析,发现PVR mRNA在胃癌组织中表达明显上调。进而使用免疫组化染色法分析了PVR在73例胃癌患者组织中的表达情况,结果表明PVR蛋白在胃癌组织中表达上调,而在癌旁正常组织中不表达或低表达。多项研究结果表明,PVR在人类的多种肿瘤中表达上调。有研究者利用免疫组化法分析了134例胰腺癌组织中PVR的表达情况,发现PVR在胰腺癌组织中高表达,且与预后、肿瘤免疫力和血管生成有关。本研究中,通过生存分析得知,PVR mRNA的表达量与胃癌患者的预后负相关。对73例胃癌患者临床资料的回顾性分析结果也表明,PVR表达量越高,患者肿瘤体积越大且更容易复发。此外。多项研究结果证实,PVR的表达情况与肺腺癌、软组织肉瘤、黑色素瘤、结肠癌等多种癌症的预后相关[10-15]。
迄今为止,研究者尚未完全阐明PVR在人类生理和病理中的确切作用。特别是在肿瘤的发生和发展中,PVR的功能在很大程度上都是不清楚的。在免疫学功能上,先前的研究结果表明,PVR既可以发挥抑制作用,同时也具有刺激和激活免疫的作用。PVR与DNAM-1相互作用刺激体内的免疫细胞产生抗肿瘤作用[16]。然而,最近的几项研究结果表明,TIGIT结合PVR并抑制T细胞和NK细胞的活性,抑制细胞因子的分泌,如干扰素γ,肿瘤坏死因子α[17-21]。在转化的早期阶段,肿瘤细胞上PVR的表达主要促进抗肿瘤免疫功能,而在晚期则支持肿瘤生长和免疫逃逸。
在恶性转化的信号中,成纤维细胞生长因子受体或致癌性Ras突变的刺激激活了Ras-Raf-MEKERK信号通路的转录程序,最终导致CD155转录诱导[22]。在Ras突变的细胞中,CD155的过表达影响了细胞的G0/G1期,并促进了肿瘤细胞的增殖[23]。尽管尚未确定所涉及的信号传导分子,但CD155诱导的增殖信号需要胞质ITIM的参与,这表明该功能仅对CD155α亚型有效。CD155介导的信号传导还可以与生长因子信号协同作用,以控制肿瘤的生长。例如,在NIH3T3细胞中,CD155增强了血小板衍生的生长因子诱导的细胞增殖,从而增强了Ras-Raf-MEK-ERK信号通路[24]。另外有研究者报道,CD155的抑制通过影响Bax和Bcl-2表达之间的比例来抑制结肠癌细胞的增殖并促进细胞凋亡[25]。
血管生成在肿瘤的生长和转移过程中也起到了关键作用,血管内皮生长因子(vascular endothelial growth factor,VEGF)在肿瘤微环境中促进血管的生成[26-27]。有研究结果表明,PVR与VEGF受体2相互作用并调节VEGF诱导的血管生成[28]。针对胰腺癌的多项研究结果表明,PVR与血管生成和患者预后密切相关[28-30]。另外,PVR的体外阻断不影响胰腺癌细胞系的VEGF的表达,肿瘤中的PVR可能通过VEGF的受体与其他分子的相互作用来调节血管生成,而不是直接与VEGF本身相互作用[28]。靶向VEGF的疗法是治疗几种人类恶性肿瘤的标准疗法,因此PVR和VEGF的联合治疗可对肿瘤发挥协同治疗作用。
PVR与细胞周期和增值具有密切关系[23-24]。Nishiwada等[13]利用siRNA干扰技术在人胰腺癌细胞系中沉默了PVR,流式细胞术结果表明肿瘤细胞的增值受到明显抑制,细胞阻滞在G2/M期。此外,沉默PVR对ERK、JNK和P38介导的MAPK通路也产生显著影响[23-24,31]。
综上所述,PVR在胃癌组织中过表达,高表达PVR的胃癌患者预后更差。因此,PVR水平对于胃癌患者的预后评价具有重要价值。本研究可为研发针对胃癌的PVR靶向疗法提供理论依据。
利益冲突所有作者均声明不存在利益冲突

