青黛散加减联合西药对急性期溃疡性结肠炎患者炎症-氧化应激的干预研究∗
李泽涵 尚洪海 赵彩琪 靳桂春 冯五金△
(1.山西中医药大学,山西 太原 030024;2.山西省中医院,山西 太原 030012)
溃疡性结肠炎(UC)是一种原因不明的炎症性肠病,临床表现为长期、反复发作性腹痛、腹泻及脓血黏液便等,失治或治疗不当导致病情反复发作,治愈难度较大,病情进展可能引起肠纤维化,且存在恶变风险[1]。目前,西医对UC尚无特效治疗药物,常规对症治疗效果并不理想。近年来,中医药对UC的治疗显示了良好的效果与应用前景,但因其机制不明确,严重制约了中医药在UC治疗中的推广应用。UC多见于直肠与乙状结肠,活动期多有气滞血瘀、湿热内蕴和肉腐血败等变化,故活动期治疗当注重清热燥湿、解毒化瘀及化腐生肌之法[2]。青黛散出自《济阳纲目》,有清热解毒和消肿止痛之功效,既往多用以治疗咽喉肿痛、口舌生疮等症。本研究在青黛散原有方基础上化裁,配合西药治疗急性期UC,观察其对肠镜、主要证候表现及炎症-氧化应激指标的影响,评价其临床疗效。
1 资料与方法
1.1 病例选择 诊断标准:西医诊断参照《炎症性肠病诊断与治疗的共识意见》[3]中有关UC的诊断标准;中医诊断参照《溃疡性结肠炎中医诊疗共识意见》[4]和《中药新药临床研究指导原则》[5]中“湿热内蕴证”的分型标准。纳入标准:符合UC的中西医诊断标准;处于疾病急性期(活动期);病情分度为轻度或中度;年龄18~65岁;患者签署知情同意书;研究经医院伦理委员会审核且批准通过。排除标准:合并严重心、脑、肝、肾及造血系统、内分泌系统等原发性疾病;合并肠结核、放射性肠炎等其他消化系统疾病;存在肠梗阻、局部狭窄、肠穿孔、息肉等严重并发症者;近期使用可能影响胃肠功能药物者;正在使用或需要使用激素治疗者;合并精神疾病、恶性肿瘤者;既往有药物过敏史或过敏性体质者;依从性较差者。退出标准:因各种原因未能坚持完成疗程者;因严重不良事件不宜继续临床试验者;研究期间发生其他疾病且需要接受药物干预者;未按计划用药影响疗效判定或资料不全者。
1.2 临床资料 选取本院2019年1月至2020年6月收治的急性期UC(湿热内蕴证)患者102例,按随机数字表法以1:1比例分为对照组与研究组各51例。研究组中男性29例,女性22例;年龄20~65岁,平均(48.02±5.14)岁;UC病程1~15年,平均(5.14±1.02)年;急性期病程1~7 d,平均(2.37±0.60)d;病变类型:直肠型15例,直肠乙状结肠型26例,左半结肠型5例,右半结肠型3例,全结肠型2例;病情程度:轻度34例,中度17例。对照组中男性31例,女性20例;年龄20~65岁,平均(46.63±5.02)岁;UC病程 1~12年,平均(5.42±1.18)年;急性期病程1~7 d,平均(2.31±0.54)d;病变类型:直肠型17例,直肠乙状结肠型27例,左半结肠型4例,右半结肠型2例,全结肠型1例;病情程度:轻度37例,中度14例。两组基线资料比较,差异均无统计学意义(P>0.05)。
1.3 治疗方法 对照组给予常规西医治疗,在调节水/电解质及酸碱平衡、针对性营养支持基础上给予美沙拉嗪肠溶片口服,每次1 g,每日4次,症状缓解后维持1周,再逐步降低剂量至每日1.5 g,分3次口服,疗程8周。研究组在对照组基础上给予青黛散加减治疗:青黛20 g,薄荷30 g,黄连20 g,黄柏20 g,儿茶20 g,炒白术15 g,枯矾6 g,珍珠3 g,乌药12 g,生黄芪15 g,炒白术15 g,肉桂4 g,甘草6 g;如便脓血明显则加生地榆15 g及白头翁30 g。每日1剂,水煎取汁300 mL,早晚各1次温服,疗程8周。
1.4 观察指标 1)中医证候分级量化标准。治疗前及治疗1、2、4、8周后,参照《中药新药临床研究指导原则》[5]对主、次症进行分级半定量评价,按无、轻、中、重度评价,单项以0~4分计,得分越高提示症状越重。2)肠黏膜Baron评分标准。治疗前及治疗1、2、4、8周后,根据结肠镜检查显示肠黏膜病变情况,以Baron标准[6]进行评价,正常为0分,轻度病变为3分,中度病变为6分,重度病变为9分。3)疾病活动指数评价标准。治疗前及治疗1、2、4、8周后,采用Sutherland疾病活动指数(DAI)[7]进行评价,包括医师病情评估与腹泻、便血、镜下黏膜表现4个维度,单项按无、轻度、中度和重度以0~3分4级评价,总分0~12分,0~2分为疾病进入缓解期,≥3分为活动期(即急性期),得分越高则疾病活动度越高。4)生存质量分析。治疗前及治疗1、2、4、8周后,采用炎症性肠病患者生存质量分析(IBDQ)[8]进行生存质量评价,包括全身症状(5项)、肠道症状(10项)、情感能力(12项)和社会能力(5项)共计32个项目,单项按1~7分评价,总分32~224分,得分越高则表示生存质量越好。5)实验室指标检测。治疗前及治疗8周后,晨取空腹静脉血5 mL,采用酶联免疫吸附法(ELISA)测定血清肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、白细胞介素-17(IL-17)和转化生长因子-β1(TGF-β1)。血清超氧化物歧化酶(SOD)和丙二醛(MDA)分别采用黄嘌呤氧化酶法和硫代巴比妥酸比色法测定。
1.5 疗效标准[5]临床控制:临床症状消失或大部分消失,证候积分降低率>90%,结肠镜检显示黏膜基本恢复正常;部分缓解:临床症状明显缓解,证候积分降低率70%~90%,结肠镜检显示仅轻度炎症或黏膜病变恢复2级以上;有效:临床症状有所缓解,证候积分降低率<70%,结肠镜检显示黏膜病变恢复1级;无效:临床症状及黏膜病变无改善甚至加重,证候积分降低率<30%。
1.6 统计学处理 应用SPSS22.0统计软件。计数资料以百分率(%)表示,采用χ2检验;符合正态分布、方差齐性计量资料以(±s)表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后临床评分比较 见表1。治疗前,组间中医证候积分、Baron评分、DAI及IBDQ评分基础值比较差异不显著(P>0.05);治疗1周后,两组中医证候积分、Baron评分、DAI评分均较治疗前明显下降,且研究组均显著低于对照组(P<0.05);IBDQ评分均升高,且研究组高于对照组(P<0.05);治疗4、8周后,两组中医证候积分、Baron评分、DAI评分均进一步降低,IBDQ评分均进一步升高,研究组均优于对照组(P<0.05)。
表1 两组治疗前后临床评分比较(分,±s)
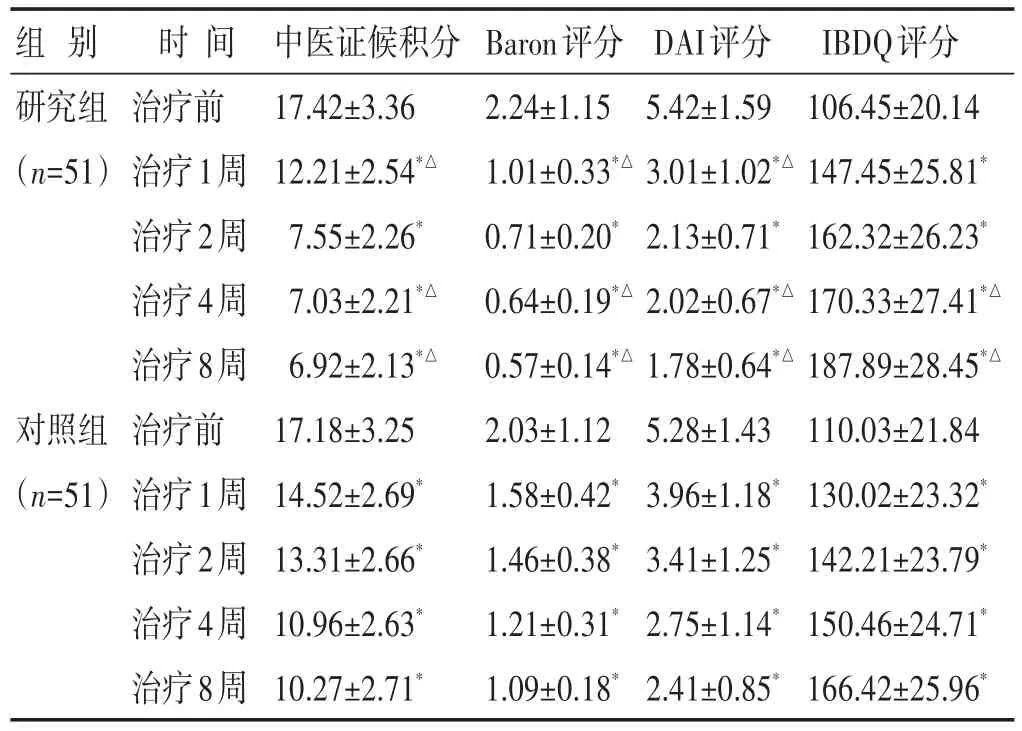
表1 两组治疗前后临床评分比较(分,±s)
注:与本组治疗前比较,∗P<0.05;与对照组同期比较,△P<0.05。下同。
组别研究组(n=51)对照组(n=51)时间治疗前治疗1周治疗2周治疗4周治疗8周治疗前治疗1周治疗2周治疗4周治疗8周中医证候积分17.42±3.36 12.21±2.54*△7.55±2.26*7.03±2.21*△6.92±2.13*△17.18±3.25 14.52±2.69*13.31±2.66*10.96±2.63*10.27±2.71*Baron评分2.24±1.15 1.01±0.33*△0.71±0.20*0.64±0.19*△0.57±0.14*△2.03±1.12 1.58±0.42*1.46±0.38*1.21±0.31*1.09±0.18*DAI评分5.42±1.59 3.01±1.02*△2.13±0.71*2.02±0.67*△1.78±0.64*△5.28±1.43 3.96±1.18*3.41±1.25*2.75±1.14*2.41±0.85*IBDQ评分106.45±20.14 147.45±25.81*162.32±26.23*170.33±27.41*△187.89±28.45*△110.03±21.84 130.02±23.32*142.21±23.79*150.46±24.71*166.42±25.96*
2.2 两组临床疗效比较 见表2。研究组总有效率显著高于对照组(P<0.05)。

表2 两组临床疗效比较(n)
2.3 两组治疗前后血清炎症因子水平比较 见表3。治疗前,两组血清TNF-α、IL-6、IL-8、IL-17及TGF-β1水平差异不显著(P>0.05);治疗后,两组TNF-α、IL-6、IL-8、IL-17水平均降低,且研究组均低于对照组(P<0.05);TGF-β1水平均升高,且研究组高于对照组(P<0.05)。
表3 两组治疗前后血清炎症因子水平比较(±s)

表3 两组治疗前后血清炎症因子水平比较(±s)
组别研究组(n=51)对照组(n=51)时间治疗前治疗后治疗前治疗后TNF-α(ng/mL)34.05±8.85 13.24±1.27*△32.94±8.27 18.43±2.64*IL-6(mg/L)165.84±23.42 80.24±10.24*△161.49±21.85 132.44±15.83*IL-8(mg/L)0.99±0.23 0.41±0.05*△0.97±0.21 0.69±0.10*IL-17(pg/mL)92.44±12.73 55.49±6.81*△90.25±11.46 66.04±9.72*TGF-β1(μg/L)31.12±4.65 47.88±7.43*△32.04±4.79 41.19±5.88*
2.4 两组治疗前后血清氧化应激指标比较 见表4。治疗前,两组血清SOD及MDA水平差异不显著(P>0.05);治疗后,两组SOD水平均升高且研究组显著高于对照组(P<0.05),MDA水平均降低且研究组显著低于对照组(P<0.05)。
表4 两组治疗前后血清氧化应激指标比较(±s)

表4 两组治疗前后血清氧化应激指标比较(±s)
组别研究组(n=51)对照组(n=51)时间治疗前治疗后治疗前治疗后SOD(U/mL)20.12±3.91 52.85±7.79*△21.06±4.15 38.82±6.04*MDA(nmol/mL)12.33±1.76 6.04±0.71*△11.85±1.59 7.74±0.92*
2.5 安全性评价 用药期间,对照组无明显不良反应。研究组2例初次服药时轻度恶心,自行缓解后继续治疗。两组治疗前后均未见明显肝肾功能损害、心电图异常及三大常规异常。
3 讨 论
UC急性期常见黏液脓血便或甚至便下鲜血,如不及时治疗病情可持续加重,甚至有恶变风险。西医常规应用美沙拉嗪等药物治疗,虽短期控制效果肯定,但远期复发风险较高,且长期、频繁监测肠黏膜炎症活动度或愈合程度不仅增加患者的痛苦,医疗消费较多,患者的依从性也不理想[9]。因此,对于急性期UC患者的治疗,如何迅速缓解并长期维持,同时降低复发率,成为UC治疗的重点和临床研究的热点。
中医古代文献关于UC相关记载较多,急性期多属“痢疾”“腹痛”等范畴,而缓解期多属“泄泻”“肠癖”“久痢”等范畴。本病为本虚标实之证,以阳虚为本,并兼寒、热、湿、痰、瘀等邪实。急性期或活动期多以邪实为主,具有明显湿热之象,多因湿热毒邪壅滞肠中而发病,湿热内蕴可化火而入营血,致血络灼伤或高热神昏,如迁延失治则邪恋正虚,致脏腑俱损,呈虚实夹杂之势[10]。因病久入络,则必瘀必虚,瘀血不除则气血愈虚,湿热毒邪蕴结于肠腑,并与瘀血缠绵,则致病情迁延难愈。虽寒与热属性相反,但二者常彼此错杂,在多种病症进展过程中普遍,尤其是在UC发病过程中寒热错杂较为普遍,致病情反复发作,且各种证型均可归为寒热错杂之证,唯寒热程度不同而已。因此,对急性期UC宜取“寒热并治,阴阳并调”之法,并少佐敛疮生肌之品以缓解,对迅速控制UC病情并预防复发或有良效。
基于急性期UC的病因病机,本研究借鉴古方青黛散加减治疗。方中青黛善清胃肠之热,并有解毒凉血之功,为本方之君;黄连泻火解毒、清热燥湿,黄柏泻火除蒸、清热燥湿、解毒疗疮,可助君药清热燥湿解毒之功,为本方之臣。枯矾敛湿化腐,儿茶收湿生肌,珍珠愈疡生肌,薄荷发汗解热,并有疏肝理气、清利头目、止痛等功效,4药配伍可增强止泻之功,并可愈疡止痛、化腐生肌。配以肉桂及乌药温补下焦,引火归原;白术与生黄芪健脾理气、托毒外出,以上共为本方之佐。甘草缓急止痛,并可调和诸药,为本方之使。全方攻补兼施、刚柔相兼,共奏清热解毒、除湿止泻、愈疡化腐、生肌敛疡之功。本研究结果显示,研究组在常规西药治疗基础上加用青黛散加减治疗1周后,无论是临床症状、疾病活动指数还是结肠镜下Baron评分均较对照组明显改善,且随着疗程推移这种优势更为凸显,临床治疗总有效率较之对照组明显提高(P<0.05),与赵艺[11]报道相符。提示青黛散加减联合西药治疗急性期UC疗效显著,能够促进病情缓解,提高疾病控制效果,改善肠黏膜炎症反应程度并促进溃疡病灶修复。同时,IBDQ量表评分发现,两组治疗前普遍存在生活质量下降,治疗1、4、8周后不仅临床症状得以改善,生活质量亦呈显著提高趋势,研究组的改善幅度更为明显(P<0.05)。随着疾病的控制,患者的心理压力也随之降低,生活质量随之改善,这也是影响UC病情的重要因素。
炎症激活是肠道损伤的关键始动因素,促炎因子过表达与抗炎因子表达弱势相互作用最终导致肠道炎症反应[12]。现代药理学研究表明,青黛具有抗炎、抗溃疡、调节免疫、降低毛细血管通透性及保护肠黏膜损伤等作用;黄柏、黄连等具有抗炎、抗菌等作用[13]。枯矾、儿茶等可调节肠道菌群、保护肠黏膜屏障及肠道蠕动功能;珍珠具有抗组胺效应,并可促进创面愈合[14]。生黄芪与白术调节免疫、抗病毒、抗氧化;肉桂有镇痛、镇静、抗溃疡、抗菌等作用;乌药抗炎、抗菌、抗氧化、镇痛[15-16]。由此推测,青黛散可能通过抗炎、免疫调节、抗氧化等途经发挥UC治疗作用。
炎症因子TNF-α、IL-6、IL-8、IL-17等参与机体炎症反应,可诱导局部炎症性损伤;TGF-β1则可抑制多种免疫活性细胞的增殖,直接或间接影响肠上皮细胞的稳态性[17-20]。本研究结果显示,两组治疗前血清炎症因子TNF-α、IL-6、IL-8、IL-17均处于高表达状态,而修复因子TGF-β1处于低表达状态;治疗后,两组血清TNF-α、IL-6、IL-8、IL-17水平均显著降低,修复因子TGF-β1水平明显升高,而研究组的改善幅度相较对照组更显著,这可能是研究组疗效更佳的关键机制。同时,本研究还发现研究组在治疗后氧自由基清除剂SOD水平明显高于对照组,而脂质过氧化产物MDA水平明显低于对照组(P<0.05),而氧化应激对组织的攻击作用或可激活炎性介质而加重组织损伤[20]。由此可见,青黛散加减联合西药治疗急性期UC可能通过调节机体炎症-氧化应激反应程度而控制病情。
综上所述,青黛散加减联合西药治疗急性期UC效果显著,可提高疾病控制效果、缓解临床症状、抑制肠道炎症反应并促进肠黏膜病理损伤的修复,改善患者的生活质量,其机制与调节炎症-氧化应激反应有关。

