血清miR-92a表达水平与胃腺癌患者无进展生存期的关系
李秋田 翟弥弥 焦 鑫 王 玉 张 力 张国友△
(1潍坊医学院外科学教研室,潍坊 261053;2 潍坊医学院第一附属医院(潍坊市人民医院),潍坊 261031;3 潍坊医学院附属医院,潍坊 261031)
胃癌(gastric carcinoma ,GC)是目前位于世界上最常见癌症的第五位,也是导致癌症相关死亡率第三高的原因[1]。早期胃癌患者常无明显特异性症状,大部分胃癌患者发现时已是进展期或存在远处转移,总体 5 年生存率不足 50%[2]。
近年来,有证据表明microRNA(miRNA)在恶性肿瘤中表达失调[3-4]。miR-92a在多种恶性肿瘤中如肺、前列腺、直肠和胰腺等肿瘤组织细胞中呈高表达、过度表达,具有致癌作用[5]。目前关于miR-92a在胃腺癌患者血清中的表达水平及其与临床病理特征和预后关系的报道尚少。本研究拟通过实时荧光定量PCR(RT-qPCR)检测胃腺癌患者血清中miR-92a的表达情况,并分析其与胃腺癌患者临床病理特征和生存期的关系,探讨血清miR-92a是否有助于胃腺癌预后评价。
1 资料与方法
1.1 一般资料
胃腺癌组:2018年5月—2018年10月在潍坊医学院附属医院就诊的胃腺癌患者作为胃癌组。纳入标准:1)经病理金标准确诊为胃腺癌;2)术前未行任何放化疗。排除标准:1)患有其他肿瘤疾病;2)术前进行过放化疗;3)随访过程中失访,有重要信息缺失。最终纳入87例胃腺癌患者,其中男性47例,女性40例;年龄31~85岁,平均年龄(61.1±12.1)岁。健康对照组:选取同一时期在潍坊医学院附属医院行胃镜检查正常的体检者为对照组,纳入标准为不患有胃腺癌及其他肿瘤疾病。最终纳入78例健康对照,其中男性41例,女性37例,年龄35~82岁,平均年龄(62.9±11.9)岁。两组间年龄(t=-0.961,P=0.338)、性别(χ2=0.035,P=0.851)差异无统计学意义。本研究获得医院医学伦理学委员会批准,且研究对象已签署知情同意。
1.2 方法
1.2.1miR-92a检测 所有研究对象均于清晨采集空腹外周静脉血3~4ml于真空促凝管中,在水浴箱(37℃) 中静置10min,使用常温离心机3000r/min离心10min,收集上层血清约1ml到新EP管中,置于-80℃冰箱中保存备用。按照总RNA抽提试剂(Trizol试剂)说明书提取总RNA,用分光光度计测量提取的RNA样品的纯度,使其OD260/OD280的比值在1.8~2.1之间。提取总RNA在-80℃的条件下保存,以备后续的实验使用。按照逆转录试剂盒说明书将总RNA逆转为cDNA,反应体系:RNA引物混合物13μl,5×RT Reaction Buffer 4μl,RNaseinhibitor 1μl,dNTP 1μl,M-MLV RTase 1μl,ddH2O 5μl,将cDNA样本置于-20℃环境中保存。miR-92a正向引物为5’-AGCTCTACGACTGTCACTCG-3’,反向引物为5’-GTATGCATTCTATCGTAG-3’;内参正向引物为5’-CTCGCTTCGGCAGCACA-3’, 内参反向引物为5’-AACGCTTCACGAATTTGCGT-3’。实时荧光定量PCR 建立实时荧光定量PCR扩增反应体系以U6为内参基因,反应体系为:2×All-in-oneTM qPCR Mix 10μl,cDNA模板2μl,正向引物2μl,反向引物2μl,50×Rox Reference Dye0.4μl,ddH2O(RNase/DNase free) 3.6μl。反应条件为:95℃预变性10min,1个循环;95℃变性15s,60℃退火30s,72℃延伸10s,40个循环。
1.2.2miR-92a表达水平判定 采用2ΔΔCt法计算血清miR-92a的表达情况:ΔΔCt=(CtmiR-92a-CtU6)待测样本-(CtmiR-92a-CtU6)对照组。循环阈值(Cycle threshold,Ct值)为每个反应管内的荧光信号到达设定阈值时所经历的循环数。
1.2.3随访与观察指标 采用前瞻性研究方法对胃腺癌患者进行随访,以无进展生存期(progression-free survival,PFS)作为疗效评价指标。PFS定义为术后第1天起,未发生复发、原发器官肿瘤转移及其他原因引起死亡的时间。
早期胃癌每6个月随访1次,进展期胃癌每3个月随访1次,随访起始时间自患者术后第1天开始,通过电话或门诊等方式对患者进行调查,随访时长为2年。随访内容包括扩患者完整的临床资料、体格检查、血液学检查、体重监测、影像学检查或内镜检查等资料。
1.3 统计学方法
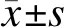
2 结果
2.1 两组血清miR-92a表达水平
胃腺癌患者血清miR-92a相对表达量(3.378±1.031)高于健康对照组相对表达量(1.062±0.117),差异有统计学意义(t=19.720,P<0.001)。
2.2 miR-92a表达与患者临床病理特征的关系
血清miR-92a的表达水平与胃腺癌患者的性别、年龄、肿瘤位置、肿瘤大小、分化程度无明显关系,而与胃癌的浸润深度、淋巴结转移、远处转移临床分期等临床病理特征关系密切,且差异具有统计学意义。见表1。
2.3 血清miR-92a表达水平和胃腺癌患者无进展生存期的关系
根据既往研究及参考文献,以所有胃癌患者血清中miR-92a表达量的平均值3.378为界限,将血清miR-92a表达量≥3.378胃腺癌患者纳入高表达组,将血清miR-92a表达量<3.378胃腺癌患者纳入低表达组。miR-92a高表达组55例,低表达组32例。Kaplan-Meier生存曲线分析血清miR-92a表达水平的高低和胃腺癌患者生存期的相关性,胃腺癌患者血清miR-92a高表达组中位无进展生存期(15个月)低于miR-92a低表达组(23个月)。两组患者的生存曲线存在显著差异(χ2=9.06,P<0.001)。见图1。
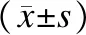
表1 不同特征胃腺癌患者miRNA-92a相对表达量的比较
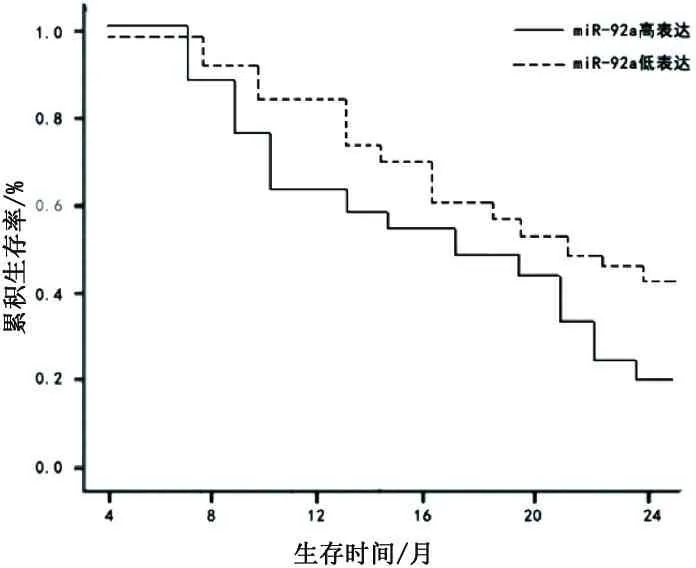
图1 miR-92a表达与无进展生存期的关系
2.4 血清miR-92a不同表达水平胃腺癌患者的死亡风险
随访结束时,miR-92a高表达组死亡10例,生存45例,miR-92a低表达组死亡3例,生存29例。血清miR-92a高表达组的死亡风险是低表达组的1.97倍(HR=1.97,P<0.05)。
3 讨论
胃癌作为全球第三大癌症死亡原因,早发现、早治疗是降低其死亡率的关键。既往由于缺乏高度敏感和无创性的诊断生物标志物,胃癌的死亡率居高不下。miRNA功能异常与肿瘤的发生发展密切相关,是肿瘤一个重要发病机制。miRNA是一类长度约为20~24个核苷酸的具有高度物种保守性的内源性非编码小RNA,miRNA在细胞早期发育,增殖,分化、死亡以及脂肪代谢等生命进程中起着关键性的作用[6-9]。在肿瘤的发生发展中表现为癌基因或抑癌基因,通过调控肿瘤细胞的分化、增殖、凋亡和侵袭等调控肿瘤的生物学行为[4]。因此,miRNA的出现为胃癌早期筛查提供了更多的可能。miRNAs可以通过分泌胞外体颗粒从癌细胞释放到体液中,这可以保护它们在循环中不被RNase降解。在血清、血浆、尿液、泪液、羊水和胃液中可检测到多种miRNA[10-11]。Ueda等[12]报告低表达let-7g、miR-433和miR-214的高表达与低生存率相关,与临床相关变量无关,包括淋巴结转移和分期。Li等[13]用实时PCR技术分析了100例胃癌患者的7种miRNAs表达谱,结果表明7种miRNAs可以预测胃癌患者的无复发和总生存率。因此,miRNAs可用于判断胃癌患者的预后,预测胃癌患者的生存率和复发率。
miR-92a家族是近年来发现的新型miRNA,目前研究认为,miR-92a家族基因与血管内皮细胞形成有关[14],其表达紊乱与肿瘤的发生发展密切相关。miR-92a在多种恶性肿瘤中过表达,具有致癌作用。研究发现miR-92a在肺、胃、前列腺、直肠和胰腺等肿瘤组织细胞中呈高表达[5]。Shigoka等[15]研究发现miR-92a在肝癌细胞中过度表达,但在肝细胞癌周围的非癌性肝细胞中未检测到miR-92a表达,其表达程度与患者的年龄、性别、病毒类型、临床分期和肿瘤分化无关。Motawi等[16]研究表明,与对照组相比,膀胱癌患者中miR-92a,miR-100和miR-143的定量表达水平显著降低,且这3种miRNA的表达水平与年龄、胆道疾病、TNM分期和等级之间均无相关性。Wu等[17]研究表明,基于粪便的miRNA具有良好的稳定性和高度可重复的检测性,与正常对照组相比,结直肠癌患者中的粪便miR-92a水平过表达。此外,粪便miR-92a水平对远端结直肠癌的敏感性高于近端结直肠癌。切除肿瘤或晚期腺瘤导致粪便miR-92a水平降低。Chen[18]等研究发现食管鳞癌患者癌组织中miR-92a的高表达可以促进食管鳞癌患者的淋巴结转移并预示食管鳞癌患者的生存期较短。
为分析miR-92a与胃腺癌发生、发展的关系,本研究通过实时荧光定量 PCR 手段检测出胃腺癌患者与健康者中血清miR-92a的Ct值,发现miR-92a在胃腺癌患者血清中表达明显升高。通过研究miR-RNA与临床病理特征的关系,结果显示血清miR-92a与胃腺癌患者的发病年龄、性别、肿瘤部位、肿瘤大小、分化程度无统计学意义,而与肿瘤的浸润深度、淋巴结转移、远处转移和临床分期等临床病理特征密切相关,推测血清miR-92a的高表达可能会导致胃肿瘤细胞的侵袭和转移。
Kaplan-Meier生存分析示血清miR-92a高表达组胃腺癌患者无进展生存期短于miR-92a低表达组,说明血清miR-92a高表达胃腺癌患者预后更差。Log-rank检验示,两组患者的生存曲线存在显著差异,且血清miR-92a高表达组胃腺癌患者的死亡风险更高,是低表达组的1.97倍。
综上所述,血清miR-92a水平成为胃癌判断预后的标志物之一,尚需进一步开展大样本的纵向研究确定其临床价值。本实验病例数尚少,血清中miR-92a浓度低,miRNAs检测方法的标准化和诊断阈值的确定仍是本次实验的难题,因此应在下一步的研究中扩充样本量,进行标准化检测。此外,miR-92a在胃癌发生发展中的具体的生物学机制尚不完全清楚,因此在下一步的研究中应寻找miR-92a在胃癌的发生和发展中的靶向调控机制,为miR-92a作为胃癌的早期诊断及预后评价指标提供理论依据。

