基质金属蛋白酶及其抑制剂与口腔扁平苔藓相关性研究进展*
张紫欣 综述 刘 雪 审校
(济宁医学院口腔医学院,济宁 272013)
口腔扁平苔藓(oral lichen planus,OLP)是一种常见的慢性炎症性口腔黏膜疾病,其组织病理学特征为:伴随密集亚上皮性淋巴细胞的浸润,基底膜被破坏、基底角质细胞发生凋亡。基质金属蛋白酶(matrix metalloproteinase,MMPs)可以通过降解细胞外基质中的多种蛋白成分造成基底膜的损伤,并参与炎症、变性、肿瘤转移等相关病理过程。目前学术界关于OLP发病机制较为主流的观点是:该疾病的发生发展由抗原特异性机制——细胞毒性T细胞的激活和非特异性机制——肥大细胞脱颗粒MMPS激活所介导[1]。金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase,TIMPs)通过直接抑制或间接活化酶原抑制MMPs的活性来维持其与MMPs的动态平衡[2]。OLP患者血清中MMPs的水平异常上调,TIMPs水平异常下调,提示OLP及其癌变与MMPs及TIMPs之间平衡状态的打破有着紧密联系。
1 MMPs的种类、特点与功能
MMPs是一类依赖Zn2+和Ca2+的蛋白水解酶,目前已分离鉴别出26个成员,分别命名为MMP1-26。根据MMPs的底物特异性和结构特征,MMPs一般被分为6类:胶原酶类(MMP-1、MMP-8、MMP-13、MMP-18)、明胶酶类(MMP-2、MMP-9)、基质降解酶类(MMP-7、MMP-26)、间质溶解素类(MMP-3、MMP-10、MMP-11)、膜型基质金属蛋白酶 (MT-MMP) 和其他类(MMP-12、MMP-19、MMP-20、MMP-21、MMP-23、MMP-27、MMP-28)[3]。
MMPs以酶原的形式维持细胞外基质(extracellular matrix,ECM)的正常组织结构和功能,并在组织重建和细胞间多种可溶性因子的调控过程中发挥重要作用,尤其在肿瘤的发生、侵袭和转移过程中有极其突出的表现,其催化机制依赖于活化中心Zn2+、Ca2+的活性和稳定性。
2 TIMPs的种类、特点与功能
TIMPs是内源性的基质金属蛋白酶抑制剂(MMP inhibitor,MMPI),是一种低分子量分泌型蛋白家族,对MMPs有特异性强效抑制作用,但TIMPs半衰期短、易失活,故其在临床上的应用具有一定局限性[3]。目前TIMPs家族已经发现了4位成员,即:TIMP-1、TIMP-2、TIMP-3、TIMP-4。TIMP-1广泛存在于体液与机体组织中,除对MMP-19、MMP-14、 MMP-16、 MMP-24亲和力较低以外,对其他MMPs均有较好的抑制作用。
TIMPs不仅可以有效抑制机体内MMPs的过度表达,还可以直接与细胞膜表面特异性受体结合,借助细胞膜表面信号传导通路,在刺激细胞增殖的同时,抑制细胞凋亡,精细调控细胞分化并协调组织新生血管的形成[4]。
3 MMPs与TIMPs的动态平衡
基质蛋白的分解以及组织结构的重建由TIMPs与MMPs共同参与调节。在正常机体中,TIMPs的合成和降解受到MMPs的调节,并且二者按1∶1的比例存在一定的平衡关系。当MMPs与TIMPs 之间的平衡被打破时,细胞外基质的降解与合成会发生紊乱,导致其正常生理功能失调,造成皮肤胶原变少,皮肤变薄[5],进而诱导皮肤和黏膜部位发生病变。
4 MMPs、TIMPs与OLP发病机制
4.1 OLP的免疫致病机制
与OLP病因相关的自身免疫因素,尤其是细胞功能的紊乱,在疾病的发生及演变中起着重要作用[6]。在OLP的发病过程中,抗原特异性与抗原非特异性机制均参与其中,后者主要包括肥大细胞的去颗粒化和MMPs的活化,细胞因子、趋化激素与MMPs等物质由OLP病损部位的肥大细胞释放,促进了 T 淋巴细胞激活、移动、增生与分化[7]。
在OLP的发病机制中,角质形成细胞作为靶细胞被某种未知的抗原攻击,并通过其趋化因子吸引免疫细胞聚集。随后,树突状细胞增多并进行抗原的呈递,CD4+T细胞被激活并分泌可促进CD8+T细胞等免疫细胞活化增殖的各类细胞因子。最后,增殖活化的CD4+T细胞和CD8+T细胞通过释放各种细胞因子和MMPs促使角质细胞的凋亡,引起OLP的病理性损伤[8]。因此,MMPs能促进基底膜发生降解,受损的基底膜可能无法提供角质细胞存活信号,导致角质细胞凋亡。此外,基底膜降解可促使CD8+细胞毒性T细胞进入上皮,导致角质细胞的进一步死亡[9]。由此可以推断,MMPs在OLP的免疫致病机制中发挥着重要作用。见图1。
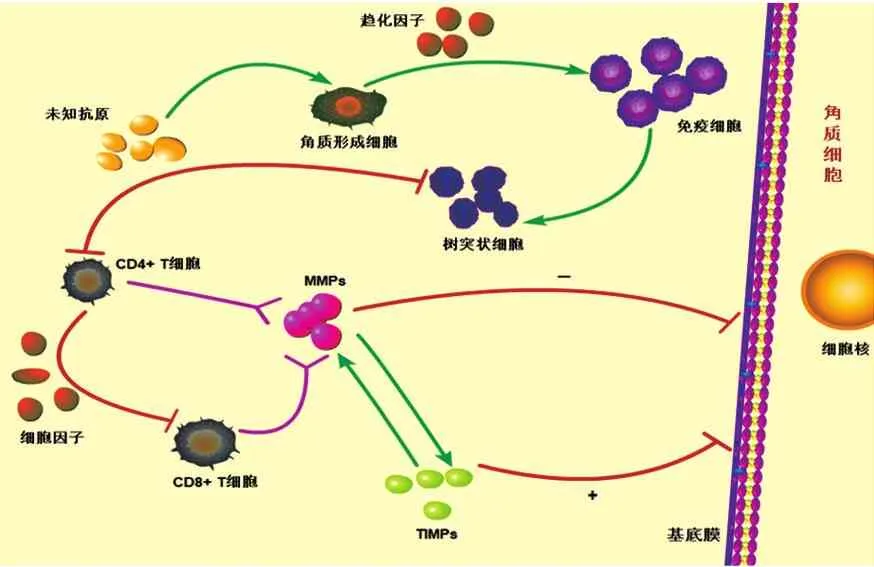
图1 MMPs及TIMPs在OLP病变发生发展中的相互作用机制
4.2 MMPs及TIMPs在OLP致病机制中的作用
MMPs与其抑制剂TIMPs之间的平衡失调对OLP病损部位基底细胞的损伤及重建中有着重要的影响。IV型胶原成分是基底膜中最主要的组成部分,只有像MMP-1、MMP-2、MMP-3、MMP-9和MMP-10这样的IV型胶原酶才能特异性地降解IV型胶原成分,并在此基础之上损坏基底膜的连续性与完整性。
MMPs家族中分布最广泛的成员是MMP-2,MMP-2可以通过降解IV型胶原来破坏基底膜,从而参与OLP的炎症损伤过程,并且在一定程度上与肿瘤的侵袭转移有关[10]。MMP-2极有可能参与了OLP的发生、发展和癌变,而MMP-2与TIMP-2之间的平衡失调也可能是导致OLP的诱因之一[11]。
MMPs是ECM降解所必需的蛋白水解酶,MMP-13在某种程度上可激活MMP-9和MMP-2,进而破坏ECM[12],而MMP-9与MMP-2同属可特异性降解基底膜带IV型胶原的明胶酶类,可促进淋巴细胞的转移,过表达的MMP-9特异性降解基底膜,进而导致角质形成细胞凋亡,同时角质形成蛋白分泌基底膜结构蛋白的能力大大降低,受损基底膜的修复功能因此失调,致使基底膜的损伤进一步加剧。损伤的基底膜产生存活素的能力减弱,不仅使角质形成细胞的凋亡加快,而且为T细胞向表皮内的移入创造了条件,使局部炎症反应进一步放大[13]。MMP-9与机体基底膜带的破损有着密切关系,MMP-9参与了OLP的病理过程,可能通过扩张血管,使得血管基底膜带的崩解或丧失,导致机体的血脑屏障受到严重破坏[14]。TIMP-1表达水平随着MMP-2和MMP-9活性的升高而增加的原因可能是:高表达的MMP-9对基底膜造成了损伤,为促进基底膜的修复,机体损伤修复系统被激活,促使TIMP-1的浓度增加,为阻止基底膜被进一步破坏,TIMP-1还具有生长因子活性[15]。但朱建华等[16]研究显示:MMP-9的表达水平虽然升高,但随着OLP病情加重,TIMP-1的含量并无明显升高,其原因可能是与TIMP-l的同源抑制剂如TIMP-2的表达水平升高有关,导致虽然OLP病情加重,但TIMP-1的表达水平升高不明显。
MMP-3也在OLP病程中发挥重要作用。MMP-3表达水平可以作为OLP患者和牙周炎患者预后的动态检测指标之一[17-18]。除此之外,MMP-1、MMP-7、MMP-8、MMP-10的表达水平在OLP病理组织中有所升高。
综上所述,在OLP的病损部位,多种MMPs都呈现高表达或过表达现象,而正常组织MMPs的表达水平非常低,只有当机体需要进行组织重塑时,MMPs的产生和激活才会被迅速诱导,提示在OLP病变过程中MMPs家族所介导的反应可能直接影响OLP的发展进程,且均与肿瘤癌变进程有一定的关联。MMPs与TIMPs之间的平衡关系也对ECM的降解和基底膜区的破坏有着重要影响,OLP患者病损部位MMP-9和TIMP-1的表达水平可作为预测OLP发生、恶化及预后评估的指标。
5 MMPs与OLP癌变
OLP已被WHO界定为癌前状态疾病,OLP恶性转化率可达2.28%。OLP绝大多数癌变为高分化的口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)。吸烟、酒精、免疫抑制剂、慢性炎症、某些病毒、基因突变的积累以及新鲜水果和蔬菜的低饮食增加了OLP患者的恶性转化风险。OLP病理组织中MMPs的高水平表达[17,20-24]可介导作为物理屏障的细胞外基质的破坏和基底膜的过度降解,从而诱导癌细胞浸润,进而发生扩散转移,加快OLP癌变进程。
在网格型OLP、侵蚀性OLP、OSCC早期和OSCC晚期患者的唾液和血清中,MMP-3的浓度顺次升高且差异具有统计学意义,提示唾液和血清中MMP-3的浓度与恶变的程度为正相关,表明MMP-3有可能作为诊断OLP和OSCC以及其预后评价的血清学标志物[17]。抑癌基因RECK具有TIMPs的功能,能在转录水平上抑制各类MMPs的生物活性。根据MMP-2表达水平的依次增加可推测其在OLP致病机制中起到一定作用且金属蛋白酶抑制剂RECK表达的高低可作为判断OLP癌变潜能的检测指标之一[20]。
MMP-9组织内高表达,进而破坏基底膜被广泛认为是恶性细胞转移侵袭的关键动作,MMP-9协助恶性细胞在OLP和OSCC组织中发生了侵袭和转移,促进了OSCC的发展,佐证了MMP-9在OLP癌变的过程中发挥着关键作用,还有研究认为MMP-9可以作为检测OSCC分级的血清学标志物之一[21]。
大量研究通过对比健康群体和OSCC患者体内MMPs的表达水平,从而进一步证明MMPs与OLP癌变具有密切联系。MMP-9在OSCC患者唾液中的表达显著高于健康对照组,且低分化的OSCC组唾液中MMP-9的平均水平显著高于中、高分化OSCC组,提示MMP-9表达水平的高低可以作为OSCC诊断、治疗和随访的血清学标志物[22]。OSCC患者血清中MMP-2及MMP-9水平较健康受试者均明显升高,MMP-2与肿瘤分级和淋巴结受累均显著相关,然而MMP-9仅与淋巴结受累有关[23]。可见MMP-9是否可以作为肿瘤分级的血清学标志物有待进一步研究。OSCC患者唾液中MMP-1的表达水平显著高于健康对照组。综上所述,OSCC患者血清中MMP-1,MMP-2,MMP-3以及MMP-9的表达水平都存在不同程度的上调,推进了癌细胞的浸润度和转移性,从而破坏了机体正常的组织学屏障[24]。明确OLP癌变标志物可帮助临床评估OLP癌变风险以及早期肿瘤分级,MMPs种类众多,各成员能否作为OLP癌变的血清学检测标志物目前仍不明确。
6 小结与展望
OLP的发生发展和癌变与血清、唾液中MMPs的异常高表达以及MMPs/TIMPs的平衡失调有着密切关系。OLP作为一种癌前病变,定期对患者体内MMPs表达水平以及MMPs/TIMPs比值进行监测,对于早期诊断OLP是否存在恶性转化的不良征象尤为重要。因此,临床上可通过检测病变组织的MMPs表达水平以及MMPs/TIMPs比值来作为诊断和监测OLP病情发展及癌变的参考指标。
众多因素的干扰导致OLP难治愈、病程长,亟需对OLP与MMPs及TIMPs的潜在相关性进行科学、深入的研究,以期为临床有效防治OLP提供可靠的理论依据。

