干扰长链非编码RNA NEAT1上调miR-126抑制胃癌细胞的生长、间质转换及裸鼠肿瘤形成*
陶正贵 杜静虎 田 葵 王东华 胡凤琪 陈 钰
(1. 湖北文理学院附属医院,襄阳市中心医院普外科,襄阳 441000)(2. 襄阳市中心医院肾内科,襄阳 441000)
核富集的转录物1(nuclear paraspeckle assembly transcript 1,NEAT1)是近年来研究新发现的一个长链非编码RNA,作为细胞核内paraspeckles的重要组成,主要用于维持细胞核内mRNA的稳定、调节基因的表达[1]。临床研究发现,NEAT1在肿瘤的发生发展过程中,都存在异常高表达现象,并且与肿瘤的转移、分期、预后等密切相关[2-3]。miRNA是广泛存在真核生物中具有保守性的一类特异性的核苷酸[4],可参与细胞的多种生物学行为,如细胞的增殖、分化、凋亡等[5-7]。miR126是一种高表达于内皮细胞、浆细胞样树突状细胞中的短链核苷酸[8],研究显示其在肿瘤细胞中表达水平显著降低;恢复肿瘤细胞miR126的表达水平后,肿瘤增殖明显受到抑制[9]。目前,关于长链非编码RNA NEAT1与miR-126的靶向关系及对肿瘤的生物学行为研究尚无报道。因此,本研究主要探讨长链非编码RNA NEAT1与miR-126的靶向关系及对胃癌细胞的生物学行为影响,并通过构建移植瘤裸鼠模型,分析NEAT1对肿瘤生长的影响。
1 材料与方法
1.1 主要试剂和仪器
胃癌细胞MGC-803、SGC-7901和人胃上皮细胞购自ATCC;SPF级BALB/c雌性裸鼠20只,4~6周龄,体质量17~20 g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2017-0022。DMEM培养液及胰蛋白酶(上海生工生物工程有限公司);胎牛血清(Gibco);LipofecamineTM2000 TRIzol反转录试剂盒(Thermo Fisher);SYBR PCR Master Mix试剂盒(TOYOBO);Ki67、Caspase-3、N-cadherin、E-cadherin、β-actin、蛋白抑制剂等(Santa Cruz);HRP羊抗兔IgG、HRP羊抗鼠IgG(Thermo);Ki67、Caspase-3成套免疫组化试剂盒(武汉博士德生物工程有限公司);NEAT1阴性对照病毒、NEAT1干扰shRNA(上海吉玛制药技术有限公司);细胞裂解液、ECL化学发光试剂、MTT试剂及其他试剂、耗材(北京索莱宝科技有限公司)。
CO2培养箱(SanYo);DNM-9606酶标分析仪(北京朗普新技术有限公司);湿转仪(AB);凝胶成像系统(DNR);PCR仪(Thermo);XD-202倒置显微镜(南京江南永新光学有限公司);FACSCalibur流式细胞仪(BD);电泳仪、图像采集及图像分析系统(Bio-Rad);其他仪器购自Eppendorf。
引物序列:①NEAT1引物。F:5′-GGCAGGTCTAG TTTGGGCAT-3′,R:5′-CCTCATCCC TCCCAGTACCA-3′;②β-actin引物。F:5′-CCTCG CCTTT GCCGA TCC-3′,R:5′-GGATC TTCAT GAGGT AGTCA GTC -3′;③miR-126引物。F:5′-AGTGCAGGGTCCGAGGTAT-3′;R:5′-GCCGCTCGTA CCGTGAGTAATAATG-3′。
1.2 方法
1.2.1细胞培养:用含10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的DMEN高糖培养基培养胃癌细胞MGC-803、SGC-7901和人胃上皮细胞GES-1,培养条件为37 ℃、5% CO2恒温恒湿。隔天换液1次,细胞融合度达到75%以上,3次传代后进行检测。
1.2.2慢病毒转染:取对数生长期的MGC-803和SGC-7901,调整细胞浓度为1×105个/mL,2 mL/孔,接种6孔板,继续培养,待细胞生长覆盖度达到50%按照试剂操作说明书要求进行慢病毒转染。阴性对照组(shRNA-NC)加入20 μL NEAT1阴性对照病毒(NEAT1-NC,滴度2×108TU/mL),实验组(sh-NEAT1)加入6 μL NEAT1干扰病毒(NEAT1-shRNA,滴度9×108TU/mL)及2 μL polybrene(5 μg/μL),对照组(control)加入20 μL培养基,转染过夜后(约16 h),每天更换新鲜培养基。培养5 d后,加入终浓度为 2 μg/mL嘌呤霉素筛选耐药细胞株,Western blot鉴定病毒转染效果,将转染成功的细胞用于后续实验。
1.2.3细胞增殖:根据EDU染色试剂盒说明书,检测细胞增殖。完全培养基稀释EDU溶液,作用浓度为10 μmol/L, 100 μL/孔,孵育2 h后弃培养基,PBS清洗2次,4%多聚甲醛固定,Apollo染色,立即检测或用抗荧光淬灭封片后,保存检测。
1.2.4流式细胞术检测细胞凋亡:取对数生长期细胞,调整细胞浓度为2.5×105个/mL,2 mL接种于6孔板,过夜培养(约16 h)。次日更换无血清培养基,诱导培养处理24 h。离心收集细胞于上样管,按照Annexin V-FITC试剂盒说明书向每管中依次加入150 μL AnnexinV-FITC结合液,3 μL AnnexinV-FITC和2 μL PI染液重悬细胞,室温暗室孵育15 min。加PBS至500 μL混匀过300目筛,30 min内上机检测,Cell Quest软件检测分析细胞凋亡情况。
1.2.5细胞侵袭实验:Transwell小室中将5 μg 纤黏连蛋白用移液器均匀涂抹在小室内的PVPF聚碳酸滤膜外表面;膜内侧表面涂5 μg基底胶。调整细胞量每室接种2×105个细胞,设置3个重复孔;培养4 h后PBS清洗3次并去除小室中膜内侧表面多余的细胞,4%多聚甲醛进行固定;随机选取10个视野, 倒置显微镜下采用双盲计数法统计膜下表面的细胞数目平均值。实验重复检测3次。
1.2.6划痕迁移实验:将划痕实验插件置于24孔板,取对数生长期的目的细胞,调整细胞量为5×105个,过夜培养(约16 h)。小心移去划痕实验插件,用完全培养基润洗3次,加入10 μmol/L丝裂霉素,继续培养2 h,更换新鲜完全培养基,显微镜下拍照,时间点为0 h,继续培养24 h拍照分析细胞的迁移情况。
1.2.7RT-PCR:依据TRIzol试剂盒提取各组细胞总RNA,测定RNA浓度及纯度,按照cDNA反转录试剂盒说明书,配置反转录PCR体系,设置PCR扩增程序进行反转录扩增,用SYBR PCR Master Mix试剂盒对miR-126表达水平进行检测,内参基因选择β-actin管家基因,引物的合成由Thermo Fisher完成。
1.2.8荧光素酶报告实验:用RT-PCR扩增miR-126片段,纯化后以pMIR-REPORT为基因载体,构建miR-126野生质粒,采用基因突变技术构建miR-126突变质粒,LipofecamineTM2000分别或同时对TPC-1细胞进行转染,各组荧光素酶活性依据Dual Luciferase报告基因试剂盒进行分析。
1.2.9蛋白表达检测:将目标细胞或组织裂解液冰浴裂解30 min取上清液提取总蛋白,酶标仪490 nm波长蛋白定量。12% SDS-PAGE电泳分离,采用湿转法将蛋白转至硝酸纤维素膜上,4 ℃条件依次加入封闭液孵育2 h,一抗孵育过夜(稀释比例均为1∶1 000),二抗孵育2 h(稀释比例均为1∶5 000)。用ECL化学发光试剂显色,在凝胶成像系统检测分析蛋白条带,蛋白表达定量分析用Image J图像分析软件对条带进行分析,内参采用β-actin。
1.2.10移植瘤裸鼠模型构建及处理:20只SPF级BALB/c 裸鼠随机分为2组,10只/组,对照组每只裸鼠左侧腋窝外侧皮下注射0.2 mL SGC-7901细胞培养液,模型组注射0.2 mL转染sh-RNA的SGC-7901细胞培养液,细胞接种量均为5×106个/只,SPF级饲养环境中分笼饲养,注射1周后记录每只裸鼠的成瘤情况,剔除移植瘤失败或30 d内死亡裸鼠,使用游标卡尺测量肿瘤的最大直径和最小直径,肿瘤体积=(最大直径×最小直径)2/2。30 d后,将裸鼠处死,体内完整的取下瘤组织精确称量瘤的质量。
1.2.11免疫组化分析:取各组裸鼠肿瘤组织样本,经4%多聚甲醛固定后,做成组织切片,按照试剂盒说明书操作进行Ki67和Caspase-3免疫组化染色,显微镜下观察组织中蛋白表达。
1.3 统计方法
2 结果
2.1 NEAT1在胃癌细胞中表达分析
通过胃癌细胞和正常的胃上皮细胞NEAT1 mRNA表达分析结果显示,NEAT1在胃癌细胞SGC-7901和MGC-803中的表达水平显著高于正常胃上皮细胞GES-1,差异有统计学意义(P<0.05)。慢病毒转染sh-NEAT1敲除肿瘤细胞中NEAT1,Western blot分析显示,与对照组相比,sh-NEAT1组SGC-7901和MGC-803细胞中NEAT1表达水平显著下降,差异有统计学意义(P<0.05),而shRNA-NC组细胞中NEAT1表达水平差异无统计学意义(P>0.05),见图1。
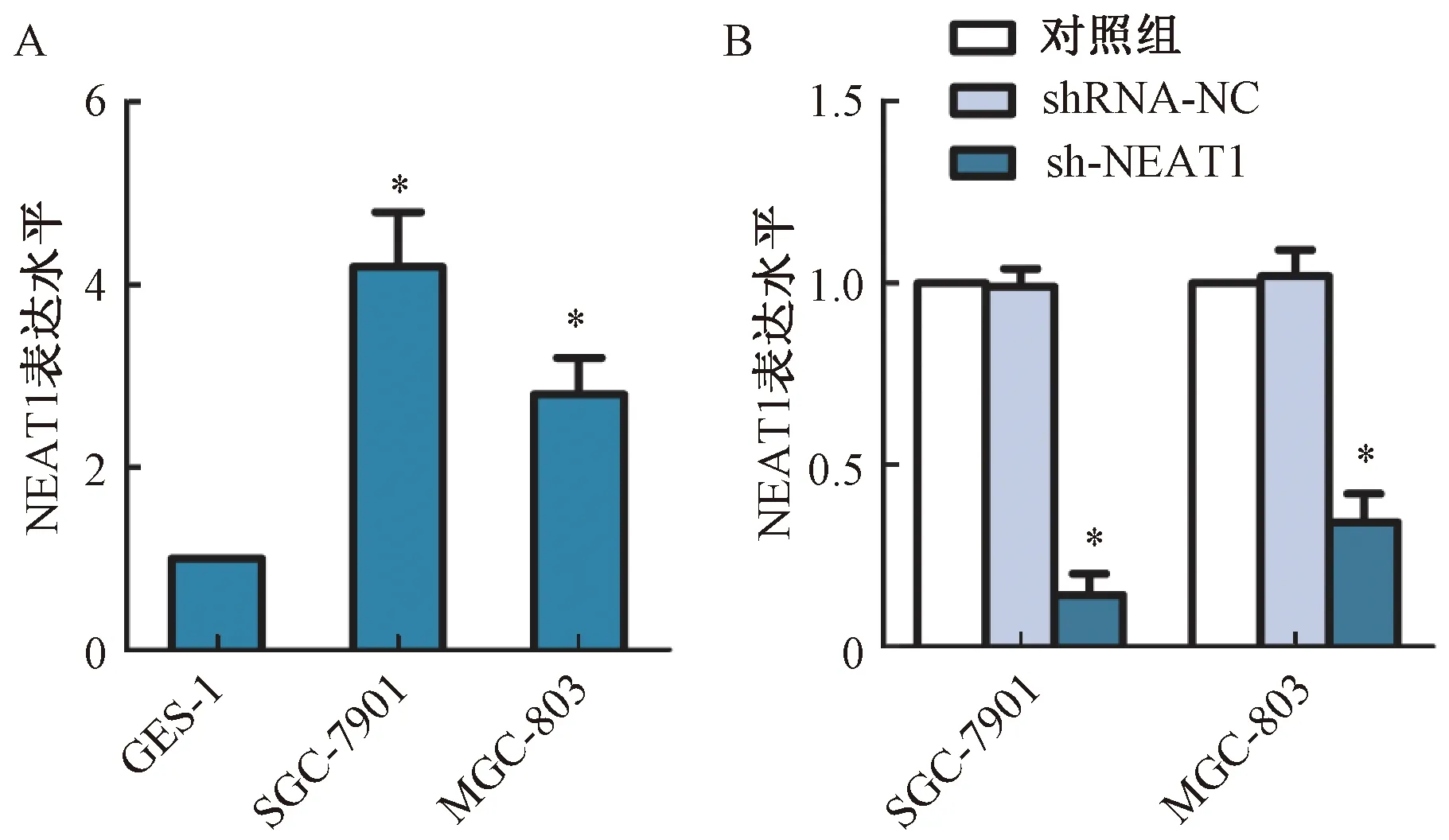
图1 NEAT1在胃癌细胞中表达分析注:与对照组相比,*P<0.05Fig.1 Analysis of NEAT1 expressionin gastric cancer cellsNote:Compared with control group,*P<0.05
2.2 NEAT1沉默对胃癌细胞增殖的影响
通过BrdU分析NEAT1沉默对胃癌细胞增殖的影响结果显示,与对照组相比,sh-NEAT1组SGC-7901和MGC-803细胞增殖水平显著下降,差异有统计学意义(P<0.05),而shRNA-NC组细胞的增殖水平差异无统计学意义(P>0.05),见图2A。通过Western blot对各组细胞Ki67蛋白表达分析显示,与对照组相比,sh-NEAT1组SGC-7901和MGC-803细胞中Ki67表达水平显著下降,差异有统计学意义(P<0.05),而shRNA-NC组细胞中Ki67表达水平差异无统计学意义(P>0.05),见图2B。流式细胞术分析NEAT1沉默后细胞凋亡情况结果显示,与对照组相比,sh-NEAT1组SGC-7901和MGC-803细胞的凋亡比例显著上升,差异有统计学意义(P<0.05),而shRNA-NC组细胞凋亡情况差异无统计学意义(P>0.05),见图2C。Western blot结果显示,与对照组相比,sh-NEAT1组SGC-7901和MGC-803细胞中Caspase-3表达水平显著升高,差异有统计学意义(P<0.05),而shRNA-NC组细胞中Caspase-3表达水平差异无统计学意义(P>0.05),见图2D。
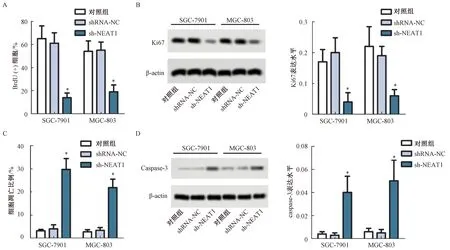
图2 NEAT1沉默对胃癌细胞增殖的影响注:与对照组相比较,*P<0.05Fig.2 Effect of NEAT1 silencing on proliferation of gastric cancer cellsNote:Compared with control group,*P<0.05
2.3 NEAT1沉默对胃癌细胞侵袭及迁移能力的影响
通过Transwell小室和划痕实验分析NEAT1沉默对胃癌细胞侵袭、迁移能力的影响结果显示,与对照组相比,sh-NEAT1组SGC-7901和MGC-803的浸润细胞比例显著减少,划痕细胞覆盖率明显降低,差异均有统计学意义(P<0.05),而shRNA-NC组细胞的浸润比例和划痕覆盖率差异无统计学意义(P>0.05),见图3A、图3B。Western blot分析显示,与对照组相比,sh-NEAT1组SGC-7901和MGC-803细胞中E-cadherin表达水平显著升高,N-cadherin表达水平明显下降,差异均有统计学意义(P<0.05),而shRNA-NC组细胞中E-cadherin和N-cadherin表达水平差异无统计学意义(P>0.05),见图3C。

图3 NEAT1沉默对胃癌细胞侵袭及迁移能力的影响注:与对照组相比,*P<0.05Fig.3 Effect of NEAT1 silencing on invasion and migration of gastric cancer cellsNote: Compared with control group,*P<0.05
2.4 NEAT1靶向miR-126关系分析
靶向基因在线软件分析发现,miR-126序列中存在NEAT1的结合位点(图4A)。分析各组细胞miR-126的表达水平结果显示,miR-126在胃癌细胞SGC-7901和MGC-803中的表达水平明显低于正常胃上皮细胞GES-1,差异有统计学意义(P<0.05),见图4B。NEAT1基因沉默后,胃癌细胞SGC-7901和MGC-803的miR-126表达水平显著增高,差异有统计学意义(P<0.05),见图4C,表明NEAT1能够抑制miR-126表达。靶向调控关系的荧光素酶结果(图4D)显示,miR-126作用后NEAT1野生质粒的荧光素酶活性显著降低,差异有统计学意义(P<0.05),而NEAT1突变质粒的荧光素酶活性无明显影响,这表明NEAT1和miR-126之间存在靶向调控关系。

图4 NEAT1靶向miR-126关系分析Fig.4 Analysis of relationship of NEAT1 targeting miR-126
2.5 NEAT1/miR-126对生长和运动的调节
BrdU增殖结果显示,沉默NEAT1后,SGC-7901细胞的增殖明显受到抑制(P<0.05),miR-126抑制剂能促进SGC-7901细胞的增殖,并显著减弱sh-NEAT1对SGC-7901细胞的增殖抑制作用(P<0.05,图5A)。流式细胞术结果显示,沉默NEAT1后,SGC-7901细胞的凋亡比例显著增加(P<0.05),miR-126抑制剂能促进SGC-7901的细胞凋亡,并显著抑制sh-NEAT1对SGC-7901细胞的凋亡诱导作用(P<0.05,图5B)。Transwell小室和划痕实验结果显示,沉默NEAT1后,SGC-7901细胞的侵袭、迁移能力明显受到抑制(P<0.05),miR-126抑制剂能促进SGC-7901细胞的侵袭、迁移,并显著减弱sh-NEAT1对SGC-7901细胞侵袭、迁移能力的抑制作用(P<0.05),见图5C、图5D。

图5 NEAT1/miR-126对生长和运动的调节注:与对照组相比,*P<0.05;与sh-NEAT1组相比,#P<0.05Fig.5 Regulation of growth and movement by NEAT1/miR-126Note:Compared with control group,*P<0.05;Compared with sh-NEAT1 group,#P<0.05
2.6 NEAT1对裸鼠体内肿瘤的影响
裸鼠体内抗肿瘤结果显示,NEAT1基因沉默后,与对照组相比,sh-NEAT1组裸鼠肿瘤的体积增大速度明显低于对照组(P<0.05,图6A),但sh-NEAT1组裸鼠肿瘤质量显著高于对照组(P<0.05,图6B)。分析肿瘤组织中蛋白表达水平结果显示,NEAT1基因沉默后,与对照组相比,sh-NEAT1组裸鼠肿瘤细胞中NEAT1的表达水平显著降低,miR-126的表达水平显著升高(P<0.05,图6C)。免疫组化结果显示,NEAT1基因沉默后,与对照组相比,sh-NEAT1组裸鼠肿瘤组织中Ki67的表达量显著降低,Caspase-3的表达量显著增加(P<0.05,图6D);Western blot结果显示,NEAT1基因沉默后,与对照组相比,sh-NEAT1组裸鼠肿瘤组织中N-cadherin的表达量显著降低,E-cadherin的表达量显著增加(P<0.05,图6E、图6F)。

图6 NEAT1对体内肿瘤的影响注:与对照组相比,*P<0.05Fig.6 Effects of NEAT1 on tumors in vivoNote: Compared with control group,*P<0.05
3 讨论
长链非编码RNA多是由RNA聚合酶Ⅱ转录而来,其长度约200 bp。研究显示,多数的长链非编码RNA为原癌基因,虽然不具有蛋白质翻译功能,却通过参与其他基因的表达调控,影响细胞的增殖、侵袭和转移[10-12]。NEAT1是由人11号染色体上的多发性内分泌瘤病基因位点的RNA聚合酶Ⅱ转录而成,它能够与多个靶基因相结合,调控靶基因的表观遗传谱,从而促进癌基因的表达,促进肿瘤的生长和转移[13]。miR-126在机体内主要发挥抑肿瘤作用。
本研究结果显示,NEAT1在胃癌细胞SGC-7901和MGC-803中的相对表达水平显著高于正常胃上皮细胞GES-1,与Choudhry等[14]在乳腺癌中的研究结果一致。通过病毒转染sh-NEAT1对干扰肿瘤细胞NEAT1表达后发现,SGC-7901和MGC-803细胞中NEAT1相对表达水平显著下降,而转染shRNA-NC组细胞中NEAT1相对表达水平无明显变化,表明慢病毒转染能够获得稳定sh-NEAT1胃癌细胞系。通过BrdU染色[15]检测细胞增殖发现,转染sh-NEAT1后SGC-7901和MGC-803细胞BrdU阳性细胞率明显减低,表明细胞增殖受到了抑制。对细胞中Ki67蛋白表达水平检测发现,Ki67蛋白相对表达水平明显降低,由于Ki67是一种存在于增殖细胞中的核抗原,与染色质的合成、细胞有丝分裂密切相关[16],其表达水平降低,表明能够抑制肿瘤细胞的增殖。流式细胞术结果显示,转染sh-NEAT1后,SGC-7901和MGC-803细胞的凋亡率明显升高,细胞中Caspase-3表达水平也明显升高。Caspase-3是参与和执行细胞凋亡的重要蛋白,当凋亡信号传递并激活下游Caspase-3的表达时,表明细胞已进入凋亡不可逆时期[17]。NEAT1表达沉默后,胃癌细胞的增殖能力明显降低,凋亡水平明显升高,可见NEAT1能够通过促进细胞增殖抑制细胞凋亡发挥原癌基因的作用。
上皮间质转化(EMT)是指上皮细胞暂时丧失细胞极性并有间质细胞特征,获得移动能力。本研究通过Transwell小室和划痕实验分析NEAT1沉默对胃癌细胞侵袭、迁移能力的影响,结果显示,沉默NEAT1后,胃癌SGC-7901和MGC-803的侵袭能力和迁移能力明显受到抑制。Western blot分析显示,肿瘤细胞中E-cadherin表达水平显著提升,N-cadherin表达水平明显下降,由于细胞发生EMT过程中,肿瘤细胞通过改变自身细胞形态,丧失细胞极性,与其他细胞分离,形成伪足,增强自身的迁移能力[18-19]。同时通过下调细胞黏附因子E-Cadherin的表达[20],上调质型细胞标记物如波形蛋白(Vimentin)[21]、N-Cadherin表达,将角蛋白细胞骨架变为波形细胞骨架,促进细胞穿透胞间连接,增强细胞的侵袭能力[22]。沉默NEAT1的表达后,SGC-7901和MGC-803细胞的N-cadherin的表达显著降低,表明其EMT机制显著受到抑制,从而降低肿瘤细胞的侵袭能力。
本研究结果显示,miR-126在胃癌细胞中的相对表达水平明显低于正常胃上皮细胞GES-1,与Rouigari等[23]关于miR-126能够发挥抑癌作用的研究一致。NEAT1沉默后,胃癌细胞SGC-7901和MGC-803的miR-126表达水平显著增高(P<0.05),表明NEAT1能够抑制miR-126表达,本研究发现miR-126是NEAT1的潜在靶向位点,miR-126作用后,NEAT1野生质粒的荧光素酶活性显著降低,而NEAT1突变质粒的荧光素酶活性无明显影响,这进一步证实了NEAT1靶向调控miR-126。由于NEAT1基因沉默后,胃癌细胞SGC-7901的miR-126表达水平相对高于MGC-803细胞,因此本研究选择SGC-7901细胞研究NEAT1/miR-126对生长和运动的调节,结果显示NEAT1沉默后使用miR-126 inhibitor能够恢复沉默NEAT1引起的SGC-7901细胞的增殖、侵袭、迁移抑制,细胞凋亡增强的细胞表型,提示在胃癌细胞中NEAT1能够上调miR-126表达抑制细胞增殖,通过阻断EMT机制降低肿瘤细胞的侵袭及转移能力。
体内移植瘤实验表明,NEAT1基因沉默后,裸鼠肿瘤的体积增长受到抑制,但sh-NEAT1组裸鼠肿瘤质量显著高于对照组,这可能是由于sh-NEAT1抑制肿瘤细胞的EMT机制,抑制细胞侵袭能力,促使细胞在局部增殖,从而使得肿瘤体积未变,而质量显著增加。免疫组化结果显示,NEAT1基因沉默后,裸鼠肿瘤组织中Ki67和N-cadherin的表达量显著降低,而Caspase-3及E-cadherin的表达量显著增加,表明sh-NEAT1在体内依旧能够发挥抑制肿瘤细胞侵袭转移的作用。
综上所述,干扰长链非编码RNA,NEAT1能够上调胃癌细胞中miR-126的表达水平,通过诱导细胞凋亡以抑制胃癌细胞的增殖,同时抑制细胞的EMT机制,达到抑制肿瘤的侵袭、转移及裸鼠肿瘤形成的目的。

