补肾清肝疏脾法对2型糖尿病SD大鼠模型肠道菌群改善及MAPK信号通路的影响*
范艳艳 陈 晟 邢 俊 陈劲宇
(1. 江苏省南通市中医院急诊内科,南通 226001)(2. 南通市第一人民医院骨科,南通 226001)
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种以糖代谢紊乱为主、慢性的、全身性的代谢性疾病[1],已成为继心脑血管疾病及肿瘤之后的又一严重危害人类健康的慢性非传染性疾病,并造成了相当严重的经济损失[2-3]。
最新的研究发现,肠道菌群与T2DM的发生发展密切相关,并对T2DM存在多种不同调节机制。MAPK信号通路在维持机体内的葡萄糖稳态等生理过程中发挥重要作用[4-5]。无菌小鼠实验表明,肠道微生物菌群的组成与无菌小鼠肥胖增加及MAPK信号通路中的短链脂肪酸受体(GPR)41、43及胰高血糖素样肽-1(glucagon-like peptide,GLP-1)在远端小肠的表达降低相关[6]。而GPR41的缺乏与酪氨酰酪氨酸肽(PYY)蛋白的表达减少有关。PYY是一种肠道分泌的细胞源性激素,通常会抑制肠道蠕动,增加肠道转运率,减少从饮食中获取能量(短链脂肪酸)。由此可见,MAPK信号通路中GLP-1与PYY是通过肠道菌群与T2DM有密切关系,GLP-1和PYY的变化可能是调节肠道菌群的因素之一[7-10]。
因此,本研究通过观察补肾清肝疏脾法对高脂高糖餐诱导的2型糖尿病SD大鼠模型血糖、血脂、胰岛素、体质量等指标及其与肠道菌群结构的影响,并测定小肠远端GLP-1和PYY的含量,探讨中医补肾清肝疏脾法对肥胖与糖尿病的治疗效果。
1 材料与方法
1.1 实验动物
SPF级健康SD雄性大鼠,体质量180~200 g, 6~8周龄,由湖南斯莱克景达实验动物有限公司提供,实验动物生产许可证号:SCXK(湘)2016-0002。常规条件饲养,按正常昼夜节律调节光照时间,保持室温22~26 ℃,相对湿度50%~60%。
1.2 模型制备
1.2.1造模方法:SD大鼠经8周高脂高糖饲料(鼠维持饲料 67.5%、猪油10%、蔗糖20%、蛋黄粉2.5%)饲喂。造模成功的大鼠需满足:体质量及增长情况显著大于空白组,且造模组大鼠空腹一次性腹腔注射pH 4.4枸椽酸钠缓冲液配制的STZ溶液30 mg/kg,7 d后经大鼠尾静脉取血,血糖值为16.7~30 mmol/L。
1.2.2分组:造模成功的大鼠随机分为模型对照组(对照组)和补肾清肝疏脾组(实验组),正常饲养组(空白组)给予普通饲料,每组8只。补肾清肝疏脾组大鼠采用蒸馏水制备的中药方剂进行灌胃,按照“动物与人体的每千克体质量剂量折算系数表”中等剂量计算,大鼠灌胃剂量(g)=6.25×2×人剂量×(鼠体质量/人体质量),大鼠灌胃容积为20 mL/kg,根据剂量和容积可以得出给药浓度(总药材量/灌胃容积)。每周按大鼠体质量计算灌胃药量,其他两组灌胃无菌水。三组大鼠喂养6个月之后,采集样品,进行分析研究。
1.3 观察指标
1.3.1肠道菌群的检测:粪便基因组DNA提取试剂盒提取大鼠粪便基因组总DNA,-20 ℃冻存。用实时荧光定量PCR(qPCR)方法对大鼠粪便中乳酸杆菌、双歧杆菌、大肠杆菌及粪肠球菌16S rDNA V3可变区进行定量分析并制作标准曲线,将提取的大鼠粪便基因组DNA进行以上4种菌株16S rDNA V3可变区qPCR反应,反应体系及反应条件与标准曲线制备相同,即:预变性95 ℃、15 min;变性95 ℃、10 s;最佳退火温度(双歧杆菌61 ℃、乳酸杆菌55 ℃、大肠杆菌51 ℃、粪肠球菌52 ℃)、20 s;延伸72 ℃、30 s;共50个循环,反应完毕后进行熔解曲线分析。根据读取的荧光数据,由系统软件Eppendorf Mastercycler ep realplex 自动分析Ct(PCR扩增过程中,扩增产物的荧光信号达到设定的阈值时所经过的循环次数),将Ct值代入标准曲线,得出大鼠粪便样品中4种菌株的含量。
1.3.2肠道GLP-1和PYY表达的测定:取大鼠远端小肠样本,提取蛋白, Western blot检测PYY、GLP-1的含量,使用大鼠PYY ELISA检测试剂盒(北京嘉美纽诺生物科技有限公司)进行PYY表达的测定。
1.3.3宏观生理生化指标的测定:每天测量大鼠进食量,每周测量1次大鼠体质量。生化法测定血脂和空腹血糖(FBG),放免法测定空腹胰岛素(FINS),并通过以下公式计算胰岛素分泌指数(HOMA-β)。
HOMA-β=20×FINS/(FBG-3.5)。
1.4 统计方法
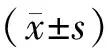
2 结果
2.1 各组大鼠肠道菌群的变化
由表1可知,对照组大鼠肠道内双歧杆菌、乳酸杆菌显著降低,而粪肠球菌、大肠杆菌数量均出现了明显的增加。
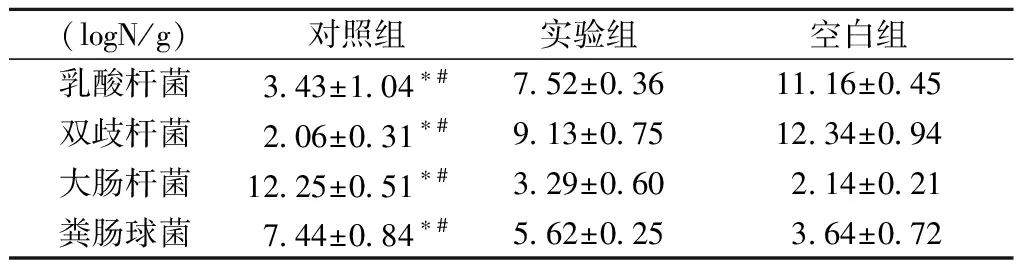
表1 各组大鼠实验6个月后肠道菌群的变化情况Table 1 Changes of intestinal flora of rats ineach group after 6 months of experiment
2.2 各组大鼠远端小肠GLP-1和PYY的表达情况
各组大鼠远端小肠GLP-1和PYY的表达情况如图1~图3所示,空白组与对照组相比,具有显著性差异;使用补肾清肝疏脾法对大鼠进行治疗后,GLP-1含量较治疗前有显著性差异。ELISA结果显示,空白组与对照组相比,PYY含量未见显著性变化,而实验组大鼠其含量则显著性增加。
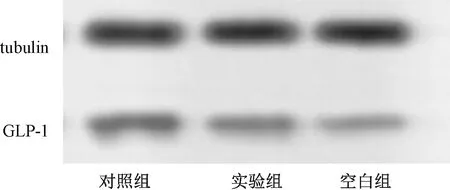
图1 各组大鼠远端小肠GLP-1的表达Fig.1 The expression of GLP-1 in the distalsmall intestine of rats in each group
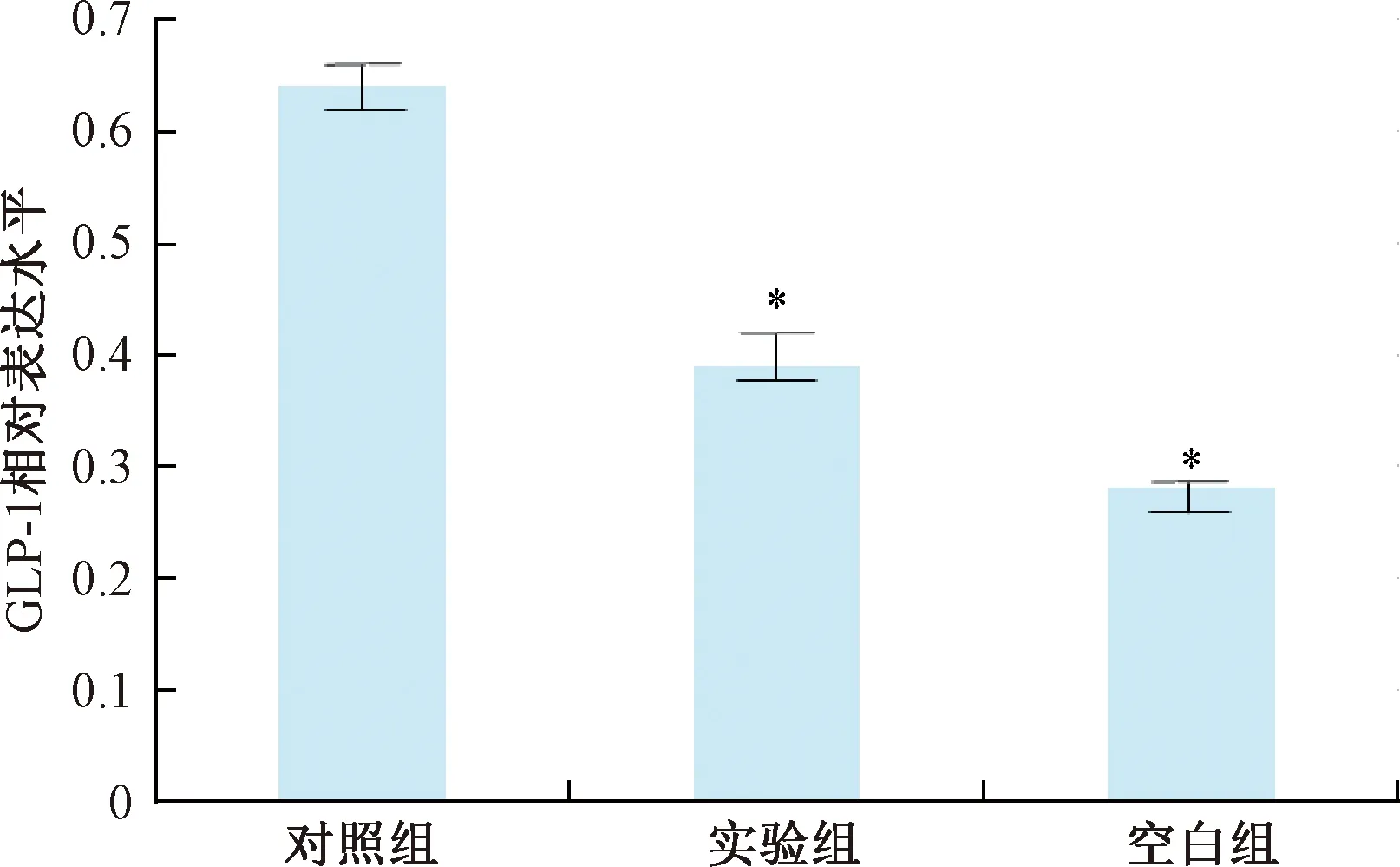
图2 各组大鼠远端小肠GLP-1表达量的比较注:*P<0.05Fig.2 Comparison of GLP-1 expression in the distalsmall intestine of rats in each groupNote:*P<0.05
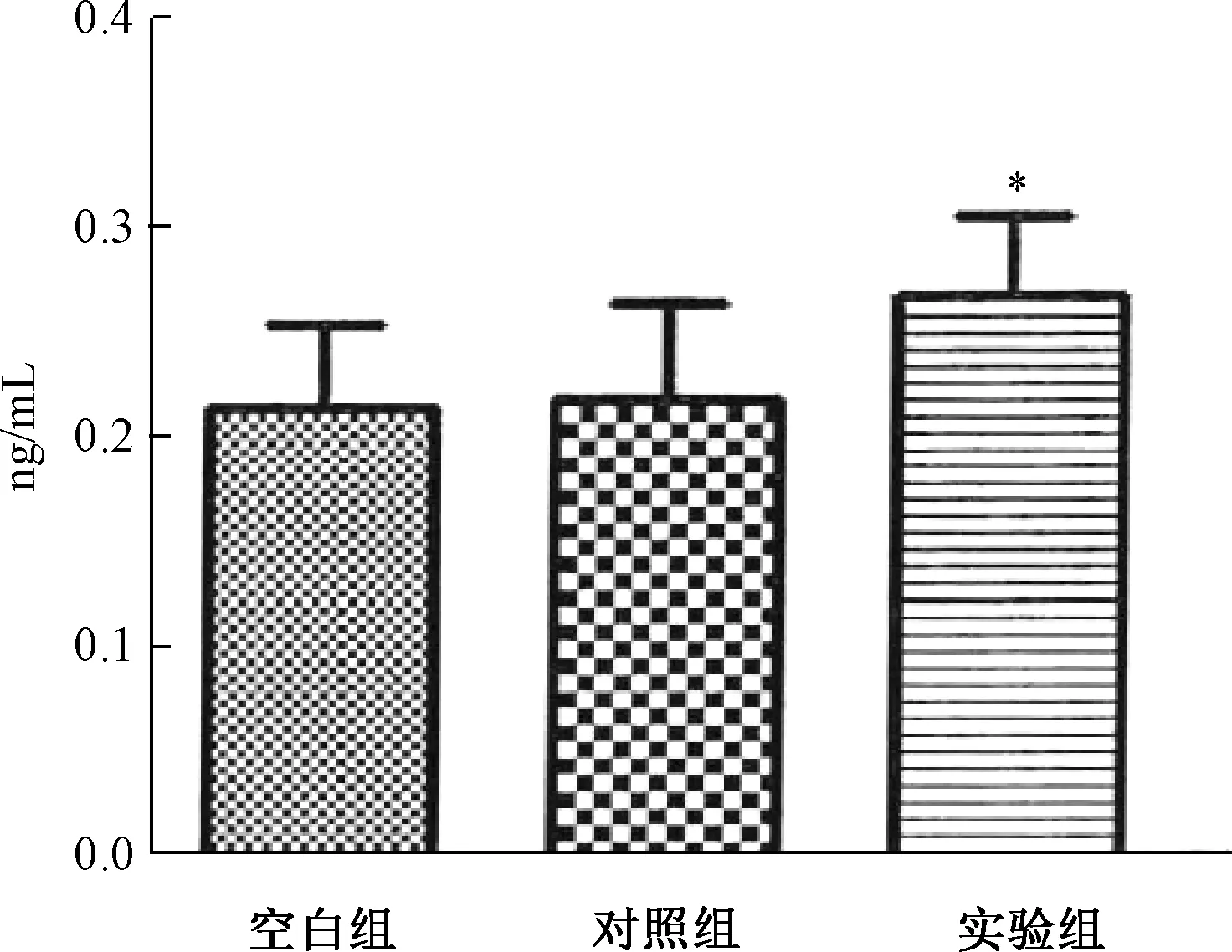
图3 各组大鼠远端小肠PYY的表达注:*P<0.05Fig.3 The expression of PYY in the distal smallintestine of rats in each groupNote:*P<0.05
2.3 各组大鼠宏观生理生化指标的变化
各组大鼠血糖、血脂、HOMA-β、体质量在实验0、3、6个月时的变化情况见表2和图4~图7。从表2可以看出,建立糖尿病模型后,对照组大鼠血糖、血脂、HOMA-β、体质量与空白组相比,0、3、6个月的时间点,均有显著性差异。经过中药汤剂灌胃的大鼠与对照组相比,各指标均有不同程度的改善。
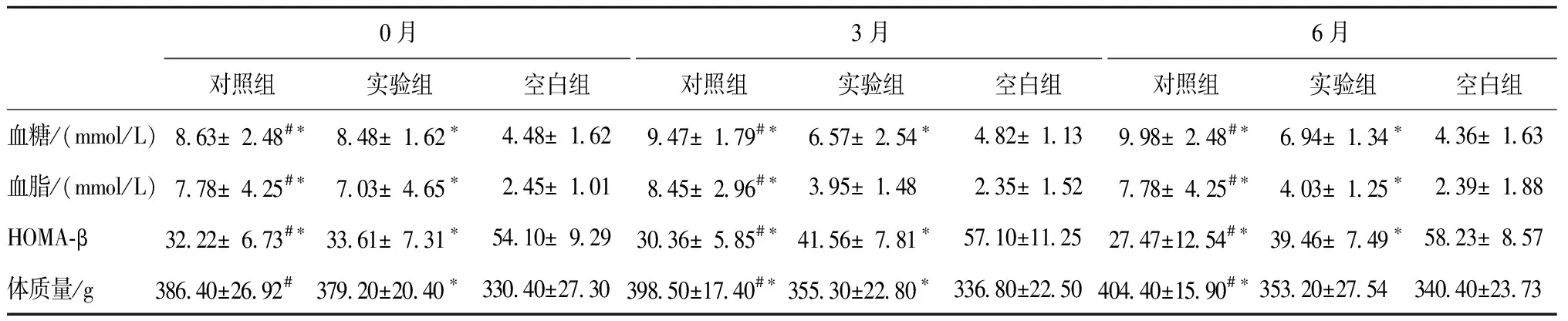
表2 各组大鼠宏观生理生化指标的变化Table 2 Changes of macroscopic physiological and biochemical indexes of rats in each group
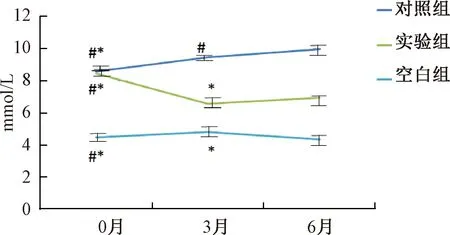
图4 各组大鼠血糖的变化注:与空白组相比,*P<0.05;与实验组相比,#P<0.05Fig.4 Blood glucose changes of rats in each groupNote: Compared with the blank group,*P<0.05;Compared with the experimental group,#P<0.05

图5 各组大鼠血脂的变化注:与空白组相比,*P<0.05;与实验组相比,#P<0.05Fig.5 Blood lipid changes of rats in each groupNote: Compared with the blank group,*P<0.05;Compared with the experimental group,#P<0.05

图6 各组大鼠HOMA-β的表达注:与空白组相比,*P<0.05;与实验组相比,#P<0.05Fig.6 HOMA-β expression of rats in each groupNote: Compared with the blank group,*P<0.05;Compared with the experimental group,#P<0.05
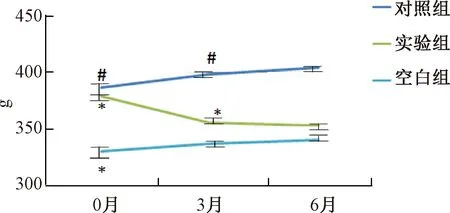
图7 各组大鼠体质量的变化注:与空白组相比,*P<0.05;与实验组相比,#P<0.05Fig.7 Body weight changes of rats in each groupNote: Compared with the blank group,*P<0.05;Compared with the experimental group,#P<0.05
3 讨论
中医典籍中将2型糖尿病归属于“消渴”范畴。现代中医多认为2型糖尿病病因病机为脾胃运化失常、肝失疏泄、痰瘀内阻、湿热内蕴。脾主运化,若饮食不节,则使中焦之气壅滞,阻碍脾胃运化,导致运化失职脾不散精,物不归化则为痰、湿、浊。中药及天然植物中的很多成分口服利用率低下,其需要经过肠道菌群的转化才能被宿主有效利用,且其对肠道菌群结构有影响作用,因此肠道菌群可能是中药发挥疗效的靶点和关键点[11]。
以往研究表明,肠道菌群与2型糖尿病息息相关,可通过短链脂肪酸(乙酸盐、丙酸盐、丁酸盐)激活 Gpr41导致PYY增加。 PYY是一种36-氨基酸肽,主要由位于回肠和大肠肠黏膜的l细胞分泌。PYY(3-36)抑制肠蠕动,并可激活PYY和GLP-1分泌增加,抑制脂肪细胞胰岛素信号,减少脂肪积聚,可能具有治疗人类肥胖的潜力[12]。而G蛋白偶联受体(GPCRs)中的 MAPK信号通路,是2型糖尿病治疗的重要发现靶点之一。许多MAPK蛋白,如GLP-1可能直接参与胰岛素抵抗的发展和β细胞功能障碍,炎症的病因可能导致肥胖引发的2型糖尿病[13-14]。本研究中空白组与对照组之间的PYY含量并不存在显著性差异,由此可见,糖尿病大鼠与正常大鼠PYY表达并无较大差异,PYY的表达并不因大鼠饮食的变化而变化。但实验组中发现PYY含量增加,说明补肾清肝疏脾法治疗激活PYY的表达,可以起到增强的消化功能与糖代谢机能,促进大鼠健康。我们预测,如果对空白组大鼠使用补肾清肝疏脾法进行治疗,仍能够增加其PYY的表达。
前期笔者辨证使用补肾清肝疏脾法治疗上百例2型糖尿病患者,随访半年以上,均得到不同程度的改善,现通过动物实验,证明补肾清肝疏脾法能够改善糖尿病模型大鼠的血糖、血脂、HOMA-β及体质量。此外,本研究对大鼠肠道菌群及结肠GLP-1、PYY的研究证明,补肾清肝疏脾法能够改变肠道菌群结构,并影响结肠GLP-1和PYY的含量,其影响与前文研究中丙酸-GPR43-GLP-1/PYY通路的机制相类似。综上所述,本研究用大鼠糖尿病模型证明了补肾清肝疏脾法对糖尿病的控制作用,其作用机制可能是通过改善肠道菌群、GLP-1及PYY含量进行的。

