m6A甲基化在妇科肿瘤中的作用研究进展*
王博,马剑,马晓欣
110022 沈阳,中国医科大学附属盛京医院 妇产科
妇科肿瘤包括子宫颈癌、子宫内膜癌、卵巢癌等,严重威胁全球妇女的健康。其中子宫颈癌是女性第四大常见癌症,每年约有超过528 000例以上的新发病例和266 000例死亡病例;卵巢癌病例仅在2018年就新增295 414例,死亡184 799例[1];而子宫内膜癌在西方国家以及我国部分发达城市中,发病率更是高居妇科肿瘤的首位。近年来大量研究表明m6A甲基化修饰在妇科肿瘤恶性生物学行为及肿瘤放疗抵抗方面有着重大意义,已成为当下研究热点。
1 m6A甲基化概述
RNA表观遗传学修饰是RNA调节的重要环节[2]。而N6-甲基腺嘌呤(N6-methyladenosine,m6A)是高等真核生物中最常见的mRNA内部修饰[3-4],m6A修饰的腺嘌呤数量占到了腺嘌呤总数的0.2~0.5%[5]。m6A是位于腺嘌呤的第6位氮原子的甲基化修饰,主要分布于终止密码子附近和3′-非翻译区(3′-untranslated region,3′UTR)[6-8],定位于保守的RRACH序列(R=G或A;H=A,C或U)中[9-11],并广泛分布于mRNA和非编码RNA(non-coding RNA,ncRNA)中,在mRNA剪接、微小RNA(microRNA,miRNA)的加工成熟、长链非编RNA(long non-coding RNA,lncRNA)介导的转录抑制等多种RNA的代谢过程中发挥重要作用[12-13]。
2 m6A相关酶
2.1 m6A甲基化酶(Writers)
METTL3、METTL14以及WTAP形成m6A甲基转移酶复合物[14-16],这种甲基化酶也被称为“Writers”[17],m6A甲基转移酶复合物通过S-腺苷蛋氨酸转移酶上的甲基基团,在靶mRNA上添加m6A甲基化[18]。METTL3是该复合物的催化核心酶,METTL14是METTL3的结构支持伴侣,METTL3-METTL14可诱导哺乳动物核RNA上的m6A沉积[19-20]。除了这三个经典的甲基化酶以外,也有实验证明VIRMA、HAKAI、ZC3H13等也在m6A甲基化的过程中发挥重要的作用[21-22]。
2.2 m6A去甲基转移酶(Erasers)
FTO(ALKBH9)和ALKBH5被报道具有去甲基化的活性[23-24],FTO基因被敲低后,mRNA中m6A水平升高,而过表达野生型的FTO中,mRNA中m6A水平显著降低,证明了FTO具有去甲基化的功能[23]。ALKBH5定位于细胞核中,沉默或者过表达ALKBH5均可改变m6A水平[24]。
2.3 m6A识别蛋白(Readers)
m6A识别蛋白通过读取m6A甲基化从而调控mRNA的相关生物学行为及行使相应功能,能与RNA结合的YTH结构域家族是第一个被发现能直接识别m6A的“Readers”[25],YTH家族蛋白包括YTHDF1~3和细胞核成员YTHDC1~2[26-28]。也有实验表明IGF2BPs也可以作为m6A甲基化的识别蛋白,发挥相关生物学功能[29]。此外在哺乳动物细胞中与m6A关联的蛋白还有eIF3等[30]。
3 m6A调控RNA的生物学行为及可能机制
m6A甲基化修饰在调控RNA生物学行为中起到了重要作用。近些年来的研究表明,mRNA生物学行为调控的全过程都受到m6A甲基化修饰的调控[31]。此外,m6A在lncRNA和miRNA的生成及功能等方面也发挥了重要调控作用[32]。
3.1 m6A调控mRNA的生物学行为及可能机制
m6A可以调控mRNA的剪接及成熟。例如,FTO控制RUNXITI的可变剪接(RUNXITI是一种与脂肪形成相关的转录因子),影响脂肪形成[33],也有实验表明敲除FTO可显著调节pre-mRNA剪切过程中的外显子跳跃事件,并且上调3′末端外显子的表达[34]。
mRNA从细胞核到细胞质的转运是连接转录和翻译的关键过程[35],这个过程可选择性地调控基因的表达。METTL3的缺失可抑制mRNA的核输出[36],细胞内ALKBH5的敲除可加速靶mRNA从细胞核向细胞质的转运[24]。
m6A可通过多种机制促进翻译,主要包括:YTHDF1可以促进核糖体装载,并招募43S复合物促进翻译[6],YTHDF3可以通过与YTHDF1和eIf4A3结合促进翻译起始[28]。
mRNA的稳定性与m6A依赖的降解过程密切相关。与未甲基化的mRNA相比,YTHDF2与m6A标记的mRNA的亲和力高约16倍,衰减率明显提高,半衰期缩短[37-38](图1)。
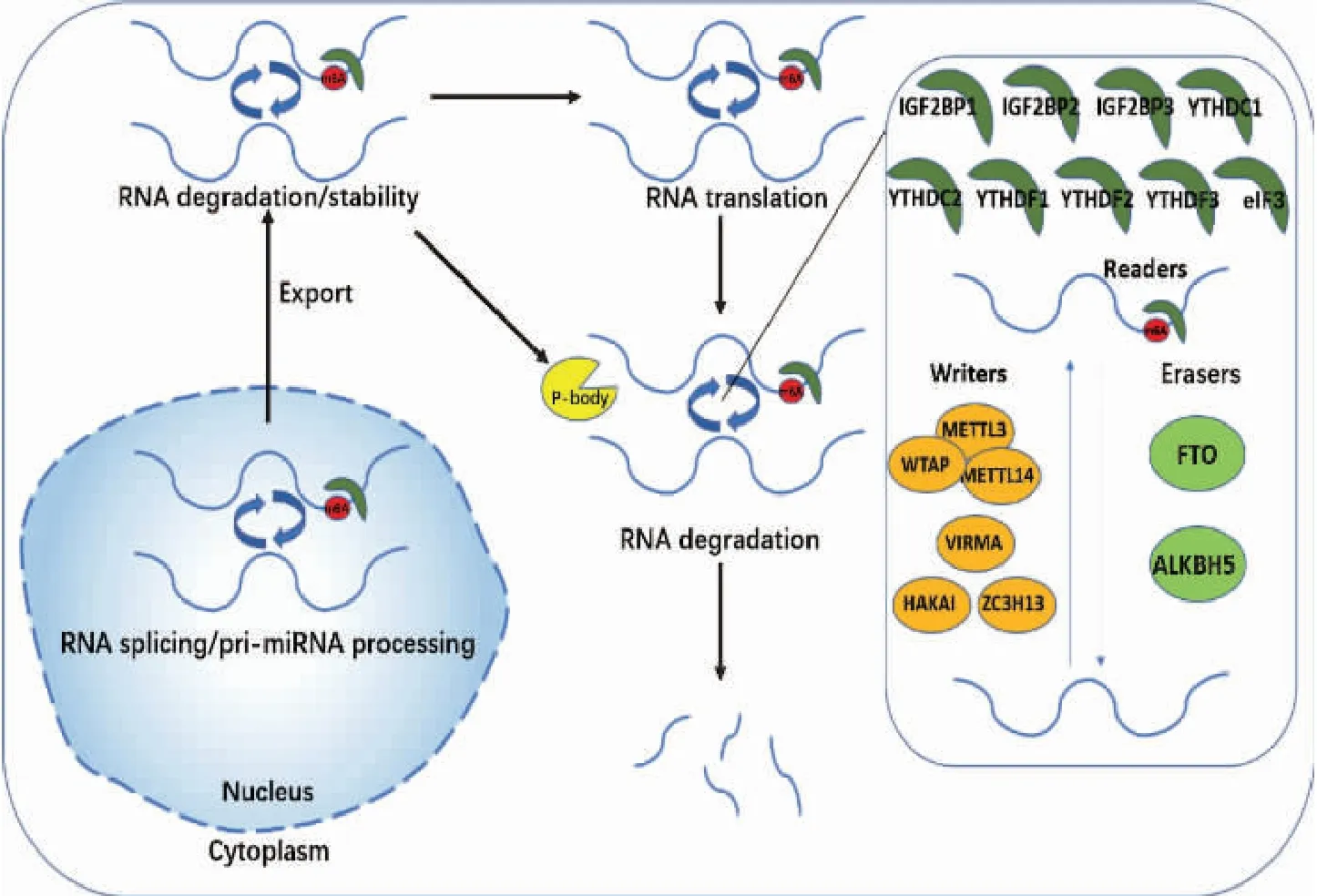
图1 “Writers”、“Erasers”和“Readers”在RNA上m6A甲基化修饰中作用的分子机制
3.2 m6A调控lncRNA和miRNA的生物学行为及可能机制
除了mRNA外,lncRNA和miRNA也受到m6A的调控。例如,有研究表明METTL3通过上调lncRNA ABHD11-AS1上的m6A甲基化修饰,从而增强其稳定性,进而增加了非小细胞肺癌的增殖和Warburg效应[39]。当然lncRNA上有m6A修饰位点,功能受到m6A甲基化的调节,同样lncRNA作为一种功能性RNA也可以调节m6A相关酶的活性,来调控其他分子水平的m6A修饰。有研究表明DMDRMR可以结合m6A识别蛋白IGF2BP3来增强其活性,通过m6A依赖的方式来稳定细胞周期激酶CDK4和3种细胞外基质成分(COL6A1,LAMA5和FN1),从而增强了透明细胞肾细胞癌细胞中G1/S过度,促进细胞增殖[40]。另一方面有实验表明m6A甲基化酶METTL14调控has-miR-146a-5p表达,从而影响乳腺癌细胞的迁徙和侵袭[41]。m6A甲基化修饰一方面可以调控mRNA,lncRNA和miRNA的生物学行为,另一方面mRNA,lncRNA和miRNA之间本身也存在复杂的调控,m6A甲基化修饰也参与复杂的调控网络的发生,是其中的重要环节。总之,不能孤立的看待m6A甲基化修饰,m6A甲基化修饰作为复杂RNA调节网络中的重要一环,在未来仍需要进一步研究。
4 mRNA上m6A甲基化修饰在妇科肿瘤发生发展中的作用
4.1 m6A甲基化与宫颈癌
近期不少研究发现m6A甲基化修饰与宫颈癌的发生发展存在密切联系,有研究就表明m6A水平降低与FIGO分期、肿瘤大小、分化程度、淋巴结浸润及肿瘤复发显著相关[42]。Wang等[43]研究发现METTL3靶向己糖激酶2(HK2)mRNA的3’-非翻译区(3’UTR)并招募m6A阅读器YTHDF1来增强HK2的稳定性,从而促进宫颈癌细胞的增殖和好氧糖酵解。另一项研究也表明METTL3促进PDK4的5’UTR的m6A修饰,进而增加其mRNA的稳定性促进其表达来促进宫颈癌的发生发展[44]。也有研究发现m6A去甲基化酶FTO通过调控m6A修饰E2F1和Myc转录本,在调节宫颈癌细胞的增殖和迁移中发挥重要的致癌作用[45](图2)。在宫颈癌相关研究中,m6A甲基化修饰是一把双刃剑,过度修饰或者修饰水平过低都可能会导致肿瘤的发生发展。细胞中整体m6A甲基化修饰水平和局部m6A甲基化修饰水平都是我们进一步研究的重点。
4.2 m6A甲基化与卵巢癌
复杂且可逆的m6A修饰是卵巢癌中一个新发现的调控方式。有研究就发现METTL3总体水平升高是子宫内膜样上皮性卵巢癌患者生存期相关的独立因素[46]。其他研究也揭示了METTL3与卵巢癌进展相关,Liang等[47]实验发现METTL3下调可能通过激活线粒体凋亡途径和AKT信号通路使卵巢癌细胞凋亡增加,另一方面Hua等[48]研究发现METTL3通过上调受体酪氨酸激酶AXL促进卵巢癌上皮-间质转化。生物信息学分析也发现同为甲基化酶的WTAP表达升高与卵巢癌预后恶化之间存在显著相关性[49]。
去甲基化酶也在卵巢癌进展中起到重要作用,Huang等[50]研究发现FTO升高通过降低3’UTR m6A水平和两个磷酸二酯酶基因(PDE1C和PDE4B)mRNA稳定性,增强第二信使3’,5’cAMP信号通路,抑制了卵巢癌干细胞特性。有趣的是同样作为去甲基化酶的ALKBH5则表现出相反的功能,Jiang等[51]研究发现高表达toll样受体(TLR4)激活NF-κB通路,上调ALKBH5的表达,mRNA去甲基化后NANOG表达增加,从而增强卵巢癌细胞的侵袭性。
作为“Readers”的YTHDF1也在卵巢癌进展中也起到重要作用,Hao等[52]发现经过m6A甲基化修饰的TRIM29可以招募YTHDF1,来促进顺铂耐药卵巢癌细胞中的TRIM29的翻译。另一项研究也显示YTHDF1能促进卵巢癌的发生和转移[53](图3)。总之,m6A甲基化在卵巢癌的发生、发展、侵袭和耐药性中起到重要作用。
4.3 m6A甲基化与子宫内膜癌
除了卵巢癌,m6A甲基化在子宫内膜癌进展中也发挥重要作用。Liu等[54]研究发现METTL3/METTL14表达减少使得m6A甲基化修饰水平降低,进而导致AKT负性调控因子PHLPP2的表达减少,而AKT正调控因子mTORC2表达量增加,激活AKT通路导致子宫内膜细胞的增殖和致肿瘤性增强。去甲基化酶也同样发挥重要作用,研究发现FTO可以催化HOXB13 mRNA 3‘UTR区域的去甲基化修饰,从而消除YTHDF2蛋白对m6A修饰的识别,减少了HOXB13 mRNA的衰变和增加HOXB13蛋白的表达进而激活WNT信号通路和下游蛋白的表达,促进子宫内膜癌的发生发展[55]。另一种去甲基化酶ALKBH5也发挥促进子宫内膜癌的作用,Chen等[56]研究发现ALKBH5通过mRNA去甲基化来促进SOX2转录,从而维持子宫内膜癌干细胞状态和肿瘤特性。另一研究发现ALKBH5能去除IGF1R mRNA上的m6A修饰,从而增加mRNA的稳定性,促进IGF1R翻译,激活IGF1R信号通路进而促进子宫内膜癌的发生发展[57](图2)。整体上看,m6A水平降低是子宫内膜癌发生发展的重要特性。
总之mRNA上m6A甲基化修饰在妇科肿瘤的进展中发挥重要作用,未来m6A甲基化进一步机制的阐明、相关药物治疗、诊断和预后生物标志物的发掘在未来仍需要进一步的研究。
5 LncRNA上m6A甲基化修饰在妇科肿瘤发生发展中的作用
除了mRNA外,lncRNA也受m6A的调控。有研究发现ZAFS1能抑制miR-647,促进宫颈癌细胞增殖、迁移和侵袭,这种RNA-RNA相互作用受到METTL3介导的m6A修饰的调控[58]。也有研究表明lncRNA GAS5-AS1的下调与宫颈癌FIGO分期显著相关,GAS5-AS1与肿瘤抑制因子GAS5相互作用,在体外功能上显著降低宫颈癌细胞的增值、迁移和侵袭,在体内显著抑制宫颈癌的致肿瘤性和转移。LncRNA GAS5-AS1与RNA去甲基化酶ALKBH5相互作用,降低了GAS5的m6A修饰,提高其稳定性。此外m6A介导的GAS5 RNA的降解依赖于m6A阅读器YTHDF2依赖的通路[59]。此外,lncRNA KCNMB2-AS1可作用于下游miR-130b-5p和miR-4294,miR-130b-5p和miR-4294又可以作用于更下游的靶点IGF2BP3。IGF2BP3是一种RNA结合蛋白,可作为m6A的阅读器,而lncRNA KCNMB2-AS1具有m6A位点,IGF2BP3通过m6A修饰阻止KCNMB2-AS1的降解。因此KCNMB2-AS1与IGF2BP3之间形成了一个由m6A修饰介导的前馈调控回路。m6A修饰的KCNMB2-AS1在宫颈癌中通过调控miR-130b-5p/miR-4294/IGF2BP3信号轴发挥促癌lncRNA作用[60](图2)。有研究表明lncRNA RHPN1-AS1上的m6A修饰可以减少自身的降解,提高自身稳定性,能导致卵巢癌细胞中RHPN1-AS1上调。RHPN1-AS1作为海绵miR-596的ceRNA,能增加LETM1的表达并激活FAK/P13K/Akt信号通路,促进卵巢癌细胞的增殖和转移[61](图3)。
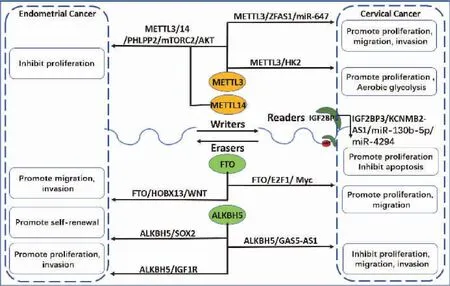
图2 m6A调控蛋白在子宫内膜癌和宫颈癌中的作用
6 miRNA上m6A甲基化修饰在妇科肿瘤发生发展中的作用
不仅lncRNA受到m6A甲基化修饰的调控,miRNA也受到m6A甲基化修饰的调控,有研究发现METTL3能促进miR-126-5p的成熟,进而靶向作用于PTEN,激活P13K/Akt/mTOR通路,促进卵巢癌的进展和肿瘤发生[62]。同样,Li等[63]研究发现细胞中YTHDF2升高能显著促进上皮性卵巢癌细胞系的增殖和迁移,而YTHDF2还可以和miR-145形成双负反馈回路,通过间接调控m6A水平参与上皮性卵巢癌的进展(图3)。
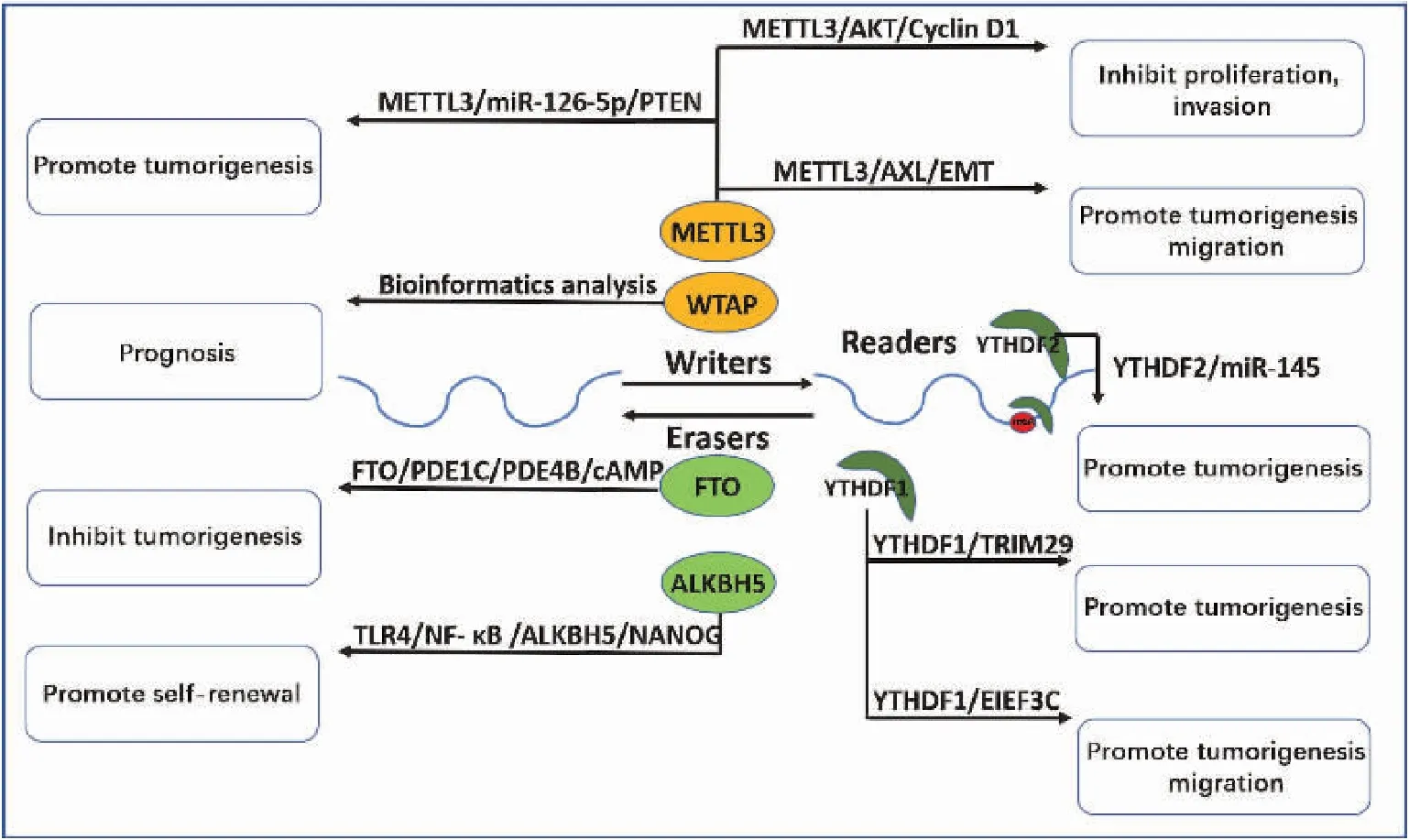
图3 m6A调控蛋白在卵巢癌中的作用
7 总结与展望
在m6A甲基化酶、m6A去甲基转移酶和m6A识别蛋白的共同可逆调节下,m6A甲基化修饰涵盖了mRNA、lncRNA和miRNA等各种RNA生命历程的各个阶段。通过这种表观遗传学m6A甲基化修饰,来调节mRNA、lncRNA和miRNA等各种RNA发挥相应的功能,进而改变肿瘤细胞相关基因表达,从而促进妇科肿瘤的发生发展。有趣的是在宫颈癌的不同研究中,甲基化酶METTL3和去甲基转移酶FTO表达增高均能促进宫颈癌的发生发展[43,45]。在卵巢癌的不同研究中METTL3增高有时可以作为促进癌症进展的因素,有时可以作为抑制的癌症因素[46-47]。已有的研究提示:1)m6A甲基化修饰是一把双刃剑,过度修饰或者修饰水平过低都可能会导致肿瘤的发生发展;2)同一m6A甲基化相关酶,在不同作用通路上可能具有不同功能;3)m6A甲基化修饰不仅局限于mRNA上,也存在于lncRNA、miRNA和其他RNA上,这为我们研究提供了广泛的研究空间;4)m6A甲基化相关酶也可以作为lncRNA、miRNA调控靶点,影响其他RNA的m6A甲基化水平;5)m6A甲基化酶除了调控m6A水平外,还可能具有其他独立功能,例如METTL3除了具有甲基转移酶活性,还能增强癌症基因的翻译,独立于其催化亚基影响癌症进展[64]。这也为我们拓展了m6A的研究思路。
m6A甲基化在妇科肿瘤中的作用研究已经取得不少进展,然而也存在许多机遇与挑战:1)m6A在妇科肿瘤中的作用仍有争议,这些功能特点是m6A在mRNA和亚细胞阅读器的不同区域波动分布造成的,考虑到代谢网络之间广泛相互影响,维持代谢过程之间的内环境平衡尤为重要,这也是我们未来要考虑的因素之一;2)m6A及其调控因子是否可以作为妇科肿瘤诊断和预后的潜在生物标志物,这些生物标志物的特异性和敏感性有待探索;3)有研究表明m6A调控因子及相关通路可作为治疗靶点,但缺乏在大样本的临床实践中的具体应用,其副作用在很大程度上尚不清楚;4)m6A甲基化修饰和其他表观遗传学修饰之间存在联合效应还是相减效应有待进一步探索;5)已有的妇科肿瘤研究大多针对甲基化酶与去甲基转移酶,而对于阅读器的研究较少,这也是我们未来探索的方向之一。相信随着对m6A修饰RNA后功能变化研究的不断深入,一定可以为我们早期诊断妇科恶性肿瘤和寻找治疗靶点提供参考依据。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

