微生物数码显微培养计数系统在固体粉末样品检测中的应用
廖燮恒,赵海锋
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.高露洁棕榄(中国)有限公司,广东广州 510620)
微生物检测,是食品,药品,化妆品等领域产品的重要释放指标[1]。随着社会产品的多元化,人民对健康越来越重视,对产品的质量要求也越来越高[2]。一方面,社会发展,政府为保障消费者对质量监控加大力度,检测方法逐渐与国际接轨,质量对应的法律法规更加严谨,而食源性污染又是食品行业最突出的问题[3,4]。另一方面,产品竞争也愈演愈烈,商家都希望能通过自动化手段降低产品成本,增加竞争力。微生物的传统检测具有时间长,人工操作多的特点,需要数天才能完成,往往成为产品释放时间的瓶颈,商家需要为此建立起对应的原料以及成品库存,当有超标事故发生,往往是数天之后,连续生产的产品可能已经受到多天的污染。因此,可靠的微生物自动快速检测技术,能为检测结果提供预警信号的仪器,受到市场上的广泛关注[5-8]。
市面上有不少成熟的微生物自动化检测技术,大部分是采取非琼脂培养的方式。例如,利用ATP技术,有Celsis和Charm。利用电化学法,有梅里埃的Tempo和Sy-Lab的Bactrac。利用颜色变化法,有梅里埃的Bact/Alert。利用流式细胞技术,有BD的Microcount,Foss公司的BactoScan和梅里埃的Chemunex。除此之外,还有酶联免疫法ELISA[9],荧光定量PCR法[10,11],高通量测序技术结合传统培养技术[12],阻抗法[13],快速测试纸片[14],分子生物学法等。另外一些方式是利用一些预警的软件而达到控制风险的目的[15]。企业在正式实施这些方法前,需要有完整的方法验证作为支持,以证明代替方法与传统方法一致或者更加严格。
传统的微生物检测技术,是通过倒琼脂平皿,然后放置到合适的温度中培养,培养数天后人工目视读数结果。微生物检测的过程中,关键步骤结果读数,大多数是依赖人工目视读数,并且依赖于实验员的主观经验[16]。目前有不少学者研究通过自动化的技术例如影像菌落读数仪器对培养皿菌落进行自动计数[17-19]。我们尝试使用下文中的Microu3D检测仪器,在不改变微生物实验中的培养基、温度、时间等培养条件的情况下,通过仪器对培养过程中平皿变化的连续监控,探讨其与传统的人工目视读数结果间的一致性,以拓展其在食品和日化品中微生物快速检测的应用。
1 材料与方法
1.1 材料和试剂
试验菌株:Escherichia coli ATCC 8739大肠埃希氏杆菌、Staphylococcus aureus ATCC 6538金黄色葡萄球菌、Candida albicans ATCC 10231白假丝酵母菌和Aspergillus brasiliensis ATCC 16404巴西曲霉购买于KWIK-STIK Plus Culture,Microbiologics。
培养基:Modified Letheen Agar (MLA)、Sabouraud Dextrose Agar (SDA)和TAT购于美国BD公司。
1.2 仪器与设备
微生物数码显微培养计数系统MicroBio u3D 252398,BD公司;高压灭菌锅,美国Steris公司;培养箱BD240,Binder公司;纯水仪Elix-10,密理博公司;生物安全柜A2,Thermo公司;超净工作台ACB-4A1,Thermo公司;比浊仪,BBL公司。
1.3 方法
1.3.1 培养基制备及灭菌
按照供应商指引准备好MLA,SDA,TAT和生理盐水。培养基在121 ℃下灭菌15 min。琼脂培养基使用前放置于46 ℃水浴锅中保温,稀释剂和生理盐水灭菌后冷却至常温使用。
1.3.2 菌悬液的制备
准备多支0.85%的生理盐水,用于稀释菌悬液。无菌条件下将目标菌株转接到MLA/SDA平板上进行划线和菌种复苏,得到新鲜菌株。金黄色葡萄球菌和大肠杆菌:将细菌划线到MLA平板上,放置于30 ℃的培养箱内培养18~24 h,获得新鲜菌种。白色念珠球菌:将霉菌划线到SDA平板里面,放置于22.5 ℃的培养箱内培养24~48小时。巴西曲霉:将霉菌划线到SDA斜面试管,放置于22.5 ℃的培养箱内培养7~8 d,准备好比浊仪,将菌悬液调整到麦氏浓度0.5(0.5 McFarland standard)。此时金黄色葡萄球菌和大肠杆菌的浓度为1.5x108CFU/mL,用1:10的浓度进行稀释得到107CFU/mL、106CFU/mL、105CFU/mL、104CFU/mL、103CFU/mL,共6个菌液浓度。而白色念珠球菌的浓度为1.0×106CFU/mL,按同样的方法稀释得到105CFU/mL、104CFU/mL、103CFU/mL。用50 mL的生理盐水,对霉菌斜面试管进行润洗,利用玻璃珠将霉菌芽孢洗脱。对其进行1:10稀释四次,此时每10 μL的菌悬液大约为20 CFU。
1.3.3 倾注法平板计数
1.3.3.1 只接种标准菌株
将目标菌种的菌悬液移到平皿中,每种菌的接种梯度为两个,分别是20 CFU左右的低浓度接种和150 CFU左右的高浓度接种,每个平板倒入15~20 mL琼脂培养基,摇匀,待凝固,分别放入自动读数仪和培养箱内进行培养。细菌平板培养温度为30 ℃,真菌平板培养温度为22.5 ℃,培养时间为96 h。
1.3.3.2 标准菌株中加入杂质的影响
在平皿中先加入1 g珍珠粉末作为杂质,然后接种约50 CFU左右的标准菌株。每个平板倒入15~20 mL琼脂培养基,摇匀,待凝固,分别放入自动读数仪和培养箱内进行培养。细菌平板培养温度为30 ℃,真菌平板培养温度为22.5 ℃,培养总时间为96 h。
1.3.3.3 实际应用
使用某种白色粉末原料,进行常规的微生物污染检测,使用TAT作为肉汤,然后分别倾注MLA培养基作为细菌计数平板,SDA培养基作为真菌及霉菌计数平板。
1.3.4 计数对比
每天分别记录自动读数仪和培养箱内平板的读数,记录,并对两种方法的结果进行比较,利用数据分析软件Minitab对相关性R2和比值%进行评价。
1.4 数据统计与分析
采用SPSS 23对数据进行处理,所有数据结果均以平均值±标准差表示,并用Origin 8.0作图。
2 结果与讨论
2.1 结果与分析
2.1.1 仪器与读数
仪器外观如图1a所示,它具有微生物培养箱的功能,可以设定不同的温度,通过每30 min一次的图片采集(图1b),形成3D图像(图1c),判断菌落生长的形成,确认它是否菌落。由于照片是连续的,所以可以实现生长情况的连续监控,如果有超标的情况可以实时得知。

图1 MicroBio 3D仪器外观以及检测原理Fig.1 Appearance and detection principle of MicroBio 3D

图2 培养标准菌落时仪器读数和目视读数的相关性Fig.2 Correlation of both methods for microbial colony detection

图3 加入杂质时仪器读数和目视读数的相关性Fig.3 Correlation of both methods for microbial colony detection supplementation with residue
2.1.2 仪器读数和目视读数的一致性
金黄色葡萄球菌、大肠杆菌、白假丝酵母菌和黑曲霉在MLA和SDA培养基中培养96 h后,分别采用目视法和仪器法进行计数,两种方法的相关性如图2所示。由图2可知,对于金黄色葡萄球菌,大肠杆菌和白假丝酵母菌,机器读数与目视读数的相关性都在95%以上,而对于巴西曲霉,机器读数与目视读数的相关性为85%,表明两种方法在测试菌株上具有很高的等效性。
2.1.3 杂质对机器读数的影响
将添加有珍珠粉杂质的样品,接种4种实验菌株,然后测试杂质对供试菌株读数的影响,结果如图3所示。由图3可知,对于金黄色葡萄球菌,大肠杆菌和白假丝酵母菌,机器读数与目视读数的相关性都在95%以上,表明杂质对机器读数的影响较小;而对于巴西曲霉,机器读数与目视读数的相关性是75%,说明杂质对霉菌的检测结果影响较大。这可能与霉菌的生长形态有关,当霉菌生长成熟时在琼脂表面菌落会蔓延,可能会遮挡其他菌落的形成,加上杂质的影响,图片采集时可能出现阻挡的情况而使机器的检出率降低。
2.1.4 Boxplot分析

图4 标准菌仪器读数与目视读数的比值Fig.4 Ratio of results obtained by both methods

图5 加入杂质时仪器读数与目视读数的比值Fig.5 Effects of residue on the ratio of results obtained by both methods
参考AOAC指引,接种回收率比值的可接受范围是50%~200%。比值%=机器读数值除以目视读数的数值。图4展示了4种实验菌株的回收率和离散性,大肠杆菌,金黄色葡萄球菌和白假丝酵母菌的回收率平均值分别为112%,105%和114%,具有良好的回收率,而巴西曲霉的回收率平均值是155%。巴西曲霉之所以被检测出超过100%的回收率,一个原因可能是对于在霉菌孢子周围形成的新菌落,机器比肉眼更敏感故能检测出来。另一个原因可能是对于邻近几个菌落形成的片状,人眼的读数会报读成一个菌落,而机器能检测出原始扩散点而读数更高。图5是当加入杂质时对机器读数的影响,从图5中看到几个回收值均比单纯培养标准菌落时要下降,这可能是当菌落较小时,杂质会对微小的菌落形成阻挡而令镜头无法拍摄到。
2.1.5 图像
机器能实时显示出时间与菌落读数的趋势图,从图中发现,检测出的速度与回收率,与菌种的类型与菌落形态有很大关系。金黄色葡萄球菌和大肠杆菌,能在24 h内完成检测。对于白假丝酵母菌,使用MLA培养基培养的平板能在24 h到达范围,而使用SDA平板的需要到48 h才能到达,这与培养的温度有关,SDA培养的温度较低,故菌落生长相对慢。而巴西曲霉,需要到72 h才能完成检测,这也是由其生长特性决定的。
2.1.6 杂质的区分
通过比较图像的差异,可以区分机器读数是真正的菌落还是由于杂质而误判。因为菌落在不同的时间点会变大而杂质则维持不变,这在放大的3D图会更加明显。最终结果判读的时候,可以结合目视的读数和机器的读数做判断。
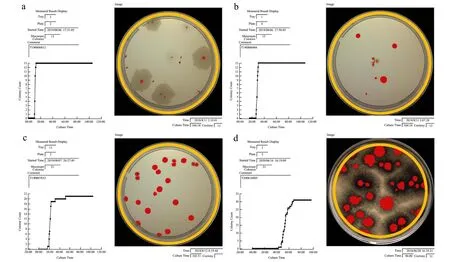
图6 仪器的检测时间与读数Fig.6 Detection time and results of MicroBio 3D

图7 大肠杆菌菌落放大图Fig.7 Enlarge image of E.coli colony detected by MicroBio 3D
如图7b所示,结果页面会出现培养皿的照片,菌落的位置会显示红色标记。当将鼠标指向培养皿内区域,能出现那个位置的放大三维显示图。如果是没有菌落生长的位置,三维图像平面不会有变化,显示图会出现像图7a图像,当鼠标移到有菌落生长的地方,会显示出菌落生长的三维图,如图7c所示。利用这个功能也可以区分开特定区域的杂质和菌落。
2.1.7 MicroBio 3D在固体粉末样品中的实际应用
表1是采用两种方法对某白色粉末样品进行微生物污染测试的结果。由表1可知,22个样品,MLA培养皿和SDA培养皿各44个,对比目视读数和仪器读数,共88个培养皿中83个培养皿的读数是一致的,比例为94%。其余5个培养皿仪器读数多于目视读数。

表1 仪器法与目视法在固体粉末样品中的实际应用Table 1 The practical application of both methods for microbial colony detection in solid powder samples
在22个样品目视观察中,样品1、7、11、18结果报告是有菌落生长的,这四个样品对应的仪器读数均对应有生长,其中,样品11的MLA平板目视读数为30 CFU/g而仪器读数为40 CFU/g,仪器读数稍高于目视读数。
对于18个目视读数均无任何生长的样品中,样品6,12和22则仪器分别报告有10~20 CFU/g的生长。因此,仪器检测更为敏感,读数稍微多于目视读数。
2.2 讨论
除了读数高度一致性以外,当遇到有严重污染或者超标的情况,仪器能实时发出邮件警报,不需要等到培养结束的时候才发现,从而对超标结果起到预警作用。为微生物实验室的自动化,实验室的数据完整性,提供了一个较好的选择[20]。
在实验过程中发现,仪器具备参数设定功能,对于特定的微生物,则需要有对应的最敏感参数。对于菌落很小的目标菌种,可以调节较为敏感的参数,这样即使在肉眼未能很好判断的阶段,仪器已经能判别出菌落的生长从而起到很好的预警作用。而对于菌落形态较大,例如是生长在营养琼脂表面的芽孢菌落往往会长成片状,或者是像巴西曲霉那样的会在琼脂表面长出孢子的,如果参数调节得敏感,则会有较多的误判,仪器会将凹凸不平的单菌落误判为多菌落,一个成熟霉菌菌落生长出来的许多孢子,肉眼观察是一个菌落而机器会将所有孢子都判断成为菌落而造成误判。故此在日常使用过程中,可以优先考虑常见菌或者是特定的致病菌,寻找对应合适的参数而使得仪器能在尽可能短的时间内检测出菌落。另外,当杂质和菌落在同一个垂直面上并且菌落非常小的时候,杂质有可能挡住菌落而无法读出[21]。
从2010年起有不少学者对通过影像系统对培养皿读数进行研究[16,20,22,23],市面上的仪器成品也各有千秋,其核心是影像系统的数据处理算法,不同的算法影响了仪器的判读能力、精度和产生误判机会的大小[24]。有些仪器能通过菌落的外观例如大小,颜色,质感,边缘表现等,通过大数据分析形成菌落形态的数据库,当检测样品菌落数量的同时对菌落形态进行分析判定,从而对培养皿上的菌落作菌种鉴定。而到菌种鉴定的步骤,需要有足够大的数据库,并且同一种菌,生长在琼脂的不同位置,其形态和颜色也有所不同,其精确度比起单纯的菌落数量计算更为复杂,期望在不久的将来这项技术能有所突破。
3 结论
本文讨论的仪器能实现实时监测的情况下,对活菌的生长进行计算,在不改变检测方法的前提下,包括培养基的种类,培养的温度和方式都保持不变,用机器的判读代替传统的人工目视读数。在人工接种包括在高浓度和低浓度的标准菌时,仪器的检测读数和人工目视读数有较高的一致性;在有杂质的情况下,仪器判定的菌落更为准确;而当使用实际样品进行微生物污染检测时,仪器读数能等同或者稍高于人工读数,显示了其优越性。

