基于CRISPR-Cas13的单增李斯特菌RNA快速检测方法的建立
曾红棱,张婷,邓锐杰,任尧,贾利蓉
(四川大学轻工科学与工程学院,四川成都 610065)
单增李斯特菌(L.monocytogenes)是一种重要的食源性致病菌,其广泛存在于土壤、植物、水,人及动物粪便中,主要污染食品基质为肉类、熟食、乳制品及海鲜类食品[1],感染可导致败血症,脑膜炎,肠胃炎和流产[2],其在冷藏温度和高盐浓度(10% NaCl)下仍能保持生存和增长[3],因此,单增李斯特菌污染对于食品安全及人类健康皆构成了巨大威胁。为了有效防止单增李斯特菌的危害,迫切需要发展一种高度特异性、快速、准确的食品中检测方法。
单增李斯特菌的检测方法依赖培养富集,然后是传统的生化培养法培养、免疫学法或以聚合酶链式反应(PCR)为基础的分子生物学方法[4]。传统培养法检测周期较长,约为4~6 d[5],无法满足大量样品的检测。免疫学法[6]主要包括ELISA,免疫胶体金技术和免疫磁分离技术,可以实现不依赖培养的单增李斯特菌检测,有望实现现场检测,然而,抗体比较昂贵,较难保存,限制了这些方法的广泛应用。针对核酸的检测技术[7]传统PCR,多重PCR(mPCR)和实时定量PCR(qPCR)可鉴定和高灵敏检测不同微生物。Liu Z等[8]开发了基于DNAzyme的PCR信号级联扩增技术,可实现肉眼检测食品中的李斯特菌。但PCR引物的设计极为关键,否则容易非特异性扩增产生假阳性或假阴性结果,且对于温度和仪器要求较高。等温核酸扩增的出现可消除核酸扩增技术对控温设备的依赖。Feng J等[9]将核酸适配体与LAMP检测技术结合,建立了对单增李斯特菌的AMC-LAMP可视化检测体系,检出限为5 CFU/mL。此外,一些基于荧光、比色、表面等离子共振、电化学的传感器检测技术[10-13]也得到了发展。GUO Y[14]结合免疫磁捕获和聚集诱导发光(AIE)检测单核细胞增生李斯特,无需任何预富集,且具有良好的选择性,加标回收率在95.37%至101.90 %。
但以DNA为检测模板的核酸分析方法无法区分死菌和活菌,假阳性率较高,且通常认为活菌对于食品安全及人类健康风险更大[15]。由于RNA分子通常具有较短的半衰期,在死菌中迅速降解,因为认为RNA检测更适用于准确检测活致病菌[16]。CRISPRCas(成簇的规则间隔的短回文重复序列)是一类特殊的核酸蛋白复合体,可依赖靶标单链RNA,切割无关的ssRNA,适用于RNA检测[17]。Zhou J等[18]建立了一种基于CRISPR-Cas13a检测金黄色葡萄球菌的方法,通过靶标RNA激活Cas13a-crRNA复合物的切割能力,切割荧光探针,导致荧光值增加,该方法具有较高的灵敏性,特异性,可在4 h内完成检测。但目前基于CRISPR-Cas13a的检测方法仍然需要通过逆转录过程获得cDNA,再进一步核酸扩增,此外一般需要在RNA报告探针的两端修饰荧光基因和淬灭基团,检测成本昂贵,操作流程也较为繁琐,无法满足同时具有高效率、高灵敏度、强特异性和低成本的需求。
因此设计了一种CRISPR-Cas 13直接切割RNA序列以检测活性致病菌的方法,以Broccoli适配体作为信号探针,后者可特异结合荧光染料产生荧光信号[19],无需化学合成和修饰。该方案无逆转录、无核酸扩增,可定量检测活的单增李斯特菌,检测耗时短,具有较高的选择性和灵敏度,有望实现食品中单增李斯特菌的实时现场检测。
1 材料与方法
1.1 材料和仪器
单增李斯特菌(L.monocytogenes)(ATCC 19115)、大肠杆菌(E.coli)(ATCC 25922)、鼠伤寒沙门氏菌(S.enterica)(ATCC 14028)和蜡样芽孢杆菌(B.cereus)(ATCC 14579)由中国工业培养收藏中心(CICC)提供;所有DNA寡核苷酸序列(表1)均购于上海生工生物技术有限公司(并通过PAGE进行纯化);Cas 13(cat.no.32117)购于Tolobio,中国上海;phi 29 DNA聚合酶和T7 RNA聚合酶购自Thermo Fisher Scientific(Waltham,USA);DNase I,dNTPs和rNTPs购自New England Biolabs(Ipswich,MAUSA);5-二氟-4-羟基苄基咪唑烷酮(DFHBI-1T)购自Lucerna(美国布鲁克林);细菌总RNA分离试剂盒购自上海生工生物技术有限公司;所有溶液采用分子生物级水(美国纽约康宁)配制。

表1 核苷酸序列表Table 1 Oligonucleotide sequences
美国伯腾Biotek Synergy H1多功能酶标仪;美国SCILOGEX(赛洛捷克)D3024R台式高速冷冻型微量离心机;上海一恒THZ-100恒温培养摇床。
1.2 实验方法
1.2.1 细菌培养及核酸提取
所有菌株分别在NB培养基中过夜培养得到菌液,梯度稀释后取适宜的3个连续梯度稀释液进行涂布平板计数。同时取1 mL不同浓度培养菌液4 ℃,12000 r/min离心10 min,弃上清,用无菌磷酸盐缓冲盐水(PBS,0.1 M,pH=7.4)洗涤沉淀,用细菌总RNA分离试剂盒提取纯化总RNA。所有RNA在进一步分析前保存在-80 ℃。
1.2.2 Broccoli适配体和crRNA的制备
50 μL反应体系中包含5 μL 10×phi 29聚合酶缓冲液,5 μL L-Broccoli(10 μM),5 μL启动子(promoter)(10 μM),90 ℃变性3 min,室温反应30 min;加入0.3 μL phi 29 DNA聚合酶(10 U/μL)和1 μL dNTPs(dATP,dGTP,dCTP和dTTP分别为10 mM),30 ℃孵育30 min,孵育使其延伸形成双链;再加入10 μL 5×转录缓冲液,1 μL T7 RNA聚合酶(20 U/μL),2 μL rNTPs(ATP,GTP,CTP和TTP分别为25 mM)和20.7 μL水,37 ℃孵育6 h,转录结束后,加入2 μL DNase I在37 ℃下4 h去除DNA模板,然后在75 ℃灭活15 min,得到Broccoli适配体。分子识别探针crRNA的制备方法同上。
1.2.3 靶标RNA的检测
取2.2中制备得到的Broccoli适配体4 μL(50 μM),crRNA 4 μL(1.5 μM),加入0.3 μL Cas 13(10 μM),4 μL 10×Cas 13 buffer,4 μL DFHBI-1T(100 μM)以及4 μL不同浓度的靶标RNA,加水至反应总体系为40 μL,37 ℃孵育30 min,检测荧光。其中激发波长为468 nm,发射波长范围498~650 nm,检测步长2 nm,记录不同活菌浓度下的荧光值。
1.2.4 特异性检测
每40 μL反应体系包括0.3 μL Cas 13a(10 μM)、10×Cas 13 buffer、4 μL Broccoli适配体(50 μM)、4 μL crRNA、4 μL DFHBI-1T(100 μM),分别加入2.2中提取的不同细菌RNA,混匀,37 ℃孵育30 min,检测荧光。
1.2.5 牛奶样品中单增李斯特活菌的检测
将单增李斯特菌接种至液体培养基过夜,将培养液用生理盐水进行梯度稀释,采用平板计数。然后取1 mL稀释菌液接种到9 mL牛奶中,将污染的牛奶4 ℃,12000 r/min离心20 min,弃上清[20],用无菌磷酸盐缓冲盐水(PBS,0.1 M,pH=7.4)洗涤沉淀,用细菌总RNA分离试剂盒提取纯化总RNA,检测样品中RNA方法如1.2.3所述。
1.2.6 数据处理
每个样品设3个平行,测定结果以平均值±标准差表示。采用Origin 9.0作图。
2 结果与讨论
2.1 检测原理
检测原理如图1所示,靶标RNA仅存在于活菌中,死菌中RNA会迅速降解,根据靶标RNA的序列设计crRNA,其中crRNA包括向导序列和锚定序列。依赖锚定序列,crRNA可识别并结合Cas13形成Cas13-crRNA复合物,令crRNA的向导序列与靶标RNA反向互补,当样品中存在靶标RNA时,其通过碱基互补配对与Cas13-crRNA复合物结合,Cas13的非特异性RNase活性被激活,可切割无关的单链RNA(ssRNA)[21]。我们引入Broccoli适配体作为信号探针监测CRISPR-Cas13的激活状态,一旦Broccoli适配体被剪切,其结构遭到破坏,将无法结合并打开DFHBI-1T染料的荧光,产生荧光淬灭。因此通过Broccoli/DFHBI-1T复合物的荧光强度可以指示靶标RNA的存在,进而实现对单增李斯特活菌的快速检测。

图1 检测原理图Fig.1 Schematic illustration of CRISPR-Cas13 for detection of L.monocytogenes
首先对Broccoli/DFHBI-1T的荧光指示作用进行验证,结果如图2所示。自由状态下DFHBI-1T染料荧光信号微弱(对照组1),加入crRNA后荧光值无明显变化(对照组2),但加入Broccoli适配体后(对照组3),荧光强度从214激增至16386,表明Broccoli适配体可特异性结合并打开DFHBI-1T染料,形成Broccoli/DFHBI-1T复合物,发射强烈的荧光信号,与文献报道一致[22]。并且Broccoli适配体可以通过体外转录和扩增,扩增速率与PCR相当,允许等温扩增[23]。当加入Cas13和crRNA,荧光信号无明显变化(对照组5)。其次对CRISPR-Cas13的信号识别能力进行验证,当加入一段与crRNA部分互补的单链RNA(cRNA),Cas13的非特异性RNase活性被激活,剪切Broccoli适配体产生荧光淬灭(对照组4)。当加入单增李斯特菌的RNA时,荧光强度减弱(从15706降至6496),说明靶标RNA可以激活Cas 13的剪切活性,进而剪切非靶标Broccoli适配体。

图2 原理验证图Fig.2 Validation of CRISPR-Cas13 assays for L.monocytogenes detection
2.2 实验条件优化
为了扩大该检测方法的信噪比,对实验条件进行进一步优化。首先根据单增李斯特菌16s rRNA片段,设计了不同的L-crRNA序列,并应用Primer-BLAST进行比对,筛选得到10条序列,再通过体外转录得到crRNA,结果如图3a所示,T8序列可特异性结合靶标RNA,激活Cas蛋白的剪切活性,信噪比为2.25,优化的L-crRNA的核苷酸序列如表1所示。此外,crRNA的缺乏或丰富导致信噪比降低[15],因此对crRNA与Cas 13的比例进行优化,保持Cas13浓度为100 nM,Cas13:crRNA比值范围为1:1~3:1。结果表明,当Cas 13a和crRNA浓度为2:1时时,信噪比最大为3.32(图3b)。

图3 CRISPR-Cas13体系实验优化Fig.3 Optimization of CRISPR-Cas13 based assay
2.3 线性范围与检出限
为验证CRISPR-Ca13对单增李斯特菌检测的灵敏度。以系列单增李斯特菌菌液浓度为横坐标(0,2.3×10、2.3×102、2.3×103、2.3×104、2.3×105、2.3×106、2.3×107CFU/mL),以该浓度下的荧光值为纵坐标绘制标准曲线。如图4,荧光强度随着单增李斯特菌浓度的增加而降低,线性检测范围为2.3×102~ 2.3×106,拟合线性方程为y=-2415.2x+21854,R²= 0.9953,LOD(最低检测限)=148 CFU/mL。由于检测对象为RNA,提取方法以及RNA易降解的特性[24],且未进行核酸扩增,导致该检测方法检测限略高。相比较利用RNA检测单增李斯特菌的其他方法,周振森等[25]以RAN检测为模板,利用Opti Gene Genie便携式仪器和反转录LAMP扩增,检出限为10 CFU/mL,但该法需要特定仪器,不适用于现场检测。徐匆等[26]在此基础上进行改进,以HNB作为指示剂,对单增李斯特菌的RNA进行反转录及环介导等温扩增,建立一种单增李斯特菌的RT-LAMP-HNB检测方法,可直接依据颜色变化判读结果。Ma CC等[27]建立一种基于RNA检测的RTLAMP方法,可用于检测鲜切水果和蔬菜中的活单增李斯特活菌,检测限低至1 CFU/mL。但由于实验过程中的污染及人员操作,LAMP方法的超灵敏性有时仍会导致假阳性结果。此外,LAMP还需要4至6个引物,相比其他等温扩增方法,引物设计更为复杂[28],且对于反应温度有严格要求。因此,基于CRISPRCas13检测单增李斯特菌的方法,无需逆转录和核酸扩增,可实现对单增李斯特菌的快速、定量检测。

图4 单增李斯特菌的定量检测Fig.4 The relationship between [L.monocytogenes] and fluorescence response of CRISPR-Cas13 based array
2.4 特异性
为了验证该检测方法的特异性,本实验选取了食品中危害较大的三种食源性致病菌进行特异性实验。实验结果如图5所示,单增李斯特菌的crRNA序列对单增李斯特菌具有很强的识别能力,加入靶标RNA可特异性结合crRNA,激活Cas13的酶切活性造成荧光猝灭,荧光值降低。相反,加入沙门氏菌、大肠杆菌和蜡样芽孢杆菌时,荧光值几乎无差异,未达到荧光淬灭的效果。表明该检测方法对单增李斯特菌具有较好的特异性。
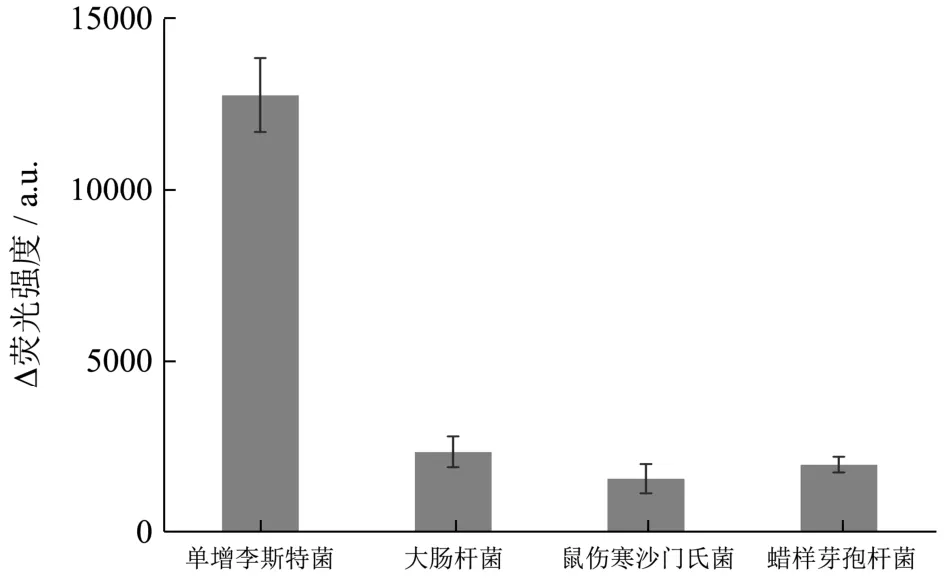
图5 特异性分析Fig.5 Specificity test of L.monocytogenes detection
2.5 实际样品检测
为了验证该检测方法在食品检测中的可行性,本实验选取牛奶样品进行验证,结果如表2,样品加标回收率为95.15%~97.99%,表明该方法能实现复杂组分的食品基质中单增李斯特菌的准确、快速检测。

表2 牛奶样品中单增李斯特菌的检测Table 2 Determination of L.monocytogenes spiked in the milk (n=3)
3 结论
本实验结合CRISPR-Cas13作为信号识别元件,Broccoli适配体为信号探针,可对单增李斯特菌特异性识别,无需任何富集或平板培养过程,可在30 s完成对于单增李斯特活菌的识别与检测,检出限为148 CFU/mL。该方法无逆转录、无核酸扩增和核酸标记,识别和扩增皆可在恒温条件进行,降低了对于人员和精准控温设备的要求,适用于单增李斯特菌的现场检测,且直接检测致病菌RNA可有效避免死菌对实验结果的干扰。由于CRISPR-Cas13系统的可编程性,该检测可针对不同细菌设计crRNA的向导序列,具有较强的特异性和灵敏度,实现对不同的细菌的快速检测,为建立食品中快速和现场检测致病菌提供一种通用检测方案。

