海洋鱼蛋白低聚肽结构和抗氧化活性的体外消化稳定性
冯晓文,赵晓涵,潘骁琦,王卓然,谷瑞增,刘文颖
(1.中国食品发酵工业研究院有限公司,北京市蛋白功能肽工程技术研究中心,北京 100015)(2.北京城市学院生物医药学部,北京 100094)(3.北京农学院食品科学与工程学院,北京 102206)
三文鱼因其英文Salmon音似三文而得名,也叫鲑鱼、大马哈鱼或大麻哈鱼,主要产于北冰洋、大西洋与太平洋的交界水域,如加拿大、挪威、日本和美国等国家。三文鱼肉质鲜美,口感好,富含n-3系列不饱和脂肪酸、人脑神经和视觉神经中主要的脂质成分二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)等生物活性物质,还富含VA、VB1、VB2、VB12和VD,不仅能降低血液中的胆固醇含量,有效防治心、脑血管疾病及减轻因风湿、牛皮癣等疾病带来的痛苦,还可预防慢性疾病、糖尿病和某些类似的疾病,且多吃三文鱼有助于保持肠道健康,降低结肠炎等肠道疾病风险,被誉为 “ 鱼中至尊 ” , “ 水中珍品 ” , “ 冰海之皇 ”[1,2]。
随着人民生活水平的显著提高,对海产品的消费需求日趋增长。三文鱼肉色为红色或鲜橘红色,以其独特的口味、丰富的营养,在消费者食物中所占比例不断增长。目前,国内对三文鱼肉的研究报道主要是对其营养价值的阐述,对于三文鱼酶解物海洋鱼蛋白低聚肽的研究鲜有报道。本中心使用酶解法酶解三文鱼肉制得海洋鱼蛋白低聚肽,通过体外模拟人体胃肠消化系统,以分子量分布测定法、紫外全波长扫描法及圆二色光谱扫描法表征海洋鱼蛋白低聚肽消化前后结构方面的变化,以DPPH自由基清除能力、ABTS自由基清除能力、铁离子还原能力(FRAP)、氧自由基吸收能力(ORAC)4个抗氧化指标揭示海洋鱼蛋白低聚肽消化前后抗氧化活性的变化。
通过探索海洋鱼蛋白低聚肽结构和抗氧化活性的消化稳定性,以期为三文鱼肉在抗氧化领域高附加值产品的多元化开发提供理论基础。
1 材料与方法
1.1 材料与仪器
三文鱼肉,北京中食海氏生物技术有限公司提供;碱性蛋白酶(20000 U/g)、中性蛋白酶(200000 U/g),诺维信公司;无水乙醇、氢氧化钠、浓盐酸、磷酸二氢钾、磷酸氢二钠、过硫酸钾、醋酸钠,北京化学试剂公司;胃蛋白酶,美国Sigma公司;胰蛋白酶,美国Solarbio公司;2,2-二苯基-1-苦味肼基自由基(DPPH)、偶氮二异丁脒盐酸盐(AAPH)、Fluorescein(荧光指示剂)、Trolox(水溶性维生素E),色谱纯,美国Sigma公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),分析纯,南京森贝伽生物科技有限公司;2,4,6-三吡啶基-1,3,5-三嗪(TPTZ),酷尔化学科技(北京)有限公司;三氯化铁、硫酸亚铁,广东汕头市西陇化工有限公司。
YG30型喷雾干燥机,无锡市阳光干燥设备厂;HH-4数显恒温水浴锅,普瑞斯机械有限公司;FE20K型pH计,瑞士梅特勒-托利多公司;KQ-250E超声波振荡器,昆山市超声仪器有限公司;J-810圆二色谱仪,美国Jasco公司;Spectra MR多功能酶标仪,美国Dynex公司;SpectraMax i3x多功能酶标仪,美国MD公司;LC-20AD型高效液相色谱仪,日本岛津公司;UV-1780紫外可见分光光度计,日本SHIMADZU公司。
1.2 实验方法
1.2.1 海洋鱼蛋白低聚肽的制备
解冻三文鱼肉,称取50 g于1 L的超纯水中,90 ℃水浴加热10 min,降温至55 ℃后,用2 mol/L NaOH或HCl调节pH值为8.50,按每克蛋白质3000单位的酶量的用量加入碱性蛋白酶,酶解3 h;调节溶液pH值为7,温度为45 ℃,按每克蛋白质2000单位的酶量加入中性蛋白酶,酶解2 h。酶解完毕,沸水浴灭酶15 min。10000 r/min离心30 min,上清液待用。用截留分子量为1000 u的超滤膜过滤上清液,滤过液经喷雾干燥机处理到海洋鱼蛋白低聚肽干粉[3]。喷雾干燥机条件为:进料温度25 ℃,进料速度14 mL/min,进风温度135 ℃,进风压力20 kPa。
1.2.2 体外模拟胃肠道消化实验
1.2.2.1 胃蛋白酶消化实验
取15 mL 50 g/L的海洋鱼蛋白低聚肽溶液,调节溶液pH值为2,温度为37 ℃,然后加入3%(E/S)胃蛋白酶(≥250 units/mg),混匀,消化时间为3 h,100 ℃左右灭酶10 min,得胃蛋白酶消化组样品溶液。另移取15 mL未消化样品溶液为对照组样品[4]。
1.2.2.2 胰蛋白酶消化实验
取15 mL 50 g/L的海洋鱼蛋白低聚肽溶液,调节pH值为6.8,温度为37 ℃,加热1 min后,加入3%(E/S)胰蛋白酶(≥250 units/mg),混匀,消化时间为3 h,100 ℃左右灭酶10 min,得胰蛋白酶消化组样品溶液[4]。
1.2.2.3 先胃蛋白酶消化后胰蛋白酶消化实验
取15 mL 50 g/L的海洋鱼蛋白低聚肽溶液,按1.2.2.1消化后,再按1.2.2.2消化,然后100 ℃左右灭酶10 min。得先胃蛋白酶消化后胰蛋白酶消化组样品溶液[4]。
1.2.3 分子质量分布测定
测定条件为:色谱柱:TSKgel G2000 SWXL(300×7.80 mm)凝胶柱;流动相:乙腈、水、三氟乙酸体积比为45:55:0.10;流速:0.50 mL/min;进样体积:10 μL;柱温:30 ℃,紫外检测波长:220 nm。经流动相配制1 mg/mL的待测液,经孔径0.20 μm聚四氟乙烯过滤膜过滤,然后进行凝胶过滤,GPC软件处理数据。将肽标准品乙氨酸-乙氨酸-乙氨酸(分子质量189 u)、乙氨酸-乙氨酸-酪氨酸-精氨酸(分子质量451 u)、杆菌酶(分子质量1450 u)和细胞色素C(分子质量12500 u)分别配制成质量分数0.10%的溶液,过膜后进样,制作相对分子质量校正曲线[5]。
1.2.4 紫外全波长扫描
将不同处理组的海洋鱼蛋白低聚肽溶液稀释到浓度为2 mg/mL,利用紫外可见分光光度计以石英比色皿为容器进行紫外全波长扫描,扫描条件为:扫描波长245~325 nm;狭缝1 mm;采样间隔0.50 nm;慢速扫描。
1.2.5 圆二色光谱扫描
将不同处理组的海洋鱼蛋白低聚肽溶液稀释到浓度为1 mg/mL,使用圆二色光谱仪以石英比色皿为容器测定其二级结构组成,圆二色光谱条件为:光源采用氙灯;氮气输出压力为0.40 MPa;带宽1 nm;光谱测量范围180~260 nm;步进0.5 nm;数据点采样时间为0.25 s。每个样品采集三次,用CDNN 2.1-Simple Spectra软件分析四组样品的圆二色光谱图。
1.2.6 DPPH自由基清除能力测定
制备1、2、5、10、15 mg/mL的海洋鱼蛋白低聚肽溶液,样品组(Ax):依次加入100 μL 0.10 mmol/L DPPH-无水乙醇溶液和100 μL不同质量浓度的样品溶液;无水乙醇组(A0):依次加入100 μL无水乙醇和100 μL不同浓度的样品溶液;对照组(A1):依次加入100 μL 0.10 mmol/L DPPH-无水乙醇溶液和100 μL蒸馏水。混匀,避光反应0.5 h,517 nm处测得吸光值[6,7]。根据式(1)计算清除率:

1.2.7 ABTS自由基清除能力测定
将7 mmol/L的ABTS储备液:2.45 mmol/L的过硫酸钾溶液=1:1(V/V)混匀,25 ℃避光反应12~16 h,得ABTS工作母液。用0.10 mol/L PBS稀释ABTS母液35倍得ABTS工作液,使其在734 nm处的吸光值为0.70±0.02。标准曲线检测孔中各加入200 μL的ABTS工作液和10 μL不同质量浓度的Trolox标准溶液;样品检测孔各加入200 μL的ABTS工作液和1 mg/mL的样品10 μL,轻轻晃动96孔板片刻,25 ℃静置5 min,于734 nm处测定OD值。以不同浓度的Trolox溶液为横坐标,相应的OD值为纵坐标,绘制标准曲线,如图1所示。根据标准曲线计算样品的ABTS自由基清除能力,以mmol Trolox/L表示[8,9]。

图1 ABTS标准曲线Fig.1 ABTS standard curve
1.2.8 FRAP值测定

图2 FRAP标准曲线Fi.2 FRAP standard curve
300 mmol/L醋酸钠缓冲液(pH 3.60):10 mmol/L TPTZ溶液:20 mmol/L FeCl3溶液=10:1:1(V/V/V),混匀,得FRAP工作液。调节FRAP工作液温度为37 ℃。空白对照孔依次加入180 μL的FRAP工作液和5 μL的PBS;标准检测孔中各加入180 μL的FRAP工作液和5 μL的不同浓度的FeSO4标准溶液;样品检测孔内各加入180 μL的FRAP工作液和5 μL 1 mg/mL样品溶液。摇床晃动96孔板片刻,37 ℃静置5 min,于593 nm处测定OD值,以不同浓度的FeSO4标准溶液及对应的OD值得到标准曲线,如图2所示。根据标准曲线计算样品的FRAP值[10]。
1.2.9 ORAC值测定
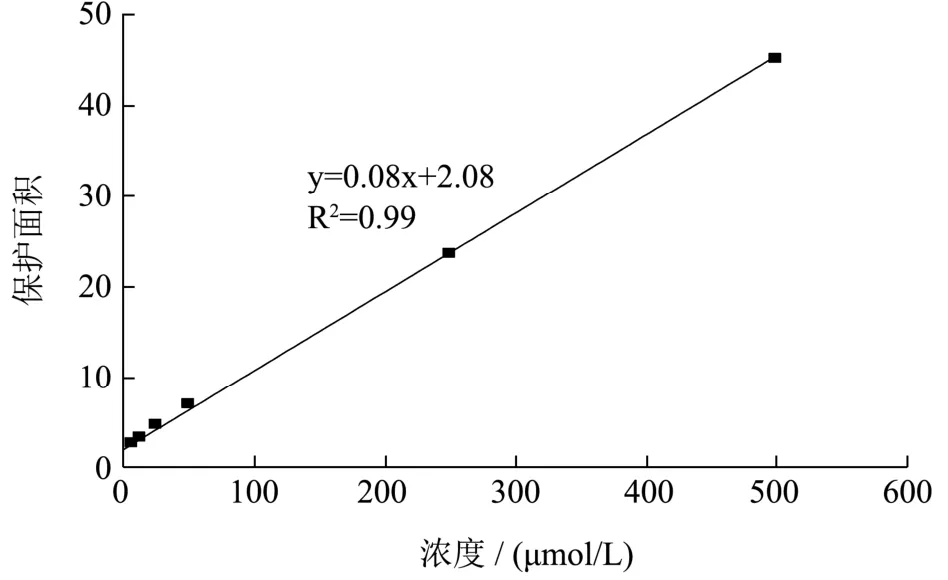
图3 Trolox标准曲线Fig.3 Trolox standard curve
配置pH=7.40,75 mmol/L PBS、不同浓度的Trolox标准溶液、0.80 μmol/L的Fluorescein(荧光指示剂)及150 mmol/L偶氮类化合物AAPH。取96孔板,依次加入25 μL 1 mg/mL样品溶液和100 μL的Fluorescein,此为实验组;25 μL不同浓度的Trolox标准溶液和100 μL的Fluorescein,此为标准曲线组;25 μL PBS和100 μL的Fluorescein,此为空白组。覆盖一层锡箔纸避光,于37 ℃烘箱反应20 min,最后于上述各孔中迅速加入75 μL 150 mmol/L偶氮类化合物AAPH启动反应,另外在空白组的基础上做不加AAPH的对照。设定荧光酶标仪条件为:激发波长485 nm,发射波长530 nm,温度37 ℃,每隔5 min测定一次,每次读数前晃匀3~5 s,测定总时间为180 min。以不同浓度的Trolox标准溶液为横坐标,荧光衰减曲线保护面积为纵坐标绘制标准曲线,如图3。根据标准曲线计算待测样品的ORAC值,结果表示为μmol Trolox/g[11]。
1.2.10 数据处理
每组数据均重复3次,实验结果以平均值±标准偏差表示,使用Origin 2021软件作图。
2 结果与讨论
2.1 消化前后海洋鱼蛋白低聚肽的分子质量分布
如表1所示,模拟胃液组与未消化组分子量分布几乎一致(p>0.05),表明海洋鱼蛋白低聚肽具有很强的抗胃蛋白酶消化稳定性;而模拟胰液组和先胃液消化后胰液消化组与未消化组相比,分子量大于1000 u的组分均减少,表明海洋鱼蛋白低聚肽中大分子肽尤其是3000~5000 u的组分对胰蛋白酶的消化稳定性不强;相应的,经胰蛋白酶消化以后分子量在150~1000 u的组分有所增加,且分子量150~1000 u组分占总组分的84%以上。张韦唯[12]研究了体外模拟胃肠液消化对发酵菜粕抗氧化肽的影响,在经模拟胃肠液消化处理后发酵菜粕抗氧化肽小于1000 u的组分所占的比例从72.51%分别上升到75.48%和79.84%,其分子质量分布规律与本实验一致。
2.2 消化前后海洋鱼蛋白低聚肽的紫外全波长扫描
四组海洋鱼蛋白低聚肽溶液的紫外扫描图如图4所示,由图可知,四组样品均在270~280 nm处有一弱吸收峰,且经模拟胃肠液处理后,与未消化组相比,其余三组最大吸收峰发生了一定程度的左移,其中未消化组吸收峰值为0.26,模拟胃液组吸收峰值为0.41;模拟胰液组、先胃后胰组与模拟胃液组相比,紫外吸收值无显著差异(p>0.05),其原因可能是模拟胃肠液消化海洋鱼蛋白低聚肽后,使得溶液中发色团和助色团如C=O、COOH、NH2的组成比例发生了变化,从而偏光性发生了变化[13]。

表1 不同处理的海洋鱼蛋白低聚肽的分子质量分布Table 1 Molecular weight distributions of MFPO with different treatments
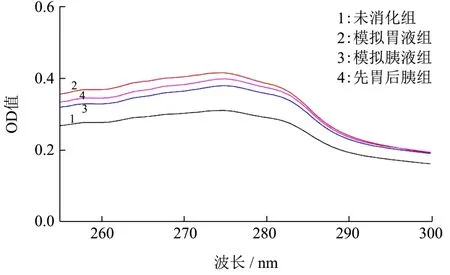
图4 不同处理的海洋鱼蛋白低聚肽的紫外全波长扫描Fig.4 UV full wavelength scanning of MFPO with different treatments
2.3 消化前后海洋鱼蛋白低聚肽的圆二色光谱扫描
圆二色光谱图表征蛋白质二级结构的组成,不同处理组的圆二色光谱图结果如图5所示,使用CDNN 2.1-Simple Spectra软件分析样品圆二色光谱图得出了不同处理组溶液中二级结构组成,如表2所示。分析可知,胃蛋白酶消化前后,海洋鱼蛋白低聚肽二级结构组成未发生显著变化(p>0.05),表明了海洋鱼蛋白低聚肽的二级结构具有抗胃蛋白酶消化稳定性;而经模拟胰液消化后,海洋鱼蛋白低聚肽中平行式β-折叠和不规则卷曲所占比例有一定程度的减少,同时α-螺旋和反平行式β-折叠所占比例有所增加,最大增加量为10.93%。总体表明了海洋鱼蛋白低聚肽在结构方面对胃蛋白酶和胰蛋白酶具有较好的抗消化稳定性。CD信噪比是根据蛋白质或多肽的旋光性随温度或变性的变化而变化,主要是测定蛋白质折叠的热力学和蛋白质的稳定性。海洋鱼蛋白低聚肽经模拟胃肠液处理后,部分肽链二级结构及稳定性发生改变,从而使得信噪比有差异[14]。
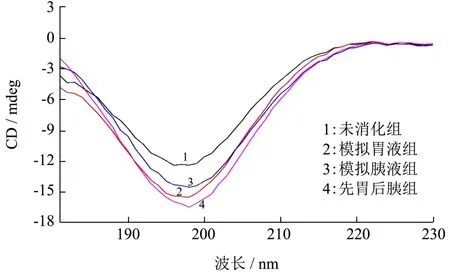
图5 不同处理的海洋鱼蛋白低聚肽的圆二色光谱图Fig.5 Circular dichroism spectrogram of MFPO with different treatments
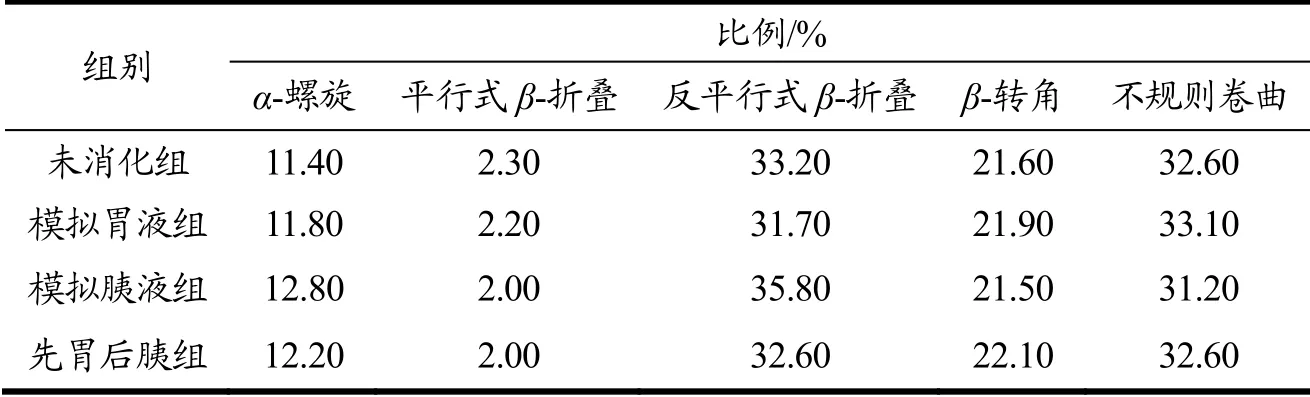
表2 不同处理的海洋鱼蛋白低聚肽的二级结构Table 2 Secondary structures of MFPO with different treatments
2.4 消化前后海洋鱼蛋白低聚肽的DPPH自由基清除能力
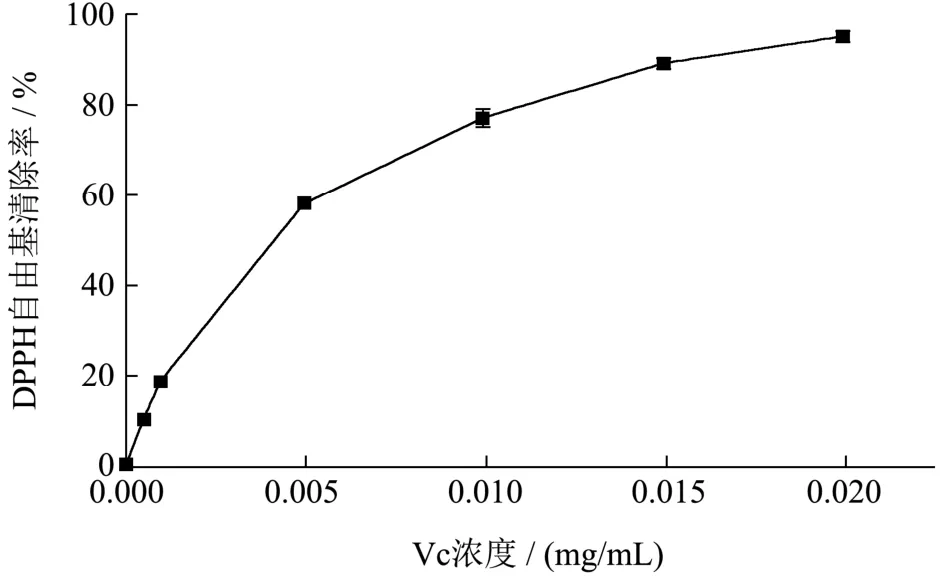
图6 Vc的DPPH自由基清除活性Fig.6 DPPH free radical scavenging activity of Vc
在抗氧化检测方法中,DPPH自由基清除率是比较灵敏的方法之一,通过测定样品清除自由基后吸光度的变化来评测样品的抗氧化能力。如图7所示,在1~15 mg/mL浓度范围内,不同处理组海洋鱼蛋白低聚肽的DPPH自由基清除率呈浓度依赖性增加。其中模拟胃液组DPPH自由基清除率15 mg/mL时最高,为67.86%,半抑制浓度(IC50值)约为4.50 mg/mL,模拟胰液组DPPH自由基清除率整体都比模拟胃液组低。阳性对照抗坏血酸(Vc)的DPPH自由基清除率趋势与海洋鱼蛋白低聚肽类似,呈剂量依赖性增长,半抑制浓度(IC50值)约为0.005 mg/mL,其DPPH自由基清除能力显著高于海洋鱼蛋白低聚肽。本中心前期以三文鱼皮为原料制得三文鱼皮胶原低聚肽,经模拟胃肠液消化以后其DPPH自由基清除率在1~20 mg/mL浓度范围内呈剂量依赖性,均从10%左右上升到了60%左右,其变化趋势与海洋鱼蛋白低聚肽一致[15]。

图7 不同处理的海洋鱼蛋白低聚肽的DPPH自由基清除活性Fig.7 DPPH free radical scavenging activities of MFPO with different treatments
2.5 消化前后海洋鱼蛋白低聚肽的ABTS自由基清除能力

图8 Vc的ABTS自由基清除能力Fig.8 ABTS radical scavenging capacity of Vc

图9 不同处理的海洋鱼蛋白低聚肽的ABTS自由基清除能力Fig.9 ABTS radical scavenging capacity of MFPO treated with different treatments
通过酶标仪测定不同浓度的Trolox标准溶液相应的吸光值,得到ABTS标准曲线方程为:y=0.58x+1.15(R2=0.99)。基于标准曲线方程得出四组海洋鱼蛋白低聚肽ABTS自由基清除能力,结果如图9所示,与未消化组相比,其余三组ABTS自由基清除能力均有一定程度的增加,与阳性对照组0.3 mg/mL的Vc清除率相当,但均无显著影响(p>0.05),这表明海洋鱼蛋白低聚肽的ABTS自由基清除能力具有较好的抗消化稳定性。海洋鱼蛋白低聚肽的ABTS自由基清除率在模拟胃肠道消化后稍有提高的原因可能是:模拟胃肠液消化海洋鱼蛋白低聚肽后,产生了较多的亲水性的抗氧化活性肽段和具有抗氧化活性的氨基酸残基,清除了大量的ABTS自由基,使得蛋白酶消化后的海洋鱼蛋白低聚肽ABTS自由基清除能力有所提高。吴丽英[16]以玛咖蛋白为研究对象,通过模拟体外消化,以ABTS为指标评价体外消化对玛咖蛋白抗氧化活性的影响,结果表明经过模拟消化处理的样品的ABTS清除率和未经过处理的样品相比,分别增至原来的2.40倍和3.12倍,与本实验变化趋势基本一致。
2.6 消化前后海洋鱼蛋白低聚肽的铁离子还原能力

图10 不同浓度Vc的FRAP值Fig.10 FRAP values of different concentrations of Vc

表3 不同处理的海洋鱼蛋白低聚肽的FRAP值Table 3 FRAP values of MFPO treated with different treatments
通过测定不同浓度的FeSO4·7H2O相应的OD值,得出铁离子还原能力标准曲线表达式为:y=0.24x+0.04(R2=0.99)。由此得出了不同处理组海洋鱼蛋白低聚肽的铁离子还原能力,结果如表3所示。由表3可知,海洋鱼蛋白低聚肽的FRAP值远低于阳性对照组,且经模拟胃肠液消化前后海洋鱼蛋白低聚肽溶液的铁离子还原能力只有轻微增加,无显著影响(p>0.05),表明了海洋鱼蛋白低聚肽的铁离子还原能力具有抗消化稳定性。Sae等[17]以超声辅助法制备鲑鱼鳞胶原蛋白,经消化处理后,其铁离子还原能力由0.05 μmol Trolox/mL升高到0.09 μmol Trolox/mL,其变化规律与本实验保持一致。
2.7 消化前后海洋鱼蛋白低聚肽的氧自由基吸收能力
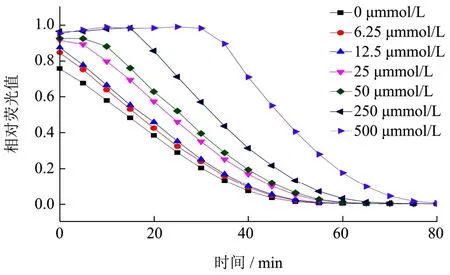
图11 不同浓度Trolox的动态荧光衰减曲线Fig.11 Dynamic fluorescence attenuation curves of Trolox at different concentrations
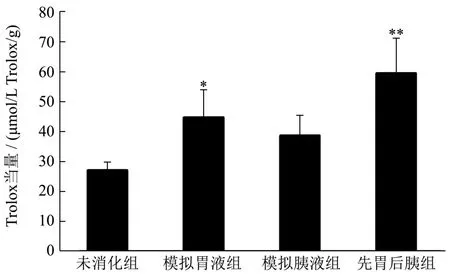
图12 不同处理的海洋鱼蛋白低聚肽的ORAC值Fig.12 ORAC values of MFBCO treated with different treatments
不同浓度Trolox标准液的动态荧光衰减曲线如图11所示。由此得到Trolox标准曲线方程为:y=0.08x+2.08,(R²=0.99)。由此可得四组海洋鱼蛋白低聚肽溶液的ORAC值如图12。从图12可得出,先胃后胰处理组极大地提高海洋鱼蛋白低聚肽的ORAC值(p<0.01)。且海洋鱼蛋白低聚肽分别经模拟胃、肠液消化处理后,其ORAC值较未消化组相比,均有提高,最大值为59.594 μmol/L Trolox/g,阳性对照Vc的ORAC值为897.42 μmol Trolox/g。Pimentel[18]等证明蛋白质水解后肽末端氨基酸的序列和暴露程度影响抗氧化活性,海洋鱼蛋白低聚肽经模拟胃、肠液消化处理后,分子质量<1000 u的短肽所占比例均有不同程度的增加,最大可达11.69%,使得肽末端氨基酸的序列和暴露程度发生改变,这可能与其ORAC值增高有一定的关系。吴明泽[19]等以中华圆田螺肉酶解产物为研究对象,其ORAC值消化前800 μmol/L,在经酶解后,酶解产物的ORAC最大可达1600 μmol/L,变化规律与本研究相似。
3 结论
本实验对海洋鱼蛋白低聚肽进行体外模拟胃肠消化,分析其在消化期间抗氧化活性及结构变化,主要结果如下:分子量分布结果表明海洋鱼蛋白低聚肽较胃蛋白酶相比对胰蛋白酶的耐受性较差,分子量3000~5000 u的组分被胰蛋白酶大量水解,水解量最大高于80%;紫外全波长结果表明海洋鱼蛋白低聚肽在消化前后其最大吸收峰发生了一定程度地变化,可能原因是经模拟胃肠液消化以后溶液中发色团和助色团组成发生了改变;圆二色光谱对不同处理组的海洋鱼蛋白低聚肽二级结构组成进行了分析,发现胰蛋白酶消化前后,海洋鱼蛋白低聚肽的二级结构组成较胃蛋白酶组相比变化明显,α-螺旋和反平行式β-折叠最大变化量为10.93%。上述结果表明海洋鱼蛋白低聚肽在结构上具有极强的抗胃蛋白酶消化稳定性及相对较强的抗胰蛋白酶消化稳定性。ABTS自由基清除率、FRAP值及ORAC值三个抗氧化指标结果表明消化后海洋鱼蛋白低聚肽的抗氧化活性均提高,其中经模拟胰液消化后的ORAC值提高最为显著(p<0.01);DPPH自由基清除率经模拟胰液消化后虽未提高,但清除率稳定在20%~30%,仍具有一定的DPPH自由基清除能力。四个抗氧化指标表征了海洋鱼蛋白低聚肽抗氧化活性具有抗消化稳定性。海洋鱼蛋白低聚肽作为一种新兴蛋白资源,在结构和抗氧化方面具有较好的抗消化稳定性,这为三文鱼肉的高附加值利用及相关产品的多元化开发提供了一定的理论基础。

