高迁移率族蛋白B1与急性心肌梗死的相关性分析
谷凌云,钱惠东,李伟章,郑若龙,蒋文龙
(东南大学医学院附属江阴医院 心血管内科,江苏 江阴214400)
高迁移率族蛋白B1(HMGB1)是与炎症疾病相关的细胞因子,能够调节和影响多种炎症性疾病的发生、发展[1]。有研究发现炎症反应是缺血性心脏病的重要发病机制之一[2-3]。促炎和抗炎的细胞因子失衡使机体处于低浓度的炎症状态,从而诱发和促进冠状动脉粥样硬化性心脏病(以下简称冠心病)的发生、发展[4]。有研究发现,血清HMGB1水平与冠心病患者临床常规检测的炎症、血脂、血糖等指标有一定的相关性[5-6]。并且HMGB1与冠状动脉狭窄程度呈正相关,与急性冠脉综合征患者的病情危险程度有很好的相关性,能很好的预测行择期经皮冠状动脉介入术(percutaneous coronary intervention,PCI)的临床预后[7-8]。急性心肌梗死(acute myocardial infarction,AMI)时炎症相关细胞因子的分泌更为紊乱,在缺血再灌注损伤、心肌重构和心力衰竭时发挥更加复杂的作用[9]。有研究发现HMGB1在AMI时发挥重要作用,但其具体作用并不一致[10-12]。本研究旨在通过观察急性ST段抬高型心肌梗死急诊行经皮冠状动脉介入术后血清HMGB1水平,探讨血清HMGB1水平与AMI的相关性及其临床价值。
1 资料与方法
1.1 一般资料
选取2016年1月—2018年11月于东南大学医学院附属江阴医院就诊并成功行急诊PCI术的急性ST段抬高型AMI患者348例作为AMI组。其中,罪犯血管为前降支、回旋支及右冠的患者分别为185、53和110例。选取同期于本院性别、年龄相匹配的健康体检群众312例作为对照组。急性ST段抬高型心肌梗死诊断标准符合2017年欧洲心脏病学会发表的《ST段抬高型急性心梗管理指南》[13]。排除标准:①既往有心肌梗死病史;②急慢性感染或自身免疫性疾病;③恶性肿瘤;④严重肝、肾功能疾病;⑤心力衰竭(左室射血分数<40%);⑥血液系统疾病;⑦PCI禁忌证。本研究经医院医学伦理委员会批准,受试者签署知情同意书。
1.2 方法
1.2.1 术前检查收集受试者的基本信息,禁食10 h后采集肘静脉血,通过本院中心化验室检测血清总胆固醇、甘油三酯、低密度脂蛋白(low density lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)、肌钙蛋白Ⅰ及脑钠肽(brain natriuretic peptide,BNP)水平。
1.2.2 HMGB1检测AMI术后第2天禁食10 h后采集的肘静脉血3~5 ml,室温静置2 h,3 000 r/min离心15 min,抽取血清放入Eppendor管中,置于-80℃冰箱冷冻保存待检。采用酶联免疫吸附试验(ELISA)检测血清HMGB1水平。
1.2.3 二维超声心动图检查AMI术后1周采用二维超声心动图检测左室收缩功能,通过胸骨旁左室长轴切面和/或胸骨旁短轴切面评估左室收缩功能指标,包括左室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左室射血分数(left ventricular ejection fraction,LVEF)。
1.2.4 球囊开通时间记录患者胸痛开始时间至Sprinter LEGENDTMRX球囊(美国Medtronic公司)预扩张时间,精确至分钟。
1.3 统计学方法
数据分析采用SPSS 22.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以率(%)表示,比较用χ2检验,相关性分析用Pearson法,并绘制ROC曲线。P<0.05为差异有统计学意义。
2 结果
2.1 两组临床资料比较
两组年龄、性别、总胆固醇及甘油三酯水平比较,差异无统计学意义(P>0.05)。两组LDL、HDL、BNP、LVEDD、LVEF及HMGB1水平比较,差异有统计学意义(P<0.05),AMI组HDL、LVEF较对照组低,LDL、BNP、LVEDD及HMGB1较对照组高。见表1。
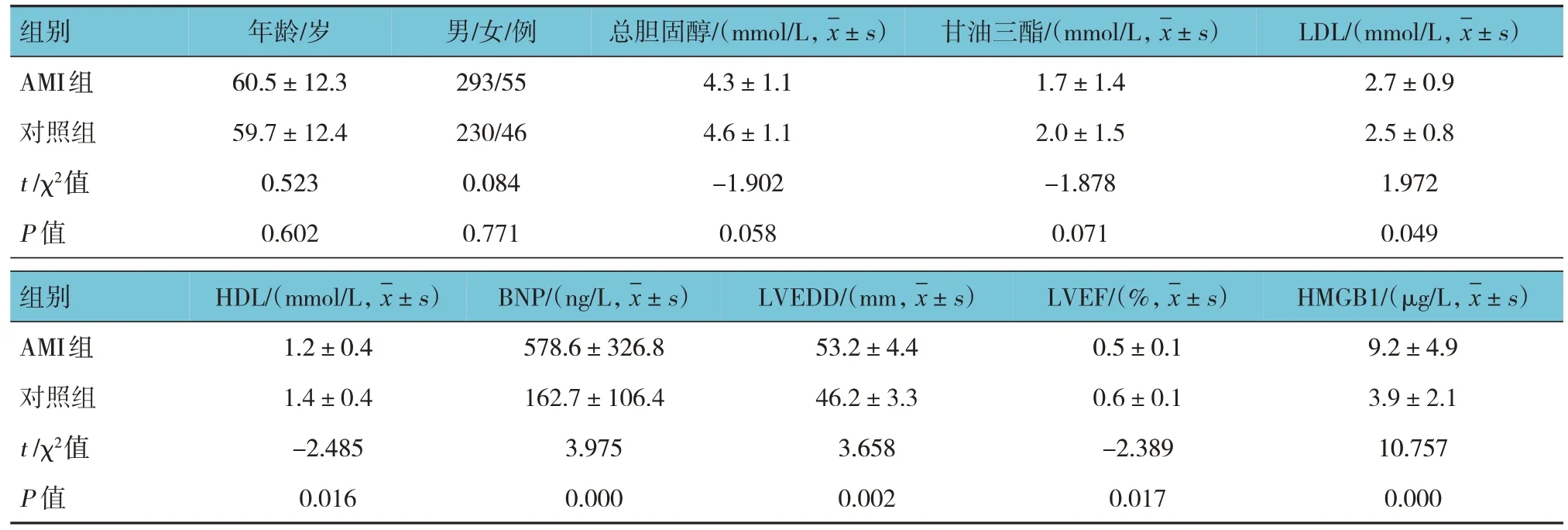
表1 两组临床资料比较
2.2 血清HMGB1水平与球囊开通时间、心功能的相关性
AMI组的球囊开通时间为(298.7±142.6)min,Pearson线性相关分析显示,血清HMGB1水平与球囊开通时间呈正相关(r=0.896,P=0.001)。血清HMGB1水平与LDL呈正相关(r=0.667,P=0.000),与HDL呈负相关(r=-0.774,P=0.000)。血清HMGB1水平与BNP水平、LVEDD呈正相关(r=0.647和0.623,P=0.006和0.002),与LVEF呈负相关(r=-0.739,P=0.009)。AMI组的肌钙蛋白Ⅰ为(46.7±31.1)μg/L,血清HMGB1水平与肌钙蛋白Ⅰ呈正相关(r=0.781,P=0.000)。
2.3 血清HMGB1水平对AMI后再发心房颤动的预测价值
AMI组患者中有52例在住院期间出现阵发性心房颤动,发病率为14.94%。AMI组血清HMGB1水平为(11.4±5.6)μg/L,对照组为(7.1±3.3)μg/L,经t检验,差异有统计学意义(t=6.445,P=0.000),AMI组较对照组高。根据ROC曲线显示,HMGB1诊断曲线下面积为0.76(95% CI:0.69,0.82),HMGB1用来预测AMI后再发心房颤动截断值为7.28 μg/L,敏感性为72%,(95% CI:0.67,0.77),特异性为62%(95%CI:0.57,0.67)。见图1。
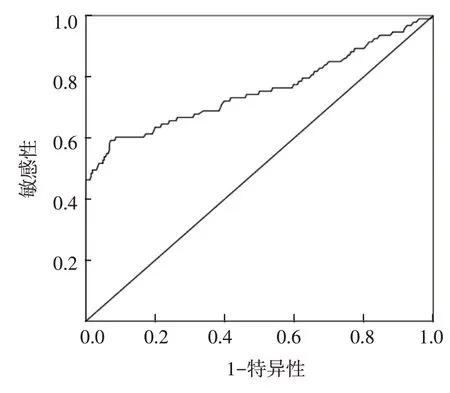
图1 血清HMGB1水平预测AMI后再发心房颤动的ROC曲线
3 讨论
本研究发现,AMI组血清HMGB1水平较对照组明显升高,独立于血清LDL、HDL水平,与球囊开通时间及心功能明显相关,并对AMI术后预测心房颤动的发生具有诊断价值。
在细胞核内HMGB1和DNA结合形成稳定的染色质小体结构,调节DNA复制、修复和转录过程,细胞坏死后HMGB1释放至细胞外,从而调节炎症反应[14-16]。有研究发现,在动脉粥样硬化斑块里,平滑肌细胞、泡沫细胞能够刺激内皮细胞和血小板分泌HMGB1,而HMGB1水平升高和单核巨噬细胞的浸润明显相关[17-18]。多项研究发现,急性冠脉综合征患者血清HMGB1水平显著升高,并且和冠心病的发生、发展和预后相关[19-20]。心力衰竭患者血清HMGB1明显升高,并且与病情严重程度相关,是恶性心血管事件和心脏移植的独立预测因子之一[21]。
有研究发现,血清LDL、HDL水平异常是冠心病发生、发展的重要危险因素,这与本研究发现一致,而HMGB1与血清LDL、HDL水平呈明显相关,可能参与了AMI的发生、发展过程[22]。细胞外研究证实AMI后30 min坏死心肌局部HMGB1水平升高,不仅介导炎症反应,而且还通过促进内皮细胞的增殖和分化、组织修复、血管再生参与心肌结构重构[10]。
本研究发现AMI血清HMGB1水平较对照组明显升高,这可能与高脂和大量坏死细胞核构成的冠状动脉粥样斑块破裂相关。有研究发现HMGB1能够诱导血管平滑肌细胞迁移和增生,这可能是动脉粥样硬化斑块形成和支架再狭窄的关键机制[18,23-24],而且HMGB1升高增加不良血管增生的概率[20]。
在大鼠心梗模型中,HMGB1基因表达增加,并释放至细胞外,通过ERK1/2信号转导通路,使交感神经过度激活和室性心律失常的发生风险增加[25]。而本研究发现,AMI后血清HMGB1水平增加,对AMI后心房颤动的发生具有诊断价值,这与LI等[25]的研究一致。
综上所述,AMI患者血清HMGB1水平明显升高,可能通过调节炎症反应、细胞凋亡等途径参与AMI的发生、发展,预测AMI后心房颤动的发生。通过监测血清HMGB1水平对AMI的诊治具有一定的临床指导意义。但是其具体的作用机制和途径还需要不同种族、不同地区及大样本量的前瞻性流行病学和临床研究结果证实。

