羊肚菌多糖饮液的制备
王雪梅 龙叶峰 周乐松 伍泳达 范 瑞 周春晖*
(1广东轻工职业技术学院食品与生物技术学院,广东广州 510030;2广东第二师范学院生物与食品工程学院,广东广州 510303)
羊肚菌(Morchella esculenta)又称羊蘑、羊肚菜、羊肚蘑,其多糖是羊肚菌体内主要的活性成分,具有抗病毒、抗肿瘤、抗疲劳、调节机体免疫力、降血脂、预防动脉粥样化等众多功效。目前,羊肚菌仍以烹饪食用为主,其他加工食品较少,因此,提取羊肚菌的功能活性成分——多糖,并研制出无须烹调、方便携带、食用便利的羊肚菌多糖饮液,有利于提高羊肚菌多糖的利用价值。羊肚菌多糖提取方法主要有水提法、酶解法、超声波辅助提取法、微波萃取法等。笔者以云南丽江的羊肚菌为原料,采用酶解水提法提取羊肚菌多糖,并采用正交法研制成羊肚菌多糖饮液,为羊肚菌多糖功能食品的开发与利用提供参考。
1 材料与方法
1.1 材料与主要设备
泛美羊肚菌(中号):购自云南丽江批发市场;纤维素酶(酶活性为1×105U/g),和氏璧生物科技有限公司;菠萝蛋白酶(酶活性为1×105U/g),鑫诚生物科技有限公司;无水乙醇,河南鑫河阳酒精有限公司;葡萄糖:天津市致远化学试剂有限公司;98%浓硫酸,洛阳市化学试剂有限公司;苯酚,天津市永大化学试剂有限公司。试验中所用化学试剂均为分析纯。
101-3AB型电热鼓风干燥箱,天津泰斯特仪器有限公司;电热恒温水浴锅,天津市泰斯特仪器有限公司;FW177型中草药粉碎机,天津泰斯特仪器有限公司;pH-100笔式酸度计,上海力辰邦西仪器科技有限公司;LH-Q90型折光仪,杭州陆恒生物科技有限公司;JJ500A型分析天平,福建艾杰尔进出口有限公司;V-5100型分光光度计,上海元析仪器有限公司。
1.2 试验方法
1.2.1 提取多糖
1.2.1.1 提取流程
取大小相近的羊肚菌子实体剪柄除杂,放置干燥箱中55℃干燥3 h,粉碎,过孔径0.425 mm网,得到羊肚菌粉末,置干燥器中保存备用[1]。取5 g羊肚菌粉末,加入150 mL去离子水溶解,加入1%的纤维素酶,调节pH为5.0,55℃酶解1 h,然后升温至80℃水提2 h,升温至95℃灭活,离心取上清液,加入4倍无水乙醇醇沉18 h,5 000 r/min离心15 min,取沉淀用相同倍数去离子水溶解,加入1%菠萝蛋白酶50℃酶解1 h脱蛋白,离心取上清液,即得羊肚菌多糖溶液。
1.2.1.2 多糖含量的检测
采用硫酸-苯酚法对多糖进行检测。将羊肚菌多糖溶液定容至50 mL容量瓶,移取2.0 mL至试管中,加入1.0 mL 6%的苯酚溶液、5.0 mL的浓硫酸,摇匀、静置30 min,490 nm处测定吸光值[2]。
其中,C为羊肚菌多糖的质量浓度(mg/mL);N为试验中的稀释倍数;M为羊肚菌子实体的质量(g);V为多糖溶液稀释的倍数;f为换算系数。
1.2.1.3 多糖提取单因素试验
以多糖得率为指标,分别选取液料比、酶解酶用量、酶解时间、浸提时间为影响因素,设计单因素试验,考察各因素对多糖得率的影响(控制其他因素不变),单因素试验因素设置:液(mL)料(g)比20∶1、25∶1、30∶1、35∶1、40∶1;酶用量0.8%、1.0%、1.2%、1.4%、1.6%;酶解时间0.5 h、1.0 h、1.5 h、2.0 h、2.5 h;浸提时间1.0 h、1.5 h、2.0 h、2.5 h、3.0 h。
1.2.1.4 响应面优化多糖提取工艺
为了有效优化羊肚菌多糖的提取工艺,依据单因素试验的结果,选取液料比、酶解时间、浸提时间三个影响显著的因素,以多糖得率为响应值,采用Design-Expert 8.0.5设计响应面优化试验,响应面因素和水平见表1。
1.2.2 羊肚菌多糖饮液制备
取适量的羊肚菌多糖溶液,加入适量的三氯蔗糖、低聚果糖、VC,搅拌均匀,转移至均质机均质15 min,装瓶50 mL,90℃灭菌20 min,冷却后即可得到成品。
1.2.2.1 饮液评价指标
如表2所示,饮液以感官评价为综合指标,其中风味30分、口感30分、组织状态25分、色泽15分,满分100分。

表2 羊肚菌多糖饮液感官评价内容
1.2.2.2 羊肚菌多糖饮液单因素试验
选定三氯蔗糖添加量为0.15 g/kg、低聚果糖添加量为40 g/kg、VC添加量为0.4 g/kg,多糖质量浓度为2 mg/mL,分别考察不同多糖质量浓度(1 mg/mL、1.5 mg/mL、2 mg/mL、2.5 mg/mL、3 mg/mL)、三氯蔗糖添加量(0.05 g/kg、0.1 g/kg、0.15 g/kg、0.2 g/kg、0.25 g/kg)、低聚果糖添加量(20 g/kg、30 g/kg、40 g/kg、50 g/kg、60 g/kg)、VC添 加 量(0.25 g/kg、0.3 g/kg、0.35 g/kg、0.4 g/kg、0.45 g/kg)对羊肚菌多糖饮液的影响。
1.2.2.3 正交试验优化多糖饮液配方
根据单因素试验的结果,选定多糖质量浓度为2 mg/mL,选取三氯蔗糖添加量、低聚果糖添加量、VC添加量进行正交试验,试验因素和水平如表3。
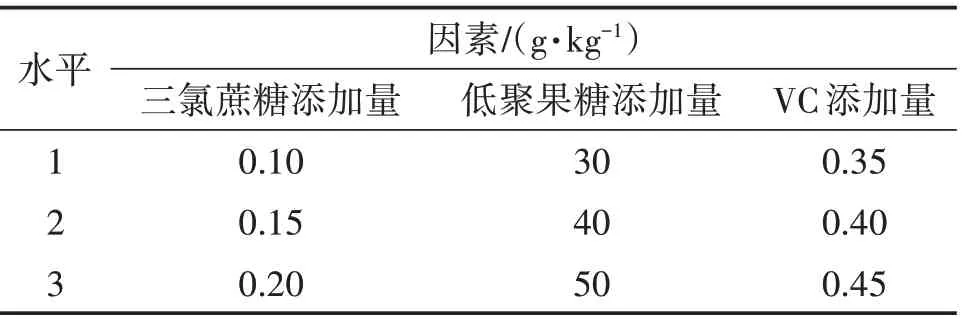
表3 多糖饮液正交试验因素水平
2 结果与分析
2.1 羊肚菌多糖提取单因素试验结果
由图1可得,羊肚菌多糖得率均随液料比、酶用量、酶解时间、浸提时间的增大(延长)呈现先上升后下降的趋势。分别在液料比35∶1、酶用量1.20%、酶解时间1.5 h、浸提时间2 h时,多糖得率达最大值,分别为6.46%、5.71%、6.02%、6.32%,随后开始下降。原因可能是液料比过大,过量提取剂对提取体系内的传热和传质造成影响而导致多糖得率下降[3];酶用量过多,过多的酶使已经饱和的酶分子与反应底物接触过度而降低体系的反应速度,使多糖溶出量减少[4];酶解时间过长,导致少量羊肚菌多糖结构发生变化[5],使多糖得率逐渐下降;浸提时间过度延长,细胞内外渗透压趋于平衡,多糖溶出水溶液的推动力逐步下降,同时长时间的高温会使一部分多糖发生降解[6],导致羊肚菌多糖得率下降。
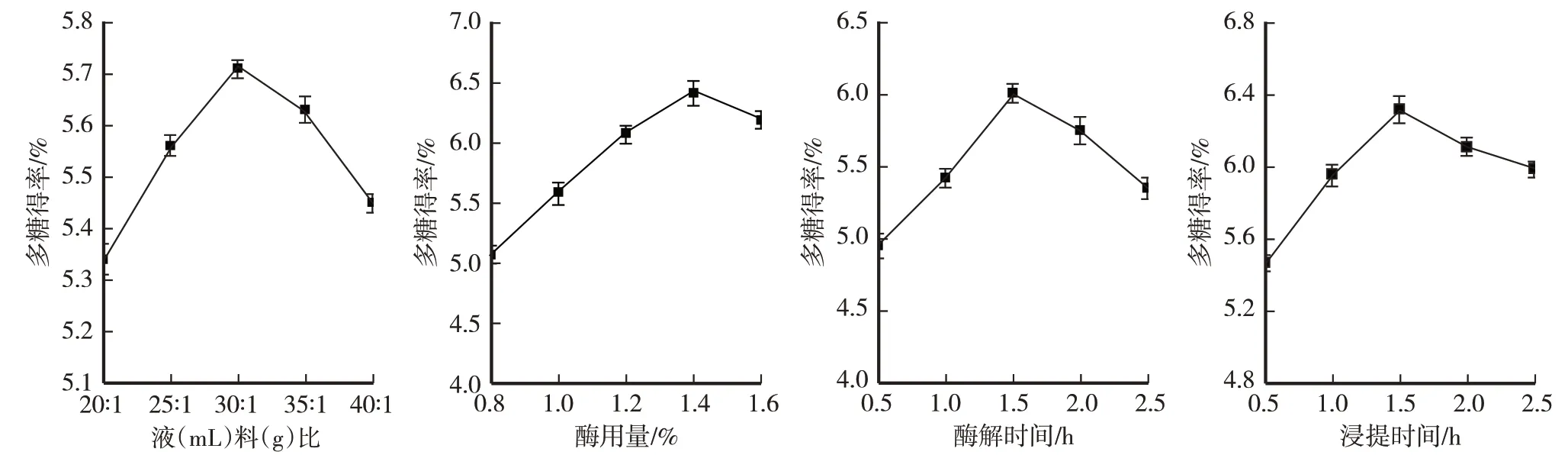
图1 不同液料比、酶用量、酶解时间、浸提时间对羊肚菌多糖得率的影响
2.2 响应面优化提取工艺试验结果
根据单因素试验的结果,固定酶用量为1.2%,以液(mL)料(g)比(A)、酶解时间(B)、浸提时间(C)为显著因素,响应面优化结果如表4。
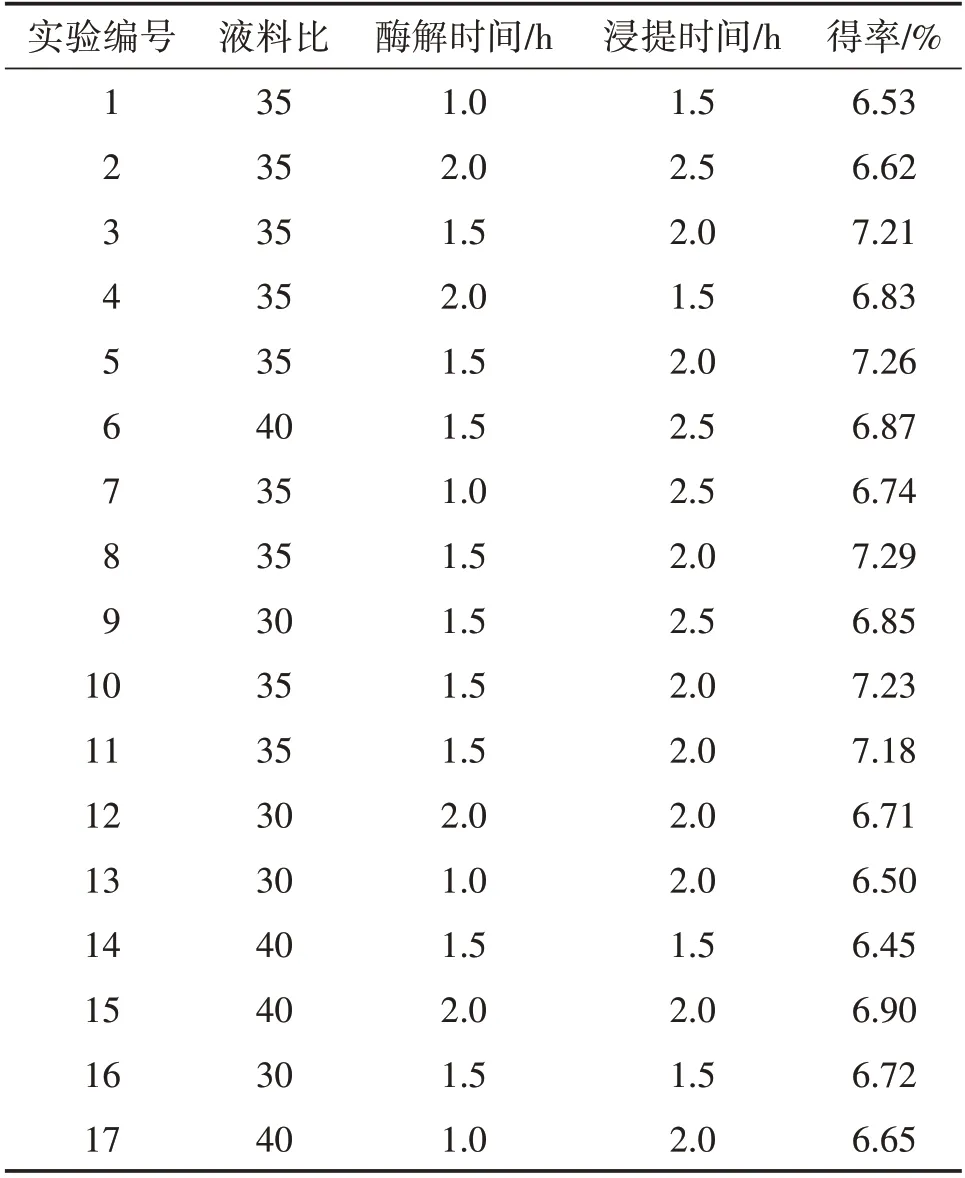
表4 提取多糖响应面优化结果
对表4试验结果进行多元回归拟合,所得回归方程为Y=7.23+0.011A+0.080B+0.069C+1.000E-002AB+0.073AC-0.10BC-0.25A2-0.29B2-0.26C2,回归模型方差如表5所示。
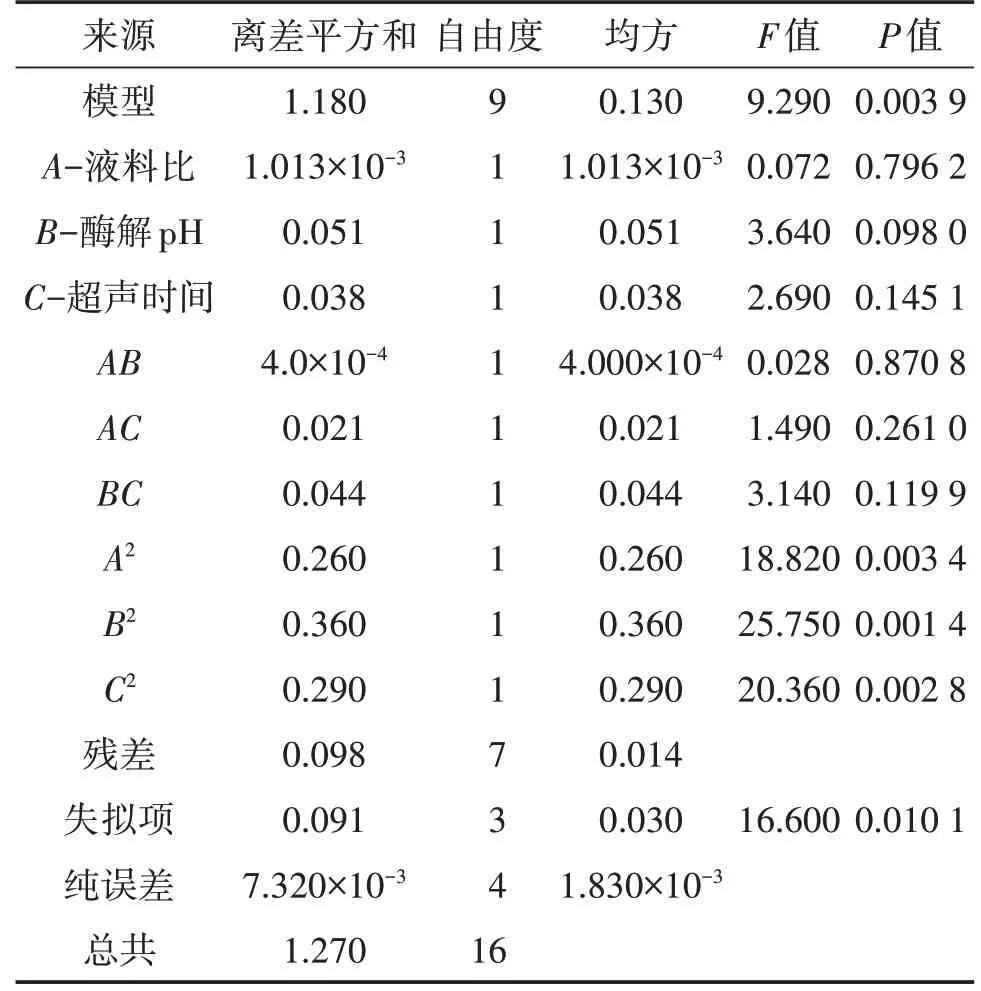
表5 回归模型方差表
由表5可得,各因素对多糖得率影响的程度依次为B(酶解时间)>C(浸提时间)>A(液料比),回归模型的F为9.29,P<0.01,极显著,失拟项的F为16.60,P<0.05,失拟项不显著,该模型拟合度较好,且科学、可用。
由图2的响应面图和等高线图可得,各因素中每两两因素之间交互作用显著,在液料比32∶1~38∶1、酶解时间1.2~1.8 h时;液料比32∶1~38∶1、浸提时间1.7~2.3 h时;酶解时间1.2~1.8 h、浸提时间1.7~2.3 h时,多糖得率呈现先上升后下降的趋势。经过对模型的分析,得到最佳配方:液料比35.21∶1,酶解时间1.56 h,浸提时间2.06 h,该条件多糖得率为7.24%,为方便操作,将提取工艺修改为液料比35∶1,酶解时间1.5 h,浸提时间2 h,经验证羊肚菌多糖得率为7.21%,优化效果明显。
2.3 羊肚菌饮液单因素试验结果
由图3可得,羊肚菌多糖饮液的得分均随多糖质量浓度、三氯蔗糖添加量、低聚果糖添加量、VC添加量的上升呈现先升高后下降的趋势。当多糖质量浓度为2 mg/mL、三氯蔗糖添加量为0.15 g/kg、低聚果糖添加量为40 g/kg、VC添加量为0.4 g/kg时,羊肚菌饮液的得分均达最高,随后开始下降。其原因是羊肚菌多糖本身具有独特的风味,其添加量过多或过少均会影响饮液口感,三氯蔗糖、低聚果糖有甜味,VC有酸味,甜味过多或者酸味过多均会影响饮液的口感。
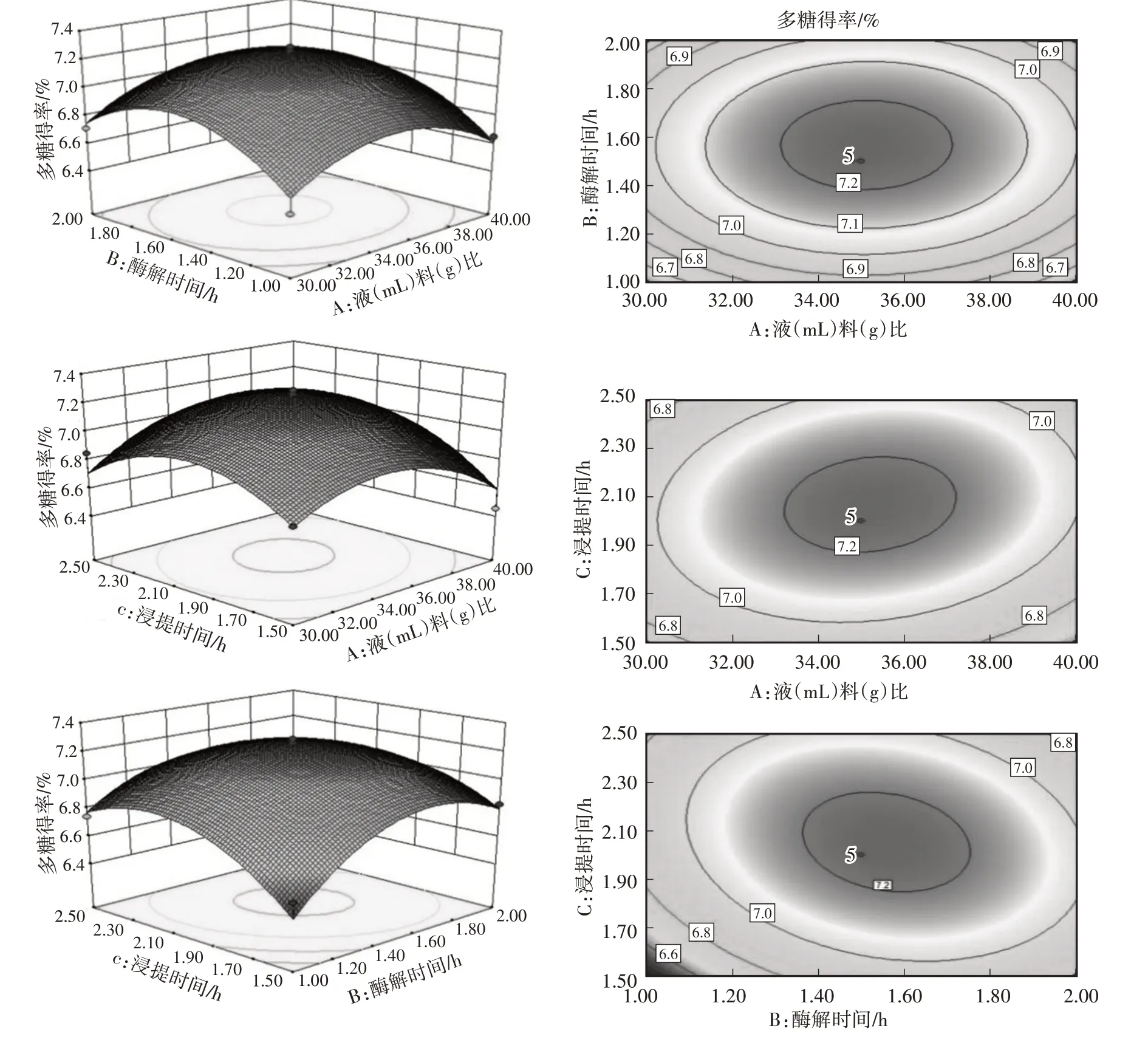
图2 响应面图和等高线图
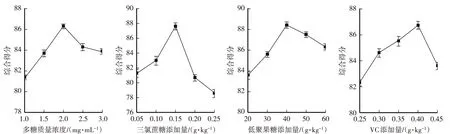
图3 羊肚菌多糖质量浓度,三氯蔗糖、低聚果糖、VC添加量对饮液综合得分的影响
2.4 羊肚菌多糖饮液正交试验结果
由表6可知,三个因素对羊肚菌多糖饮液结果影响的程度为A>C>B,即三氯蔗糖的添加量>VC的添加量>低聚果糖的添加量,三氯蔗糖添加量对饮液配方的影响最大,低聚果糖添加量对饮液配方的影响最小,最优组合为A2B2C2,即三氯蔗糖的添加量为0.15 g/kg,低聚果糖的添加量为40 g/kg,VC的添加量为0.4 g/kg。
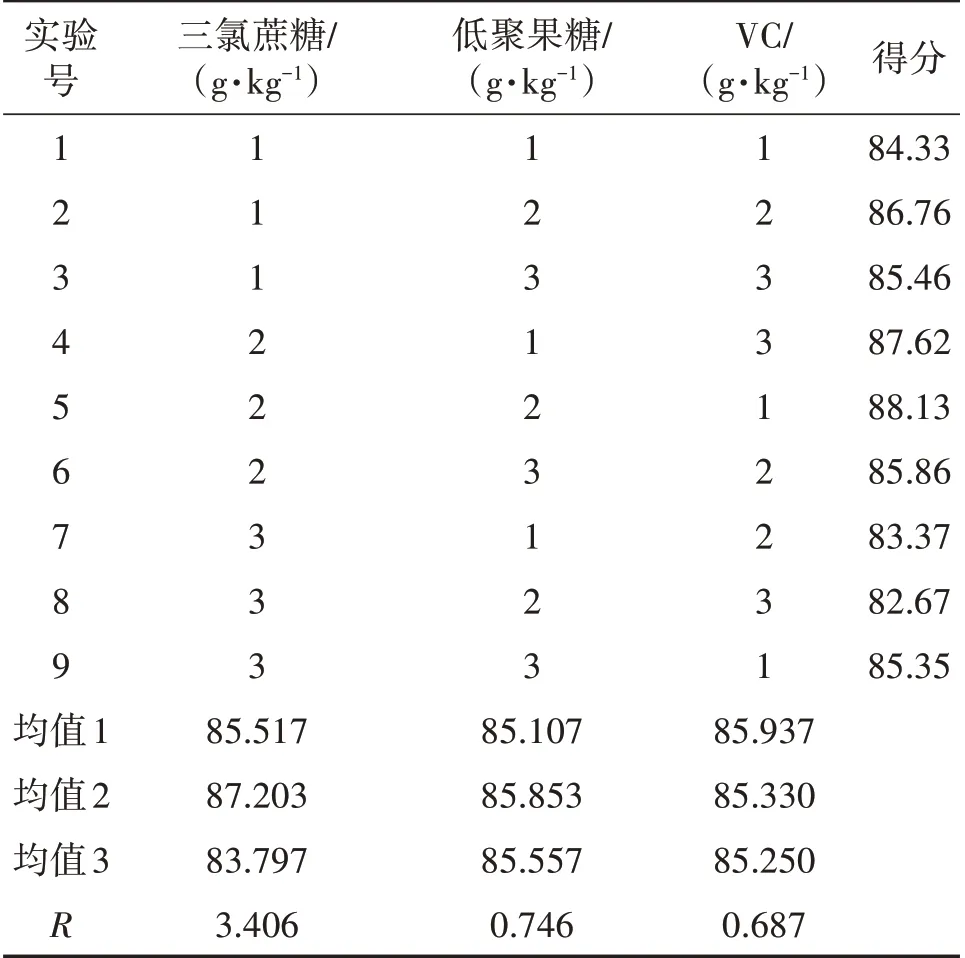
表6 羊肚菌多糖饮液正交试验结果
3 小结
酶解水提法提取羊肚菌多糖,并利用其研制羊肚菌多糖饮液。设置单因素试验,通过方差分析排除对多糖得率影响较小的因素,并对其他影响因素进行响应面优化试验,最终得到提取羊肚菌多糖最佳工艺。选定羊肚菌多糖浓度为2 mg/mL,对其他因素正交试验研制多糖饮液,直观分析得到羊肚菌饮液最佳的配方为多糖2 mg/mL,三氯蔗糖0.15 g/kg,低聚果糖40 g/kg、VC 0.4 g/kg。低聚果糖不易引起龋齿,具有调节肠道菌群、缓解便秘、降血脂等功效,目标人群广泛。
羊肚菌是世界公认的珍稀食用菌之一,提取羊肚菌多糖并加工成功能食品,丰富羊肚菌高附加值产品。试验也为羊肚菌功能食品的研制提供了参考。

