小鼠腹膜炎模型下血小板的生物学特征及其转录组变化
孙志强, 夏美娟, 郑琳, 赵晶晶, 苏培, 王洪涛, 周家喜, 刘翠翠
中国医学科学院血液病医院(中国医学科学院血液学研究所), 北京协和医学院, 实验血液学国家重点实验室, 国家血液系统疾病临床医学研究中心, 天津 300020
血小板是血液系统中体积最小的血细胞,直径约2~3 μm[1],在机体止血和血栓中发挥重要作用[2]。近年来,血小板的免疫功能逐渐被研究者们发现并得到验证[3]。据报道,血小板参与炎症[4]、自身免疫病[5]和抗细菌/病毒感染[6-8]等多种免疫应答过程,可通过黏附清除病原体[9]、分泌活性物质[10]、与免疫细胞相互作用[11]和抗原加工与提呈[12]等多种途径发挥免疫调控作用。例如,在外源性感染早期,血小板可以通过与白细胞相互作用,尤其是中性粒细胞,加快中性粒细胞向感染部位募集[13];血小板与中性粒细胞聚集体的形成,有助于调节和诱导中性粒细胞的免疫功能[14-15]。
虽然没有细胞核,但是血小板的胞质内仍含有种类丰富的RNA,介导血小板的多种功能[16]。随着RNA测序的快速发展,血小板的转录组分析在血小板生物学研究中的应用也越来越广泛。目前,血小板在不同疾病状态下的转录组变化已经有部分研究报道,包括脓毒血症[17]、心肌梗塞[18]、病毒感染[19]等。例如,Middleton等[17]通过对脓毒血症患者和小鼠模型的血小板进行转录组测序发现,表面黏附分子CD41蛋白编码基因ITGA2B(integrin subunit alpha 2b)在脓毒血症的血小板中显著上调,并与患者死亡率增加相关。Campbell等[20]通过对健康人和登革热病人的血小板进行转录组测序也发现,炎症相关基因IFITM3(interferon induced transmembrane protein 3)在登革热病人的血小板中高表达,其表达水平与患者病情的严重程度和死亡率高度相关。因此,解析血小板的转录组变化不仅可以加深对于血小板本身生物学功能及其潜在分子机制的理解,而且在临床疾病的诊断与病情评估中也有极大的应用价值。
急性感染模型是研究炎症状态下免疫细胞数量与功能变化的重要工具,能为临床上急性炎症治疗提供理论指导与支撑[21]。为了研究急性感染条件下免疫细胞和血小板的变化,本研究首先通过小鼠腹腔注射热灭活的大肠杆菌,构建了小鼠腹膜炎急性感染模型;同时借助血常规、流式细胞术等实验技术,对感染过程中腹腔免疫细胞和外周血细胞进行动态检测;最后,通过RNA-Seq解析感染后小鼠血小板转录组的表达变化。本研究有助于加深对急性感染过程中机体免疫应答的认知,旨在为解析血小板免疫调节功能的分子机制提供新的角度。
1 材料与方法
1.1 主要实验试剂
兽用血细胞分析用稀释液购自深圳mindray公司;台式液购自广州沛瑜生物制品有限公司;Trizol购自美国Thermo Scientific公司;本研究中所用抗体均购自美国BioLegend公司。
1.2 实验仪器
CantoⅡ流式细胞仪(美国BD公司);NanoDrop 2000(美国Thermo Scientific公司);BC-5000Vet血细胞分析仪(深圳mindray公司);Multiskan GO酶标仪(美国Thermo Scientific公司)。
1.3 实验动物
8周龄的C57BL/6J雌鼠(SPF级别)由中国医学科学院&北京协和医学院血液病医院(血液学研究所)实验血液学国家重点实验室动物中心购买并提供,所有的动物实验操作都符合中国医学科学院血液病医院伦理委员会的规定与要求。
1.4 E.coli菌种培养与保存
用接种环取少量大肠杆菌Escherichiacoli(菌种19138;ATCC)菌液接种在LB固体培养基中活化,37 ℃孵箱恒温培养18~24 h。挑取单个菌落置于4 mL LB液体培养基中进行二次活化,37 ℃、200 r·min-1培养10 h。取菌液和30%甘油按体积比1∶1混匀,置于-80 ℃冰箱保存。
1.5 小鼠腹膜炎模型构建
取1.4中二次活化后的E.coli菌液,8 000 r·min-1离心2 min,弃上清。用生理盐水洗涤2遍后重悬于1 mL生理盐水中。取洗涤后的适量E.coli菌液与生理盐水1∶5稀释后用酶标仪测定吸光度(OD600)值并按照每0.1 OD值相当于1×108cfu·mL-1计算菌浓度。其余E.coli菌液置于80 ℃,高温灭活30 min。根据测定的菌浓度将灭活的菌液用生理盐水稀释至1×107cfu·300 μL-1,冷却至室温后给每只小鼠腹腔注射300 μL。
1.6 小鼠腹腔细胞检测
为了检测腹膜炎条件下小鼠腹腔中巨噬细胞、中性粒细胞数目和比例的动态变化,脱颈法处死E.coli感染不同时间点(0、6、12、24、36、48、72 h)的腹膜炎模型小鼠,使用75%乙醇溶液浸泡1 min,用剪刀剪开小鼠腹部毛皮,用10 mL注射器吸取10 mL PE溶液,在腹正中线处进针,反复多次冲洗小鼠腹腔获得腹腔细胞悬液,2 000 r·min-1离心5 min得到细胞沉淀,再用适量PBS溶液重悬。
利用血细胞分析仪对腹腔细胞重悬液进行血细胞分类与计数。同时,取腹腔细胞重悬液,按抗体说明书要求加入适量抗小鼠CD45、抗小鼠CD11b、抗小鼠Ly6G、抗小鼠F4/80抗体,4 ℃标记30 min。标记结束后,加入1 mL PBS溶液,2 000 r·min-1离心5 min,洗去未结合的抗体,适量PBS溶液重悬后用CantoⅡ仪器进行流式检测。
1.7 小鼠外周血血细胞检测
为了检测腹膜炎条件下小鼠外周血中单核细胞、中性粒细胞和血小板数目的动态变化,取腹膜炎模型小鼠造模后不同时间点(0、6、12、24、36、48、72 h)的内眦静脉血20 μL,加入到480 μL血细胞稀释液中,涡旋混匀,使用血细胞分析仪预稀释模式检测小鼠外周血血细胞分类与计数。
1.8 血小板分离与纯化
取腹膜炎模型小鼠和注射等量生理盐水的对照小鼠造模后36 h的下腔静脉血800~1 000 μL,加入等体积生理盐水稀释混匀,1 000 r·min-1离心5 min(5升5降)。取富含血小板的上层液体并转移至新的EP管中,3 500 r·min-1离心2 min。弃上清,加入CGS溶液(pH 6.5)重悬,2 500 r·min-1离心2 min,洗涤2遍。弃上清,加入台式液重悬,静置1 h,得到纯化后的血小板(纯度大于99.9%)。
1.9 转录组分析
取腹腔注射生理盐水和热灭活E.coli的小鼠,在注射后36 h通过下腔静脉取血,分离并纯化血小板。使用Trizol裂解血小板,提取RNA。用NanoDrop 2000对RNA浓度进行测定和质控。RNA浓度(10~1 000 ng·μL-1)和质控合格(28S/18S≥1.0)的样本送由诺禾致源公司进行转录组测序,测序样本独立重复3次。随后,使用STAR(version 2.7.2a)软件的默认参数对质控后的原始数据(fastq)进行基因组比对,从GENCODE中下载gencode.vM25作为小鼠的参考基因组。使用featureCounts(version 2.0.1)软件的默认参数得到样本的基因表达谱。对标准化后的基因表达谱进行非参数检验和计算倍数变化(foldchange, FC)。
1.10 血小板表面黏附分子表达水平检测
为了检测小鼠腹膜炎感染前后血小板表面黏附分子CD42d的蛋白表达水平,通过小鼠内眦静脉取血并进行血小板纯化,取纯化后的血小板,按抗体说明书的要求加入抗小鼠CD41、抗小鼠CD42d抗体,室温标记30 min。标记结束后,加入1 mL CGS溶液,2 500 r·min-1离心2 min,洗去未结合的抗体,适量台式液重悬后用CantoⅡ仪器进行流式检测。
1.11 数据统计
使用FlowJoV10软件对流式检测数据进行分析,实验数据使用GraphPad Prism8进行统计分析和作图。实验数据用Mean±SD表示,利用标准t检验对实验数据进行分析,其中P<0.05则认为数据差异具有统计学意义。
2 结果与分析
2.1 感染过程中腹腔和外周血中免疫细胞检测
为了研究免疫细胞和血小板在急性炎症条件下的潜在作用,通过注射热灭活的大肠杆菌(1×107cfu·只-1)构建了小鼠腹膜炎模型。巨噬细胞与中性粒细胞是固有免疫细胞的重要组成部分,基于小鼠腹膜炎模型,首先检测了感染过程中腹腔内巨噬细胞(CD45+CD11b+F4/80+)和中性粒细胞(CD45+CD11b+Ly6G+)比例的动态变化,结果发现腹腔内巨噬细胞的比例在感染后6 h急剧降低至最低值,并持续保持该低水平,直至72 h开始回升。而腹腔内中性粒细胞的比例则在感染后6 h快速升高,12 h到达最高值,之后逐渐降低,在72 h大致恢复到正常水平(图1A)。进一步细胞计数发现,腹腔内巨噬细胞和中性粒细胞的数目与比例变化基本一致(图1B~1C)。外周血细胞动态检测发现,单核细胞数目在感染后24 h开始显著增加,在感染后期达到并维持在最大值,这可能与感染后期小鼠腹腔巨噬细胞数目的回升有关(图1D)。而外周血中性粒细胞数目在感染后6 h迅速增加,12 h达到最大值,之后开始逐渐减少,这与小鼠腹腔内中性粒细胞数目的变化趋势相一致(图1E)。上述结果提示,在感染初期,腹腔内巨噬细胞最先发挥杀菌作用,随后外周中性粒细胞快速迁移至腹腔参与炎症反应。

A:小鼠腹膜炎模型感染过程中腹腔内CD45+细胞中巨噬细胞和中性粒细胞比例动态变化流式分析,巨噬细胞:CD45+CD11b+F4/80+,中性粒细胞:CD45+CD11b+Ly6G+;B:小鼠腹膜炎模型感染过程中腹腔内巨噬细胞数目的动态变化,每个时间点3只小鼠;C:小鼠腹膜炎模型感染过程中腹腔内中性粒细胞数目的动态变化,每个时间点3只小鼠;D:小鼠腹膜炎模型感染过程中外周血单核细胞数目的动态变化,每个时间点5只小鼠;E:小鼠腹膜炎模型感染过程中外周血中性粒细胞数目的动态变化,每个时间点5只小鼠。*,**,***分别表示处理在P<0.05、P<0.01、P<0.001水平差异有统计学意义;NS表示无统计学差异(P>0.05)。
2.2 感染过程中外周血血小板检测
随后,为了研究腹膜炎急性感染对小鼠血小板生物学特征的影响,进一步探究了血小板的数目、大小在急性感染过程中的动态变化。血常规检测发现,血小板数目在感染后6 h内大幅降低(下降约50%),在24 h降至最低,之后逐渐升高,72 h后恢复到正常水平(图2A)。此外,平均血小板体积(mean platelet volume,MPV)和血小板分布宽度(platelet distribution width,PDW)则在感染后呈现升高趋势,说明感染后血小板体积增大且均一性降低(图2B~2C)。上述结果表明,在急性感染过程中血小板的数目和大小会发生显著变化,可能预示着血小板转录组和生物学功能的改变。

A:小鼠腹膜炎模型感染过程中外周血血小板数目的动态变化;B:小鼠腹膜炎模型感染过程中外周血血小板MPV的动态变化;C:小鼠腹膜炎模型感染过程中外周血血小板PDW的动态变化。每个时间点5只小鼠。*,**,***,****分别表示处理在P<0.05、P<0.01、P<0.001、P<0.000 1水平差异有统计学意义;NS表示无统计学差异(P>0.05)。
2.3 感染前后血小板转录组分析
为了进一步研究感染前后血小板的转录组变化,分别收集了对照组和感染小鼠的纯化血小板(纯度大于99.9%)进行了RNA-Seq。通过对两组6个测序样本进行主成分分析(principal component analysis, PCA),发现对照组和实验组的3个血小板样本组内变异小,但组间具有明显差异(图3A)。差异基因分析发现,3 725个编码基因在感染组血小板中显著上调(P<0.05, 上升倍数≥2),仅108个基因在感染后明显下降(P<0.05, 下降倍数≥2)(图3B)。为了进一步研究急性感染中血小板转录组变化的生物学意义,首先对感染组表达上调的基因进行Gene Ontology(GO)分析。结果表明,这些基因显著富集于中性粒细胞脱颗粒、中性粒细胞介导的免疫和中性粒细胞激活等基因集(图3C)。Gene Set Enrichment Analysis(GSEA)分析发现,与对照血小板相比,白细胞跨内皮迁移(NES=1.51,P=0)相关基因显著富集在感染组血小板中(图3D)。上述结果提示,在急性感染过程中,血小板可能通过促进白细胞迁移、中性粒细胞激活等过程参与免疫应答。
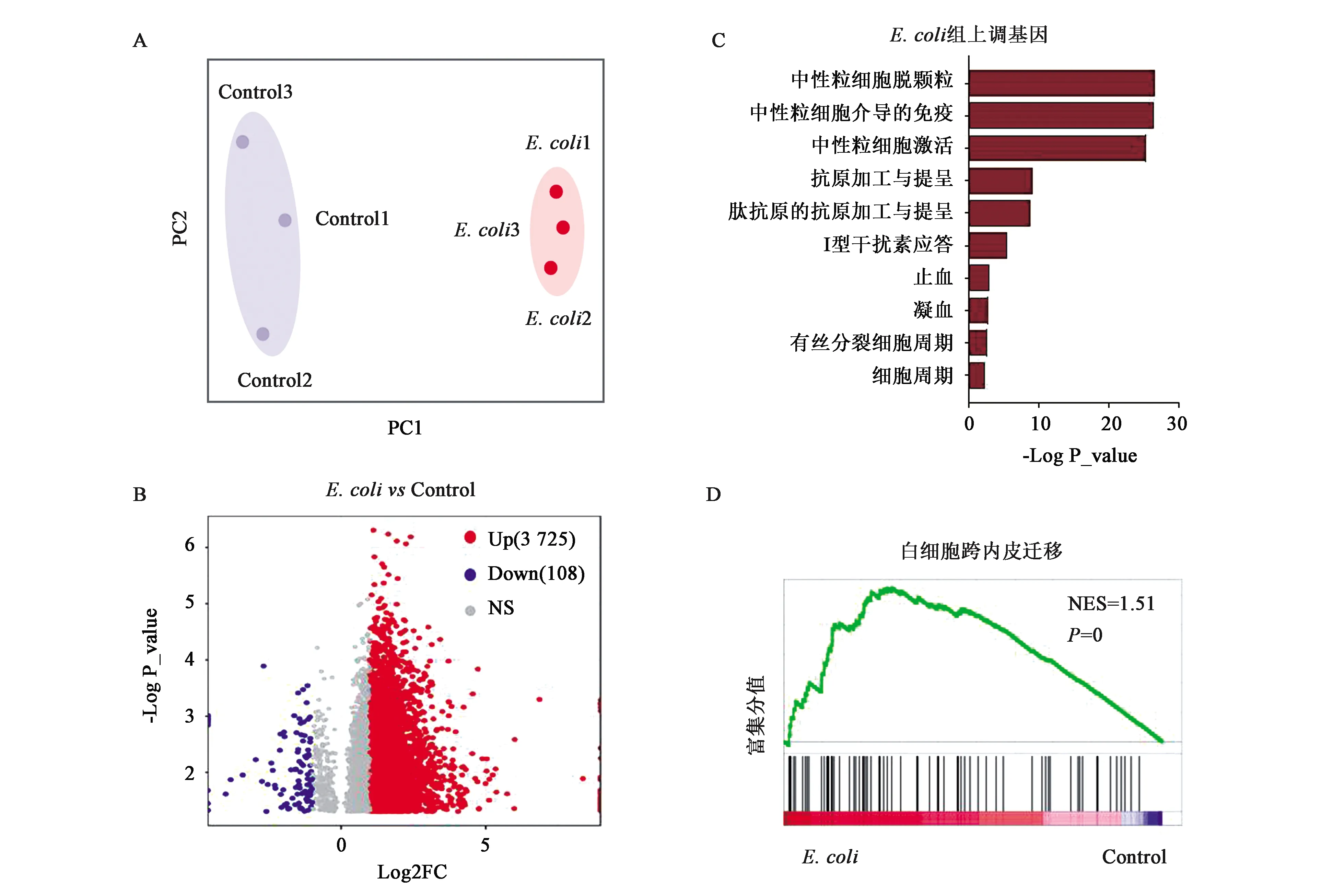
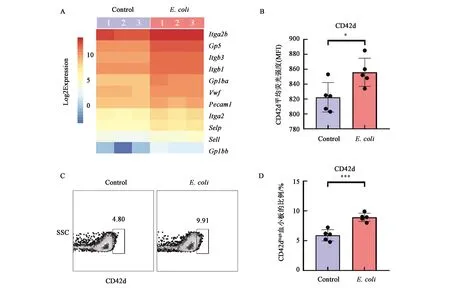
A:对照小鼠和腹膜炎模型小鼠外周血血小板转录组PCA,由3次独立重复实验得到6个血小板RNA样本;B:对照小鼠和腹膜炎模型小鼠血小板中的差异基因火山图(Volcano Plot)(E.coli vs control:腹膜炎小鼠 vs 对照小鼠),Up表示表达水平上调的基因(P<0.05,FC≥2),Down表示表达水平下调的基因(P<0.05,FC≤0.5),NS表示表达水平无显著差异的基因(P<0.05,0.5 血小板表面黏附分子在血小板与中性粒细胞等白细胞的相互作用中发挥重要作用[22]。为了进一步探讨血小板促进白细胞迁移的潜在分子机制,对比了两组血小板中表面黏附分子的表达变化(P<0.05, 上升倍数≥2)。分析发现,人血管性血友病因子vWF、血小板内皮细胞粘附分子-1(Pecam1,CD31)、L-选择素(Sell,CD62L)、P-选择素(Selp,CD62P)等介导血小板与白细胞或内皮细胞黏附的关键因子均在感染后显著上调(图4A)。而且,Itga2b(CD41)、Gp5、Gp1ba和Gp1bb(CD42d/b/c)等黏附分子经典受体基因的表达也明显升高(图4A)。为了进一步检测上述表面黏附分子的蛋白表达水平,选取了表达丰度和差异倍数均较高的CD42d进行流式检测。分析发现,与对照组相比,感染36 h后血小板CD42d的平均荧光强度显著增强(图4B)。而且,感染36 h后CD42dhigh血小板的比例也显著升高(图4C~4D)。上述结果提示,急性炎症条件下,血小板可能通过高表达多种表面黏附分子促进白细胞迁移,从而参与调节免疫反应。 A:对照小鼠(Control)和腹膜炎模型小鼠(E.coli)血小板中表面黏附分子的表达分析热图(Heatmap);B:对照小鼠和腹膜炎模型小鼠血小板中黏附分子CD42d的平均荧光强度(MFI)流式结果统计分析;C:对照小鼠和腹膜炎模型小鼠中CD42dhigh血小板比例流式检测结果;D:对照小鼠和腹膜炎模型小鼠CD42dhigh血小板比例统计分析。流式分析验证中对照小鼠和腹膜炎模型小鼠各5只。*和***分别表示在P<0.05和P<0.001水平差异有统计学意义。 本研究基于小鼠腹膜炎急性感染模型,对免疫细胞和血小板在急性感染过程中的动态变化进行了细致的检测与分析。研究发现,在感染早期外周血中性粒细胞能快速迁移至腹腔参与炎症反应,外周血血小板数目和大小在感染过程中发生显著变化。进一步对血小板转录组进行RNA测序,分析发现腹膜炎模型小鼠的血小板转录组发生了显著改变,血小板中免疫反应相关基因在感染后显著上调,多种表面黏附分子的表达显著增加,血小板的免疫功能显著增强。 转录组测序技术是生物学研究中的重要工具。目前,血小板转录组测序在一些特定疾病条件下已有相关研究报道[16],这些研究极大地推动了血小板领域的发展,拓展了研究者们对血小板功能的认知,尤其是血小板的免疫功能。本研究通过对腹膜炎模型小鼠的血小板进行转录组测序,不仅为血小板研究领域提供了小鼠腹膜炎条件下血小板的转录图谱,而且为血小板免疫功能及作用机制的深入研究奠定了基础。 血小板的免疫功能多样,在机体固有免疫与适应性免疫应答中都发挥着重要作用。并且在不同疾病条件下,血小板参与免疫反应的分子机制也不尽相同。激活的血小板可以通过膜表面表达的P选择素(P-selectin)与白细胞表面的P选择素糖蛋白配体(P-selectin glycoprotein ligand-1,PSGL-1)相互作用,调节白细胞外渗、吞噬作用和细胞因子转录与释放等生物学功能[22]。血小板能和中性粒细胞形成聚集体,调节中性粒细胞活性氧(reactive oxygen species, ROS)、中性粒细胞细胞外陷阱(neutrophil extracellular traps, NETs)的产生与释放[14-15]。血小板表面受体分子在介导血小板抗感染和免疫反应中发挥重要作用,其中表面黏附分子CD41[23]、CD42[24]、P-selectin[25]和CD31[26]等在血小板聚集黏附、白细胞募集过程中尤为关键。本研究通过对血小板转录组测序数据进行生物信息学分析发现,腹膜炎急性感染后小鼠血小板的转录组发生了显著改变,大量免疫反应相关的基因以及多种介导血小板与白细胞或内皮细胞黏附的受配体分子的表达显著升高。上述结果提示,在急性炎症条件下,血小板可能通过高表达多种表面黏附分子增强自身的免疫功能,从而更快更强地促进白细胞迁移和激活中性粒细胞,参与调节炎症进程和免疫应答的过程之中。 总之,本研究对急性感染条件下血小板免疫调节功能的分子机制做了初步探索,但仍然存在许多有趣且重要的问题值得进一步研究。比如,急性感染条件下血小板免疫表型的改变,血小板与外周血其他免疫细胞相互作用的方式,血小板数量对腹膜炎急性感染进程的影响等。未来研究中对这些问题的解答,有助于深入了解血小板在腹膜炎等急性感染条件下的免疫调控机制,有望为急性感染患者的临床诊断与治疗提供新的思路和方法。2.4 感染后血小板表面黏附分子表达水平检测
3 讨论

