植物褪黑素研究进展
张融雪, 孙玥, 苏京平, 王胜军, 佟卉, 刘燕清, 孙林静
天津市农作物研究所,天津市农作物遗传育种重点实验室,天津 300384
1 植物中的褪黑素
褪黑素在动物中被发现很长时间后,研究者才在植物中开展了其鉴定分离研究,1995年在24种植物中都检测到了褪黑素[2]。植物中并没有松果体,但是也能够合成褪黑素,所以褪黑素合成途径是一个研究热点。参考动物中褪黑素合成途径,研究者陆续发现了植物褪黑素合成的关键组分,植物褪黑素合成途径逐渐明晰[3]。研究者还克隆了首个褪黑素植物受体,为褪黑素功能研究提供了有力支撑[4]。
1.1 植物褪黑素内源含量
褪黑素存在于高等植物中的许多器官,如根、茎、叶、花、果实和种子,通常每克组织浓度含量范围从pg到μg不等。农作物如禾本科的水稻、大麦、玉米褪黑素含量较高,一些药用植物如贯叶连翘、白曼陀罗等,许多水果如草莓、猕猴桃、菠萝、香蕉、葡萄等也都含有褪黑素。
褪黑素常用测定方法有液相色谱、放射免疫分析、超高效液相色谱-质谱联用、气象色谱-质谱连用、高效液相色谱、酶联免疫吸附测定[5]等方法。有研究报道水稻不同品种种子的褪黑素含量在20~200 ng·g-1,褪黑素含量差异为有色种皮大米高于白色种皮大米,糙米含量高于精米含量[6]。利用液相色谱测得大麦种子中褪黑素含量约为82.3 ng·g-1,小麦种子中含量为124.7 ng·g-1。水果中猕猴桃含量为0.02 ng·g-1,苹果中含量为0.16 ng·g-1,绿茶中褪黑素含量较高,可达2.12 μg·g-1。褪黑素含量不仅在不同物种间不相同,而且同一物种的不同品种间也不相同,同时,褪黑素含量在不同环境条件下特别是逆境中和不同植物发育阶段也是不同的[7]。
1.2 植物褪黑素合成途径
当褪黑素在植物中被发现后,其合成途径一直是研究的热点。褪黑素合成途径在动物中研究的较为清楚,色氨酸作为前体物质,经过4步酶促反应最后生成褪黑素。第一步是色氨酸经色氨酸羟化酶(tryptophan 5-hydroxylase, TPH)作用生成五羟色胺酸;再由芳香族氨基酸脱羧酶(aromatic-amino acid decarboxylase,AADC)作用生成血清素;然后在N-乙酰基转移酶(aralkylamine N-acetyltransferase, AANAT),又称为血清素N-乙酰基转移酶(serotonin N-acetyltransferase, SNAT)催化生成N-乙酰血清素;最后在N-乙酰血清素O-甲基转移酶(N-acetylserotonin O-methyltransferase, ASMT),也叫做羟基吲哚O-甲基转移酶(hydroxyindole O-methyltransferase, HIOMT)作用下生成褪黑素。植物中褪黑素合成途径与此大体类似,但具体过程仍有差异,植物中色氨酸首先经过色氨酸氧化酶(tryptophan decarboxylase, TDC)生成色胺,第二步由色胺羟化酶(tryptamine 5-hydroxylase, T5H)作用生成血清素,接下来的合成途径与动物褪黑素合成步骤相同[3]。
植物中褪黑素合成相关基因已经被陆续鉴定,水稻褪黑素合成途径研究进展较快,褪黑素合成相关基因已经被全部克隆。Kang等[8]从水稻中克隆了TDC1/AK069031和TDC2/AK103253,在水稻中过表达TDC1和TDC2基因提高了叶片和种子的血清素含量。Byeon等[9]从水稻中克隆到TDC3/NM_001067504,在水稻中过量表达TDC3不仅增加了叶片和种子褪黑素含量,还增加了5-羟色氨酸、色胺、血清素和N-乙酰血清素等褪黑素合成中间体含量。Fujiwara等[10]通过图位克隆从累积血清素合成前体色胺的水稻sekiguchilesion突变体中克隆到了T5H。体外重组表达该蛋白具有色胺5羟化酶活性,能催化色胺转变成血清素。Kang等[11]从水稻中克隆了催化褪黑素合成第三步的血清素乙酰转移酶SNAT。通过分析SNAT在植物中的同功能酶乙酰转移酶超家族(GCN5-related N-acetyltransferase superfamily gene, GNAT),结合原核表达蛋白酶活测定。确定了GNAT5是植物SNAT,能够快速催化血清素生成N-乙酰血清素。水稻褪黑素合成最后一步的ASMT1也由Kang等首先克隆得到。褪黑素是由O-甲基转移酶(O-methyltransferase, OMT)催化N-乙酰血清素的羟基变为氧甲基后生成,研究者分析了水稻基因组中所有的OMT,发现MT15具有ASMT酶活性能够催化生成褪黑素[12]。随后又有两个ASMT基因被克隆得到,分别是ASMT2和ASMT3,研究表明两者均具有O-甲基转移酶活性。基因表达分析结果显示,ASMT1和ASMT2在茎和花表达量较高,而ASMT3在整株中表达量都很低,这3个基因表达都受非生物胁迫和茉莉酸诱导[13]。
1.3 植物褪黑素信号受体
2018年Wei等[4]在拟南芥中发现了第一个植物褪黑素受体候选G蛋白偶联受体2(candidate G-protein coupled receptor 2, CAND2),主要证据是:CAND2是质膜定位、拓扑结构与受体类似、能与G蛋白α亚基相互作用、高度特异结合褪黑素、cand2突变体对褪黑素诱导的气孔关闭不敏感。褪黑素与CAND2结合触发G蛋白βγ亚基与α亚基解离,从而激活NADPH氧化酶依赖的H2O2的产生,增强Ca2+内流和促进K+外流,最终导致气孔关闭。相较于传统植物激素,褪黑素作为植物激素的研究工作还较少,需要进一步加强。
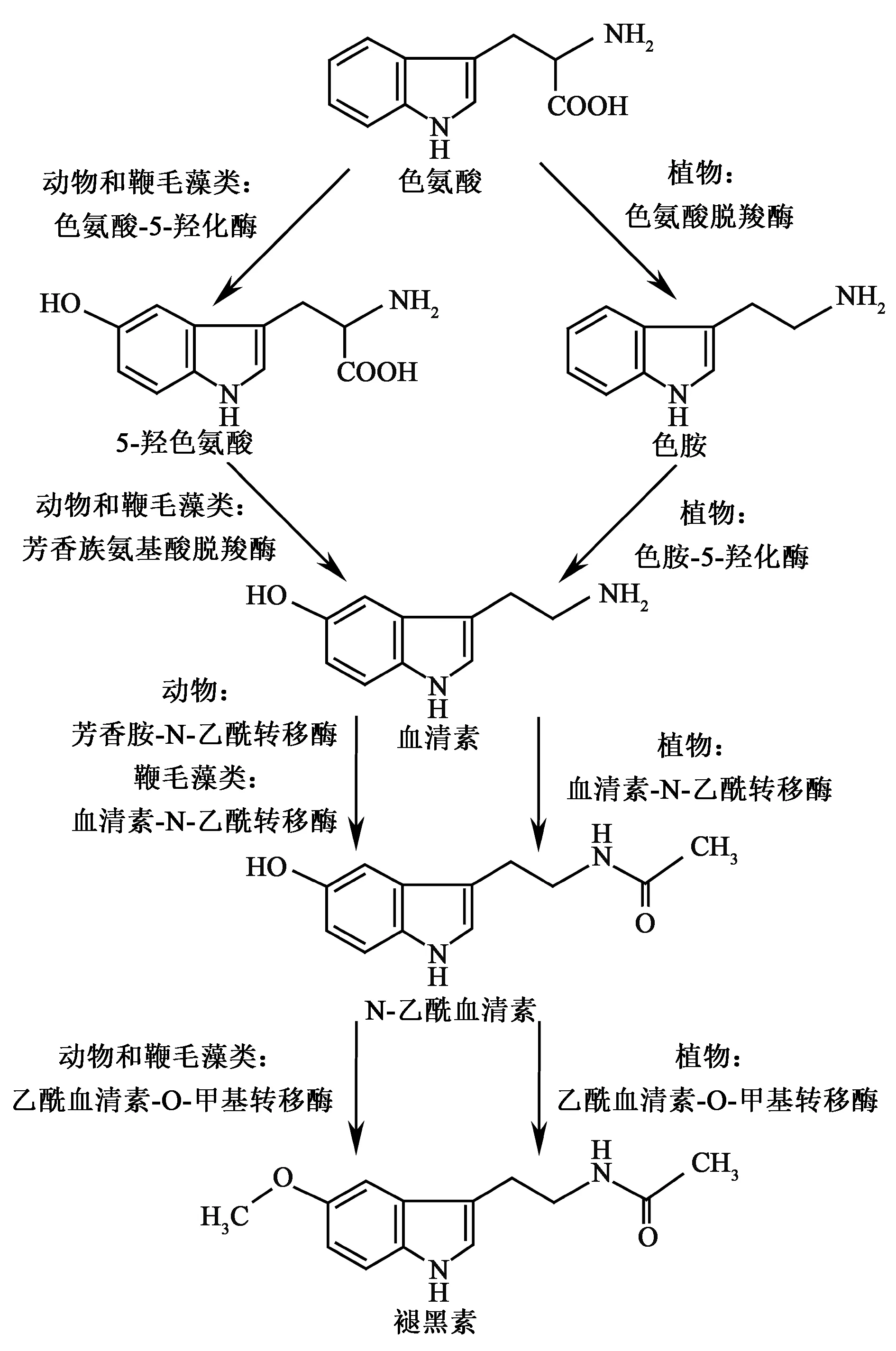
图1 植物褪黑素合成途径[3]
2 植物褪黑素的生理功能
褪黑素作为吲哚胺类物质,本身具有强还原力,能够清除植物体内产生的超氧阴离子、过氧化氢等自由基,从而发挥抗氧化作用。褪黑素和吲哚乙酸(indole-3-acetic acid, IAA)生物合成的共同前体是色氨酸[14],两者结构十分相似,二者在植物体内也有部分相似的生理功能[15]。研究表明褪黑素不仅能作为信号分子调节植物生长发育,还能作为信号分子和抗氧化剂参与植物非生物胁迫和生物胁迫应答[16]。
2.1 褪黑素调控植物生长发育
褪黑素能够促进细胞膨大,Hernandez-Ruiz证明褪黑素能够促进离体的白化羽扇豆下胚轴膨大生长,褪黑素与IAA在下胚轴的浓度分布类似,顶端最多,中间其次,基部最少;二者作用方式也类似,都是通过增加细胞膨大而促进生长[17]。
在信息化时代,行业的发展态势,企业的财务状况以及客户的需求情况都隐藏于数据之中。通过以大量的数据为基础,运用大数据技术进行数据挖掘和数据分析就可以准确的掌握行业的发展信心、企业的财务信心以及客户的需求信息使企业在市场竞争中立于不败之地。同样,将大数据技术应有于企业的财务内控管理当中就能够更加准确地找出财务问题和危机,使企业的财务内控管理水平得到提高。
褪黑素能促进萌发后种子根的生长,在过表达绵羊SNAT的水稻中,褪黑素含量增加了,与野生型相比,转基因水稻萌发后种子根数目没有变化但是根长较长,并且生物量也显著增加。在持续光照条件下,低浓度0.5~1.0 μmol·L-1褪黑素处理促进野生型水稻种子根伸长[18]。褪黑素通过调控糖代谢途径调节植物生长,外源添加褪黑素对玉米幼苗具有促进和抑制作用。最初研究表明褪黑素含量与蔗糖合成和水解相关基因表达、酶活力和蔗糖代谢呈正相关。进一步研究结果显示,外源添加低浓度褪黑素(10 μmol·L-1)能提高光合速率和己糖激酶活力,上调光合相关基因及己糖激酶相关基因表达,促进玉米生长,促进蔗糖代谢、光合作用和蔗糖韧皮部装载。而高浓度褪黑素(100 μmol·L-1)加速蔗糖、己糖和淀粉积累,抑制光合作用和蔗糖韧皮部装载[19]。
褪黑素还会影响开花时间,拟南芥褪黑素合成基因SNAT2在花中大量表达,SNAT2失活突变体中赤霉素合成途径相关基因贝壳杉烯合酶基因(ent-kaurenesynthase,KS)和开花控制基因(FLOWERINGLOCUST,FT)表达量下调,导致了晚花表型[20]。
上述研究表明,褪黑素可以作为小分子活性物质调控植物的细胞膨大、根生长、糖类物质代谢等生理过程,不同浓度作用不同,褪黑素是作为独立的信号分子调控还是仅仅作为IAA的类似物发挥功能还有待进一步研究。
2.2 褪黑素增强植物非生物胁迫抗性
2.2.1干旱胁迫干旱胁迫是一种常见的非生物胁迫,氧化胁迫被认为是非生物胁迫对植物的主要伤害之一,干旱胁迫造成膜系统的伤害主要是由细胞内活性氧的产生与清除的不平衡引起的[21]。褪黑素是内源性的抗氧化剂,外施褪黑素可提高植物过氧化物酶、超氧化物歧化酶、过氧化氢酶等抗氧化物质的含量和活性[22]。外施褪黑素能够显著降低干旱胁迫下苹果叶片叶绿素的降解,提高叶片光合效率,缓解氧化胁迫造成的伤害,从而有效延迟叶片的衰老[23]。外源添加褪黑素能够有效缓解由聚乙二醇造成的渗透胁迫对黄瓜种子萌发的抑制作用,并能促进生根,增强根系活力,提高根冠比[24]。增加植物内源褪黑素含量也可增强植物抗旱性,将苹果ASMT在拟南芥中过表达,转基因植株褪黑素含量较野生型增加了2~4倍;在干旱胁迫下,转基因植株的ROS积累量显著少于野生型,存活率较野生型高[25]。外源添加褪黑素能增强苹果幼苗的保水性、减少离子渗漏和稳定叶绿素含量,从而提高苹果耐旱性。褪黑素处理能下调ABA合成基因9顺式环氧类胡萝卜素二加氧酶3(nine-cis-epoxycarotenoid dioxygenase 3, NCED3),上调ABA代谢基因细胞色P450家族707亚家族A多肽1(cytochrome P450 family 707 subfamily A polypeptide 1, CYP707A1)和CYP707A2,降低ABA含量;还上调了褪黑素合成相关基因的表达,增加内源褪黑素合成,通过改善气孔功能和清除过氧化氢来提高苹果耐旱性[26]。
2.2.2盐胁迫盐胁迫抑制植物的生长和发育,过量盐离子对植物的伤害主要包括渗透胁迫、离子毒害和氧化胁迫。外源添加1 μmol·L-1褪黑素能够缓解盐胁迫对苹果生长的抑制作用,延缓叶绿素降解,减少氧化损伤;褪黑素处理还诱导了钠氢离子交换蛋白1(Na+/H+exchanger 1, MdNHX1)和钾离子通道蛋白(arabidopsis K+transporter1, MdAKT1)表达,将Na+转运至液泡从而降低细胞质中的Na+浓度,减少Na+毒害从而提高植株抗盐性[27]。Zhang等[28]研究表明,外源褪黑素能显著提高黄瓜种子在胁迫条件下的萌发率,一方面,褪黑素提高了黄瓜种子过氧化物酶、过氧化氢酶和超氧化物歧化酶的活力,减少了盐胁迫引起的氧化损伤,另一方面,褪黑素诱导了ABA代谢相关的细胞色素氧化酶CYP707A1和CYP707A2的表达,加快了ABA分解,同时还诱导了GA合成相关基因的表达从而减缓盐胁迫对种子萌发的抑制。外源施加褪黑素可调节水稻体内一系列氧化还原酶基因的表达,抑制光氧化叶片坏死突变体中活性氧的积累,延缓细胞死亡,有效地清除衰老和逆境条件下产生的活性氧积累,减轻细胞损伤,从而延缓水稻叶片衰老、提高盐胁迫抗性[29]。褪黑素预处理维持了番茄幼苗在盐胁迫下的生长和净光合速率,提高了生理盐水条件下光系统Ⅱ 的有效量子产量和光化学猝灭系数,从而增强了番茄幼苗光合活性对盐胁迫的耐受性[30]。盐胁迫降低了苹果的钾离子吸收并增加了过氧化氢的积累,褪黑素处理能上调钾离子转运基因和抗坏血酸-谷胱甘肽循环的抗氧化酶基因表达来应答上述盐胁迫伤害[31]。外源褪黑素处理能够增强葡萄苗期的耐盐性,作用机制是褪黑素作为信号分子诱导转录因子骨髓母细胞增多症病毒癌基因同源物108A(v-myb avian myeloblastosis viral oncogene homolog 108A, MYB108A),调控1-氨基环丙烷-1-羧酸合酶(1-aminocyclopropane-1-carboxylate synthase, ACS1)表达,通过增加乙烯合成量增强葡萄耐盐性[32]。褪黑素还能增强水稻幼苗的耐盐性,一方面褪黑素处理降低了盐诱导的钾离子外排,维持了钠离子和钾离子的平衡,另一方面褪黑素本身作为抗氧化剂清除了盐胁迫产生的羟基自由基,减少了自由基的伤害[33]。
2.2.3低温胁迫低温环境会影响植物细胞膜流动性和酶活力,抑制光合作用和营养物质的转运,造成植物体的损伤,引起作物减产。Lei等[34]发现褪黑素可使低温胁迫处理的胡萝卜悬浮细胞保持细胞膜完整性;褪黑素处理还能增强红景天愈伤组织低温耐性和美国榆冷冻芽的再生性[35-36]。褪黑素外源添加可显著增加低温胁迫下拟南芥的株高、根长和幼苗鲜重,同时冷适应相关转录因子如C重复结合因子(c repeat binding factor, CBF)、脱水响应元件结合蛋白(dehydration responsive element protein, DREB)、锌指蛋白10(zinc finger protein 10, ZAT10)等基因表达量也显著提高[37]。Shi等[38]研究发现低温胁迫下拟南芥体内褪黑素合成增加,同时锌指结构转录因子ZAT6基因表达量也增加,进一步研究发现ZAT6直接参与调控的CBF基因的表达是褪黑素诱导植物对抗冷胁迫所必需的,但是ZAT6并不调控冷胁迫处理过程中褪黑素含量的变化。
2.2.4高温胁迫外源褪黑素处理能显著提高拟南芥的耐热性,A1类热休克因子(class A1 heat shock factor, HSFA1s)参与了褪黑素诱导的耐热性。当拟南芥受到热胁迫时,内源性褪黑素水平迅速且大量诱导,增加的褪黑素进一步上调AtHSFA1s的表达。然后,AtHSFA1s的激活增加了拟南芥热响应基因如热击蛋白90(heat shock protein, HSP90)和HSP101的转录水平,从而增强了拟南芥的耐热性[39]。番茄中褪黑素也能增强热胁迫耐受性,生理方面缓解了热胁迫下的光抑制和降低了电解质渗漏。基因表达方面褪黑素通过上调HSP来加强蛋白折叠,还上调了自噬基因(autophagy-related gene, ATG)表达降解聚集蛋白,通过折叠或降解变性蛋白来促进细胞蛋白保护从而增强热胁迫耐受性[40]。
2.2.5重金属胁迫外源褪黑素处理能够增强植物对重金属的耐受性。番茄幼苗中遭受镉胁迫时,褪黑素处理能显著增强植株对镉的耐受性,一方面增强了植株的抗氧化能力,减少了镉胁迫对光合作用的影响;另一方面增强了镉离子在由根向地上部分转运过程中的区室封存,具体表现为根部镉离子含量在褪黑素处理后没有变化,但是叶片镉离子含量降低了[41]。褪黑素处理西瓜幼苗后,能增强植株对钒的耐受性。外源褪黑素增强了西瓜内源褪黑素的合成,同时还诱导了超氧化物歧化酶、过氧化物酶、过氧化氢酶、谷胱甘肽转移酶等基因的表达,降低了过氧化氢和丙二醛的积累;另外还减少了钒从根向茎和叶的运输,降低了茎和叶钒的积累[42]。
上述研究结果显示,褪黑素主要是从两方面增强植物非生物胁迫抗性,一方面是褪黑素本身作为抗氧化剂来清除植物体内的由非生物胁迫产生的自由基,减少氧化胁迫伤害;另一方面是作为信号分子,激活非生物胁迫应答基因表达,增强非生物胁迫抗性。
2.3 褪黑素提高植物生物胁迫抗性
褪黑素不仅能增强植物非生物胁迫耐受性,还能增强植物对生物胁迫的防御。在水稻悬浮培养基中外源施加血清素能诱导防御基因的表达和细胞死亡,增加水稻对稻瘟病侵染的抗性,以上结果表明血清素在水稻先天免疫中发挥重要作用[43]。褪黑激素参与了对强致病菌丁香假单胞菌DC3000的防御,拟南芥和烟草叶片上施用10 μmol·L-1浓度的褪黑激素可诱导多种致病相关基因(pathogenesis-related gene, PR)以及一系列由水杨酸(salicylic acid, SA)和乙烯(ethylene, ET)激活的防御基因。拟南芥病程相关基因非表达子1突变体npr1(nonexpressor of pathogenesis-related gene1, NPR1)和乙烯不敏感突变体ein2(ethylene insensitive 2, EIN2)中,褪黑激素诱导的PR基因几乎完全或部分被抑制,这表明SA和ET依赖于褪黑激素诱导的植物防御信号,还表明褪黑素可能是一种新的植物-病原体相互作用的防御信号分子[44]。
在拟南芥褪黑素合成途径基因SNAT突变体中,病程防御相关基因表达受到了影响。接种番茄细菌性叶斑病菌DC3000,snat中褪黑素合成含量下降至野生型的50%,对病原菌感染的敏感性增强,防御基因PR1、异分支合酶1(isochorismate synthase 1, ICS1)和植物防御素1.2(plant defensin1.2, PDF1.2)表达量降低。外源褪黑激素处理水杨酸羟化酶(sallicylate hydroxylase, nahG)拟南芥转基因植株后,无法诱导防御基因表达,但恢复了snat突变株防御基因的诱导表达。这表明褪黑素诱导防御基因的表达是依赖SA途径的[45]。
褪黑素通过诱导一些植物防御相关基因的表达来增强病原体的抗性,有研究表明这种诱导作用与丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)有关。褪黑素处理拟南芥和烟草,丝裂原活化蛋白激酶3(mitogen-activated protein kinase 3, MPK3)和MPK6被快速激活,褪黑素前体物质也能诱导这种激活,但是激活程度低于褪黑素。用褪黑素处理丝裂原活化蛋白激酶(mitogen-activated protein kinase kinase, MKK)突变体后,发现MKK4、MKK5、MKK7和MKK9参与了MPK3和MPK6的激活。这表明褪黑素介导的免疫反应是通过MAPK级联信号途径实现的[46]。
褪黑素处理能提高苹果植株对苹果斑病的抗性,经过褪黑素处理的叶片过氧化氢含量更低,植物防御相关酶的活性也得到增强,可能是通过这两方面提高了苹果抗病能力[47]。外源褪黑素能提高马铃薯对马铃薯晚疫病的耐受性,一方面褪黑素能抑制马铃薯晚疫病菌菌丝的生长,改变细胞超微结构,降低病菌对胁迫的耐受性,显著抑制病菌的生长。另一方面,褪黑素影响了马铃薯晚疫病菌的氨基酸代谢过程、胁迫耐受性、杀菌剂抗性和毒力相关基因的表达。研究还发现褪黑素和杀菌剂有协同作用,二者配合使用能减少杀菌剂用量,提高杀菌剂对马铃薯晚疫病的防治效果[48]。
上述研究表明褪黑素提高植物生物胁迫抗性主要是三方面的作用,一方面是褪黑素本身作为抑制剂限制细菌或真菌生长;第二方面是褪黑素发挥自身抗氧化剂功能,减少病菌入侵时产生的氧化胁迫;第三方面是褪黑素作为信号分子,通过SA或者MAPK途径诱导防御基因表达增强植物对生物胁迫的抗性。
3 展望
植物褪黑素作为新的生长调节小分子物质,逐渐成为植物研究领域的一个热点。在褪黑素生物合成方面,参考动物褪黑素合成途径,研究者陆续克隆了植物褪黑素合成的关键酶,解析了植物褪黑素的合成途径。在生理功能方面,褪黑素含有吲哚环,能否发挥类似于IAA的作用,促进细胞膨大、调节侧根生长、调控糖运输途径尚有待深入研究。在应对非生物胁迫方面,褪黑素一方面作为抗氧化剂来清除胁迫产生的自由基,另一方面能作为信号分子诱导非生物胁迫应答基因来增强植物耐逆性。在应对生物胁迫方面,褪黑素可以抑制细菌和真菌生长,还能通过SA诱导植物防御基因表达来抵御病害。虽然植物褪黑素研究目前已经取得了较多进展,但是还存在一些问题。首先,植物褪黑素含量方面对测定方法研究较多,而对培育高褪黑素含量的作物品种方面研究较少。如何利用褪黑素现有研究结果,结合传统育种理论和经验,选育高褪黑素含量的作物品种是一个具有吸引力和挑战性的研究方向;第二,褪黑素在信号感知、传导方面还不明晰,虽然克隆了一个褪黑素植物受体,该受体结合褪黑素后激活的直接下游信号研究较少,是否还有其他褪黑素受体也是亟待解决的科学问题;第三,褪黑素在植物应对非生物胁迫时能够诱导一些抗逆基因表达,具体是通过什么信号通路仍不明确;第四,褪黑素在植物应对生物胁迫时能通过SA或MAPK信号途径诱导防御基因表达,而另一个与防御反应密切相关的植物激素茉莉酸与褪黑素之间是否存在交叉也有待进一步研究。

