IL-13抑制剂在损伤大鼠尾椎间盘退变中的作用研究
陶红平, 张觅, 游长江, 戈惠, 刘洋, 郑先念
1.武汉市第五医院, 急诊科,武汉 430050;2.武汉市第五医院, 骨科,武汉 430050
椎间盘退变(intervertebral disc degeneration,IDD)是一种常见的运动系统退行性疾病,可能在受伤后发生,是导致慢性腰背部疼痛的主要原因,严重影响了全球约540万人的生活质量,对家庭和社会造成极大的影响[1]。自1999年以来,慢性背痛的发生率增加了54%[2]。椎间盘作为连接上下椎体的软骨样组织,其主要作用是传递和吸收作用在脊柱轴向的压缩应力、缓冲震动并增大脊柱的运动幅度,因此,是人体中较早发生退行性改变的组织。正常椎间盘由纤维环(AF)和髓核(NP)组织组成,营养物质通过软骨终板(CEP)扩散到椎间盘。AF主要由成纤维细胞样纤维环细胞和相互交联的Ⅰ型成纤维细胞组成。NP主要由富含Ⅱ型胶原蛋白、弹性蛋白和蛋白聚糖的细胞外基质(extracellular matrix, ECM)组成,它的作用是抵消和传递轴向压力载荷。AF中的纤维结构围绕着凝胶状的NP,以维持椎间盘的弹性和机械强度[3]。在正常椎间盘中,许多生长因子和细胞因子使ECM的合成和分解保持动态平衡[4]。虽然椎间盘退行性改变是多因素作用的结果,但是损伤是其中一个很重要的因素[5]。椎间盘退变过程中可以看到椎间盘胶原纤维的变化以及细胞外基质变化如糖胺聚糖、硫酸软骨素、硫酸角质素、透明质酸。纤维化是许多慢性非传染性疾病中发生的基本病理变化,并且是许多慢性疾病中组织器官功能下降甚至丧失的主要原因。纤维化几乎影响人体的所有系统和器官[6]。过度的纤维化会导致纤维结缔组织增多,实质细胞减少,从而导致器官结构破坏甚至功能衰竭。椎间盘细胞再生能力有限,轻微损伤的椎间盘主要以纤维化瘢痕修复为主。在这个过程中,大量成纤维细胞聚集在椎间盘组织中,改变了胶原纤维、细胞外基质的成分造成进一步的椎间盘退变;另一方面,成纤维细胞释放炎症因子也加速了椎间盘的退变过程[7]。因此减轻椎间盘纤维化的过程从某种程度上会减缓椎间盘的退行性改变。
组织发生纤维化过程往往与免疫效应细胞及其释放的细胞因子密切相关,其中IL-13是调节纤维化最重要的Th2细胞因子之一[8]。IL-13通过与IL-13受体结合发挥生物学作用,其中在IL-13信号通路中起关键作用的是可溶性IL-13Rα2(sIL-13Rα2)[9]。IL-13与成纤维细胞表面的IL-13Rα1受体复合物结合,导致信号转导子和转录激活子6(STAT6)的磷酸化。磷酸化的STAT6能够促进纤维化过程[10]。有研究表明在纤维化组织中,IL-13浓度较高,造成组织退变细胞外基质如Ⅰ型胶原、Ⅱ型胶原、蛋白多糖等的沉积改变[11]。因此,我们推断,给予IL-13细胞因子高效拮抗剂可能通过调控椎间盘纤维化过程减慢椎间盘损伤的退变过程。本研究通过给予不同浓度IL-13抑制剂sIL-13Rα2-Fc,并观察椎间盘病理变化,以期研究IL-13对椎间盘退变的作用及其机制。
1 材料与方法
1.1 材料
1.1.1动物清洁级SD雄性大鼠50只,8~10周龄,体重为250~300 g,购自湖北省疾控中心,许可证号:SCXK20199-0006(鄂)。常规饲料饲养,自由取食和饮水。实验符合动物伦理学要求,实验方案得到武汉市第五医院伦理委员会认可与批准。
1.1.2试剂PCR引物由武汉光谷生物工程有限公司合成。CollagenⅡ(批号sc-52658)、Aggrecan抗体(批号sc-166951)购于美国 Santa Cruz公司。β-actin抗体(批号ab8226)购于英国Abcam公司。sIL-13Rα2-Fc蛋白、核酸提取剂Trizol购于湖北天鹰生物科技有限责任公司;PCR试剂盒、Masson蓝化液、Weigert铁苏木素染色液、苏木素染色液、伊红染色液购于武汉丽华科技有限责任公司。抗胶原蛋白Ⅰ抗体、抗胶原蛋白Ⅱ抗体、抗β-肌动蛋白抗体购于武汉光谷生物工程有限公司。
1.1.3设备光学显微镜购于北京生物科技公司,石蜡组织切片机购于湖南荣和科技公司,高速离心机购于上海佳德仪器公司,净化工作台购于苏洁医疗器械(苏州)有限公司,偏振光显微镜购于武汉光学仪器厂。
1.2 方法
1.2.1建立大鼠尾椎间盘退变模型在实验开始前,所有大鼠在动物房适应性饲养3 d,常规单独饲养,自由进食、饮水。大鼠随机编号分为5组,每组10只:空白组、模型组、sIL-13Rα2-Fc蛋白低剂量干预组、sIL-13Rα2-Fc蛋白中剂量干预组和sIL-13Rα2-Fc蛋白高剂量干预组。空白组正常饲养,不作特殊处理;其余各组通过针刺法对椎间盘进行穿刺建立模型。具体的穿刺方法如下:腹腔内注射麻醉大鼠。麻醉成功后,将大鼠采取俯卧位固定于操作台上,碘伏消毒铺巾。选择Co7/8、Co8/9、Co9/10 椎间隙按照Chia-Hsian等[12]的方法,选用20 G的注射针头进行纤维环穿刺。造模完成后第7日开始以造模路径分别注射不同浓度的sIL-13Rα2-Fc蛋白(低剂量组 1 mg·kg-1、中剂量组 1.5 mg·kg-1、高剂量组 2 mg·kg-1)和等剂量生理盐水(模型组)。在药物干预后第4周每组处死5只大鼠,第6周再每组处死5只大鼠。取出Co7/8、Co8/9、Co9/10椎间盘及其临近椎体,将其放入10%甲醛溶液浸泡固定。
1.2.2组织学染色HE染色:椎间盘常规脱水、二甲苯透明、石蜡包埋后切片。伊红染色3 min,弃去,乙醇梯度脱水、二甲苯脱蜡、中性树胶封片。封片后倒置显微镜观察。Masson染色:蜡块切片脱蜡至水苏木精染色1 min,磷钼酸分色液分化,苯胺蓝染色5 min,无水乙醇冲洗,吹干后中性树胶封片。封片后倒置显微镜观察。根据组织学分类的主要子类别对组织切片进行分级(表1)。

表1 椎间盘染色的组织学分级标准
1.2.3椎间盘糖胺多糖、硫酸软骨素、硫酸角质素、透明质酸含量测定第4、6周取大鼠全层椎间盘放入EP管中,加入木瓜蛋白酶消化液,消化36 h。各组采用DMMB比色法定量检测试剂盒测定,计算测定结果。
1.2.4Ⅰ型胶原蛋白及Ⅱ型胶原蛋白mRNA表达水平检测利用 Trizol 法提取组织总RNA。使用微量分光光度计在A260/A280处测量RNA含量。分别根据QuantiNova逆转录试剂盒说明依次进行逆转录和PCR扩增。以GAPDH为内参,按照说明书行实时定量PCR检测。每组实验均重复3次。具体引物序列见表2。
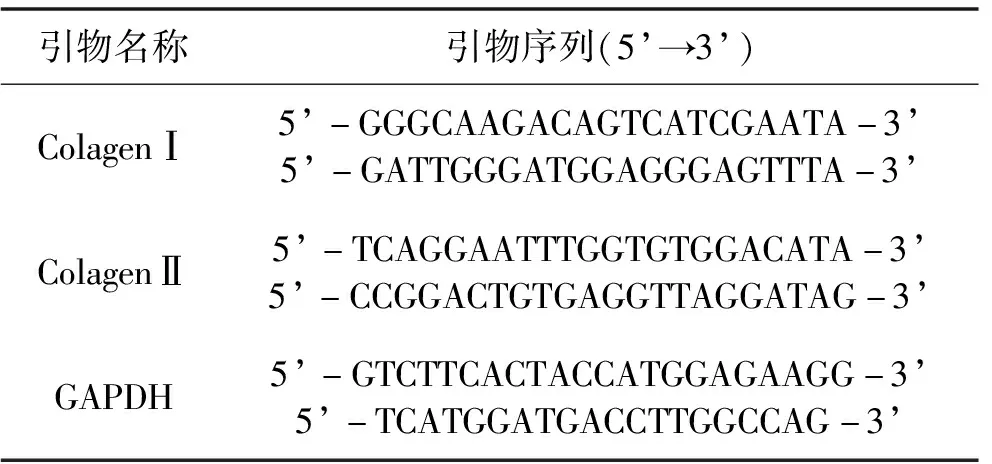
表2 RT-PCR相关基因的引物序列
1.2.5蛋白质印迹分析取椎间盘组织,研磨棒充分研磨。RIPA缓冲液裂解细胞,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离含蛋白质样品,并电泳转移到硝酸纤维素膜上。在室温下,用在Tris缓冲盐水中稀释的5%脱脂牛奶将膜封闭。漂洗后分别与抗CollagenⅠ(1∶800)、抗CollagenⅡ(1∶800)、β-actin(1∶1 000)等抗体4 ℃孵育过夜,洗膜后, 再加入二抗继续室温孵育1 h。采用Image Pro Plus 软件通过光密度测定法对条带进行分析。
1.2.6统计分析采用SPSS 20.0软件进行分析实验数据, 定量数据用均数±标准差表示, 使用单因素方差分析进行多个组之间的比较。P<0.05被认为具有统计学差异。
2 结果与分析
2.1 sIL-13Rα2-Fc对大鼠尾椎间盘组织形态的影响
在sIL-13Rα2-Fc干预的第4和6周对大鼠椎间盘组织进行染色分析(图1~3)。从切片可见,模型组和sIL-13Rα2-Fc蛋白干预组的椎间盘组织中的NP细胞数量减少,AF的排列紊乱并破裂,说明纤维环穿刺法造模成功,模型组及干预组均出现不同程度椎间盘退行性改变。sIL-13Rα2-Fc蛋白干预4周后,与模型组相比,sIL-13Rα2-Fc蛋白干预组的椎间盘退变有所缓解,AF和NP之间的连接处变宽。干预6周后,模型组椎间盘AF的排列更加紊乱,破裂部位扩大,NP细胞数量明显减少。与模型组相比,sIL-13Rα2-Fc显著减缓了大鼠椎间盘髓核和纤维环退变,其特征在于纤维环排列规则,破裂部位的减小和NP细胞数量的增加。说明IL-13抑制剂sIL-13Rα2-Fc干预能够不同程度改善椎间盘退变。各实验组sIL-13Rα2-Fc干预的第4周和第6周的椎间盘总评分见表3和表4。

表3 IL-13抑制剂干预4周后椎间盘评分

表4 IL-13抑制剂干预6周后椎间盘评分
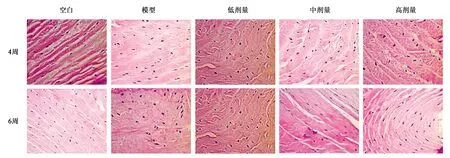
图1 椎间盘纤维环HE染色(×40)
2.2 IL-13抑制剂对大鼠尾椎间盘组织糖胺多糖(GAG)、硫酸软骨素(CS)、硫酸角质素(KS)、透明质酸(HA)含量的影响
干预第4周,模型组的GAG和HA含量(P<0.05)及CS/KS比(P<0.05)低于空白组。与模型组相比,低剂量干预组的GAG和HA含量、CS/KS无差异(P>0.05),而中、高干预组的GAG和HA含量增加(P<0.05),CS/KS比显著增加。与模型组相比,中、高干预组中的GAG和HA含量随时间增加(P<0.05),CS/KS比缓慢降低且呈现浓度依赖性。这些结果表明椎间盘退变可导致细胞外基质成分改变,糖胺多糖、硫酸软骨素、硫酸角质素、透明质酸含量下降,而sIL-13Rα2-Fc干预可明显增加糖胺多糖、硫酸软骨素、硫酸角质素、透明质酸含量(图4)。
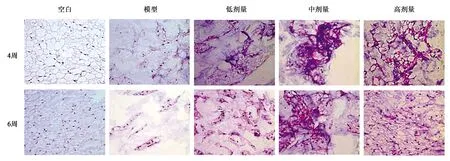
图2 椎间盘髓核HE染色(×40)
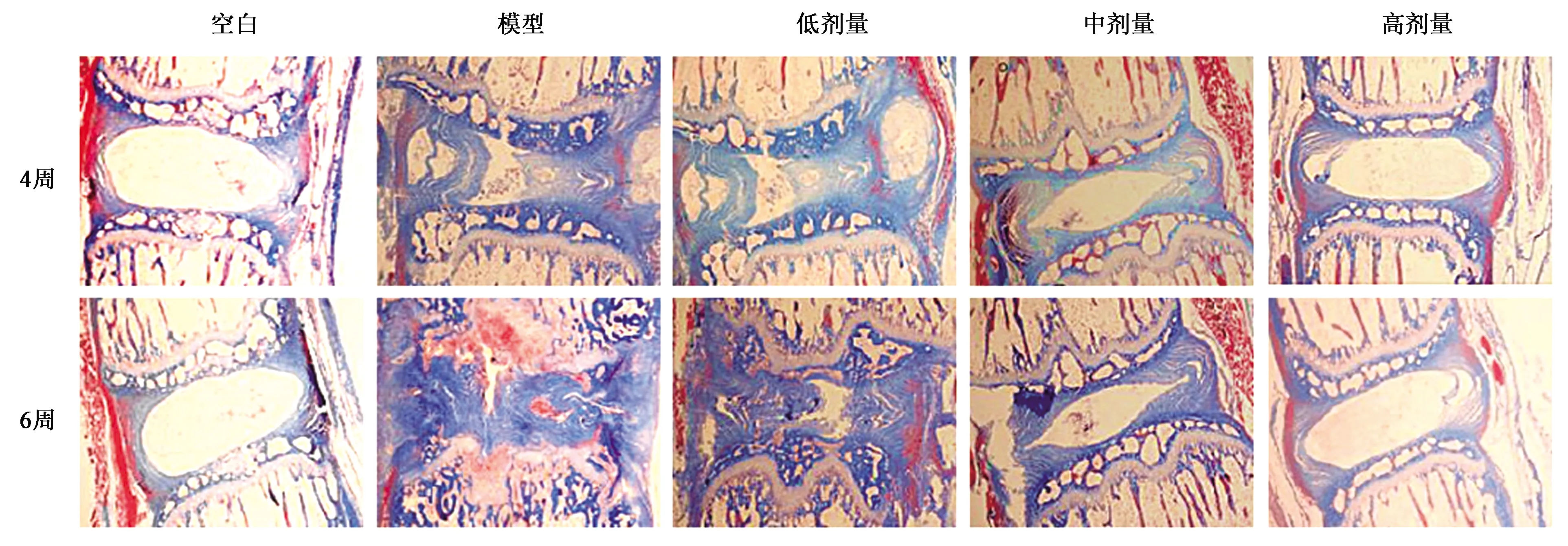
图3 大鼠椎间盘Masson染色
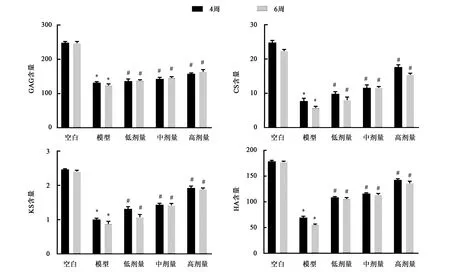
注:*表示与空白组相比较,在P<0.05水平有统计学差异。#表示与模型组相比较,在P<0.05水平有统计学差异。
2.3 IL-13抑制剂对大鼠尾椎间盘组织Ⅰ型和Ⅱ型胶原蛋白mRNA表达的影响
干预第4周,模型组和干预组的Ⅰ型胶原蛋白mRNA表达水平高于空白组(P<0.05),Ⅱ型胶原蛋白mRNA表达水平低于空白组(P<0.05)。在干预第6周,随着干预时间的延长,Ⅰ型胶原蛋白mRNA表达水平降低(P<0.05),Ⅱ型胶原蛋白mRNA表达水平增加(P<0.05),呈浓度依赖性(图5)。RT-PCR结果表明sIL-13Rα2-Fc干预能够减少Ⅰ型胶原蛋白的水平,并增加Ⅱ型胶原蛋白水平,减轻椎间盘退行性改变并呈时间浓度依赖性。
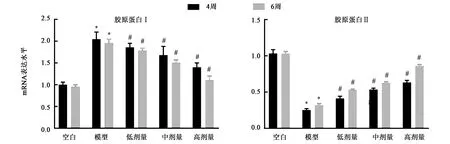
注:*表示与空白组相比较,在P<0.05水平有统计学差异。#分别表示与模型组相比较,在P<0.05水平有统计学差异。
2.4 Western blot分析IL-13抑制剂对大鼠尾椎间盘组织中Ⅰ型和Ⅱ型胶原蛋白表达的影响
Western blot结果显示,干预第4周,模型组和干预组的Ⅰ型胶原蛋白水平高于空白组(P<0.05),Ⅱ型胶原蛋白水平低于空白组(P<0.05)。与干预第4周相比,干预第6周Ⅰ型胶原蛋白水平降低(P<0.05),Ⅱ型胶原蛋白水平增加(P<0.05),呈浓度依赖性(图6~7)。上述结果表明sIL-13Rα2-Fc干预能够减少Ⅰ型胶原蛋白的水平,并增加Ⅱ型胶原蛋白水平,减轻椎间盘退行性改变,并呈时间浓度依赖性。

注:*表示与空白组相比较,在P<0.05水平有统计学差异。#表示与模型组相比较,在P<0.05水平有统计学差异。
3 讨论
椎间盘退行性疾病是临床上的常见疾病。其治疗方式包括药物治疗、物理治疗及手术治疗,但长期疗效并不令人满意。椎间盘退行性变可能与损伤、年龄、感染、遗传等因素相关。在椎间盘的退变过程中会发生椎间盘细胞的代谢异常,如可降解酶的过度表达、炎性因子的上调、健康细胞的丢失,以及细胞外基质合成的减少等[13]。椎间盘组织的结构改变是椎间盘功能受损的标志,包括髓核细胞的凋亡增加、髓核细胞数量减少、细胞内的Ⅱ型胶原蛋白含量和水分子含量显著低于正常的髓核细胞[14]。这些结构变化通过物理和生物学手段很容易检测出来。研究表明针刺法建立椎间盘退变模型可以在形态和生物化学上显示与人类椎间盘退变相类似的特征[15]。尾椎间盘针刺操作简单,对周围组织干扰少,可重复性高,且啮齿类动物的尾椎间盘很容易引起退变,可以作为椎间盘退变修复研究模型[16],因此本研究采用大鼠尾椎间盘针刺法建模作为人类椎间盘退变的模型[17]。

图7 椎间盘组织中Ⅰ型和Ⅱ型胶原蛋白的Western blot分析
IL-13是一类重要的细胞因子,其受体复合物由至少3个不同的成分组成,包括IL-4受体、低亲和力结合链IL-13R1和高亲和力结合链IL-13R2[18]。例如,竞争性抑制IL-13Rα1与IL-13的结合会导致IL-13介导的IL-13/JAK/STAT6信号通路的阻断,异常胶原蛋白分泌和表达的抑制以及细胞外基质的变化和沉积的减少,从而减少组织损伤。IL-13R2-Fc是一种融合蛋白,它与IL-13结合后可有效阻断相关的细胞信号传导途径,因此可作为IL-13的高亲和力拮抗剂[18],用于在体外和体内中和IL-13[20]。Belperio等[21]研究表明,sIL-13Rα2融合蛋白下调了血吸虫病患者外周血单个核细胞培养基中的IL-13含量,并减少了组织纤维化。Lumsden等[22]研究表明在肺纤维化中sIL-13Rα2的过表达抑制了IL-13和胶原蛋白的表达,从而发挥了抗纤维化作用。而IL-13R2-Fc在椎间盘纤维化过程中的作用还缺乏相关的研究。在本研究中,我们进行了HE和Masson染色以评估大鼠椎间盘组织的病理变化。结果显示,与空白组相比,模型组的椎间盘组织受损程度不同,具体表现为纤维环破裂、排列紊乱、髓核细胞数量减少以及纤维环和髓核之间的边界模糊,椎间盘评分高。在sIL-13Rα2-Fc干预后,椎间盘组织纤维环破坏减少、细胞排列整齐、椎间盘评分减低,表明sIL-13Rα2-Fc可一定程度缓解椎间盘退变相关的病理变化。
组织纤维化是椎间盘退变的重要机制,主要表现为大量成纤维细胞的堆积、ECM沉积、炎症反应和组织结构破坏。研究表明,组织纤维化的发展和进程受多种因素影响,主要是胶原蛋白和ECM的合成和降解之间的不平衡,导致ECM组成和含量发生变化。椎间盘的ECM成分主要由胶原蛋白和蛋白聚糖组成。椎间盘疾病发生后,蛋白聚糖含量降低,蛋白聚糖通过基质降解酶的作用被片段化,组织中渗出小片段,使椎间盘的渗透压降低并削弱了其保湿作用[23],可导致椎间盘生物力学功能下降甚至丧失,从而引起一系列临床症状[24-25]。GAG、CS、KS、HA与蛋白聚糖相关,其含量变化一定程度上可模拟退变椎间盘的ECM变化,可作为评估椎间盘退变的指标[26]。在本研究中,我们定量检测了GAG、CS、KS、HA,发现退化的椎间盘组织中其含量均有不同程度的降低,而给予sIL-13Rα2-Fc干预后,GAG、CS、KS、HA含量增加,表明sIL-13Rα2-Fc具有减轻椎间盘退变的治疗作用。
胶原蛋白是椎间盘的主要ECM成分,Ⅰ型和Ⅱ型胶原约占椎间盘胶原的70%[32],在生理状态下Ⅱ型胶原纤维比Ⅰ型原纤维含水量多 40%~90%[27-28]。在椎间盘退变过程中,组织中的胶原蛋白总量没有明显变化,但是胶原蛋白组成有一定的变化:Ⅰ型胶原含量不断增加,Ⅱ型胶原蛋白含量进一步减少,从而改变了椎间盘的生理特征和生物力学,使其无法发挥正常的生理功能。周旭等研究发现,椎间盘退变和纤维化期间Ⅰ型胶原蛋白的合成增加,而Ⅱ型胶原蛋白发生变性,二者比例发生了失衡[29-30]。在本研究中将sIL-13Rα2-Fc注射入大鼠椎间盘损伤部位,并使用RT-PCR检测Ⅰ型和Ⅱ型胶原蛋白mRNA表达的变化,结果表明sIL-13Rα2-Fc干预可减少椎间盘组织中Ⅰ型胶原mRNA的表达并增加Ⅱ型胶原mRNA的表达,差异存在统计学意义。同时,Western blot结果显示,IL-13Rα2-Fc干预增加了Ⅱ型胶原蛋白水平,降低了Ⅰ型胶原蛋白的水平,并呈时间浓度依赖性。表明sIL-13Rα2-Fc能够增加Ⅱ型胶原蛋白,降低Ⅰ型胶原蛋白,可减缓椎间盘退行性变,浓度越高,时间越长,治疗效果越好。
综上所述,IL-13抑制剂sIL-13Rα2-Fc对椎间盘退行性变进行干预,可以有效增加椎间盘细胞外基质含量和Ⅱ型胶原蛋白含量,减轻椎间盘组织纤维化,减轻组织结构损伤,对椎间盘退变有一定的治疗作用。此研究也存在一定的局限性:基于针刺法损伤建立的大鼠椎间盘退行性变化的模型。然而人类椎间盘退行性改变是复杂的病理生理过程,本造模方法也不能完美地复制这种临床人体病理变化,在选择合适的动物和造模方法时,还应不断优化使之更加接近人类椎间盘退变的自然演进进程。另外本次研究只证明了白介素13信号通路与大鼠椎间盘退变的关系及其作用,后续将在分子水平对sIL-13Rα2-Fc对椎间盘退行性变的作用机制进行研究。

