植物精油对铜绿假单胞菌群体感应系统的抑制作用研究进展
曾桃花, 李文茹, 谢小保, 施庆珊, 张建设
1.广东省科学院微生物研究所,华南应用微生物国家重点实验室, 广东省菌种保藏与应用重点实验室,广州 510070;2.浙江海洋大学,国家海洋设施养殖工程技术研究中心,浙江 舟山 316022
铜绿假单胞菌(Pseudomonasaeruginosa, PA)是一种革兰氏阴性条件致病菌,极易引起院内感染,PA已对多种抗菌药物产生耐药性,其防治难度逐渐增大[1]。群体感应(quorum sensing, QS)系统是一种细菌细胞与细胞间的通讯系统,当细菌种群密度达到一定阈值时,能够向环境中释放特定的信号分子,表现出单一细胞无法完成的一系列生理功能与行为,如毒素的分泌、生物发光、生物被膜的形成等[2]。PA的外毒素A、弹性蛋白酶、胞外蛋白酶、绿脓菌素、鼠李糖脂等众多毒力因子的产生都受到其QS系统的调控作用,抑制PA的QS系统可下调其毒力基因的表达和毒力因子的产生,达到PA防治目的[3-4]。同时,研究发现,群体感应抑制剂(quorum sensing inhibitors, QSI)轻微抑制或不抑制细菌的生长,不会给耐药菌提供有利的选择压力,因此,QSI有望成为弥补传统抗生素的一种新型抗菌药物[5]。
QS最早发现于1965年,肺炎双球菌(Pneumococcus)分泌的一种多肽分子(第一个被发现的QS信号分子)能促进其对外源DNA的吸收[6]。随后,于1970年发现海洋细菌费氏弧菌(Vibriofischeri)的发光受QS的调控,而且生物发光量与细菌密度成正比[7]。同时,在研究费氏弧菌发光机制时,研究人员提出了LuxI/LuxR QS系统,其中luxI负责编码合成N-3-oxohexanoyl-L-homoserine lactone(3OC6-HSL)信号分子合成酶LuxI,3OC6-HSL是一种N-酰基高丝氨酸内酯分子(N-acyl homoserine lactone,简称AHL),luxR负责编码合成信号分子受体蛋白LuxR[8]。直到1994年,Fuqua等[9]根据费氏弧菌、哈维氏弧菌(Vibrioharveyi)、PA等的密度依赖现象,正式提出了QS这一概念。之后的20多年,在多种微生物中也发现了QS现象,对QS系统和信号分子也展开了研究。QS作用效应和作用机制以及QSI也被广泛研究,但是QS在实际应用方面的研究较少。
目前,对PA的QS系统的研究已经比较透彻,也发现多种化合物对PA有QS抑制活性[10-11]。植物精油具有抗菌活性、抗病毒能力且安全低毒,是比较理想的天然QSI[12-13]。研究发现,大蒜(Alliumsativum)[4]、丁香(Syzygiumaromaticum)[14]、茶树(Camelliasinensis)[15]等植物精油及其主要成分都能抑制PA的QS系统。基于此,本文梳理了铜绿假单胞菌QS系统的组成及其级联调控关系,简要介绍了植物精油的QS抑制机制和抑制活性,并重点综述了萜烯类化合物、芳香族化合物、脂肪族化合物、含硫含氮化合物4类精油化合物对铜绿假单胞菌QS系统抑制作用的研究进展,以期为天然QSI的筛选和QS抑制机制的研究提供参考。
1 铜绿假单胞菌的群体感应系统
QS现象主要存在于细菌中[16],在少数真菌[17]、病毒[18]中也有所发现。PA是革兰氏阴性菌QS研究的模式菌株,对其QS系统、信号分子的研究都已较为透彻,但是对于该菌的QS调控机制的研究还不够系统和完善[8]。PA环境适应性很强,其中约10%的基因参与包括QS在内的调控作用[3]。大多数毒力因子,如绿脓菌素、弹性蛋白酶、群集运动(swarming motility)和生物被膜的形成都受其QS系统基因和相关毒力基因调控[4]。PA至少包括3种QS系统:las、rhl、pqs系统,并呈现出级联调控的特点[10]。
1.1 las系统
随着LuxI/LuxR QS系统的提出,科学家开始探索luxI和luxR的同源基因。几乎在LuxI/LuxR QS系统提出的同时,就发现了PA的lasR与luxR具有同源性,lasR负责编码产生信号分子受体蛋白LasR,LasR与LuxR的氨基酸序列相似性也高达27%[19]。后来又证明lasI是luxI的同源基因,负责编码PA信号分子(Pseudomonasaeruginosaautoinducer,PAI)的合成[20],并发现PAI为一种AHL分子,其化学名称为N-(3-oxododecanoyl)-L-homoserine lactone(3OC12-HSL),当3OC12-HSL积累到一定浓度时,LasR与3OC12-HSL结合形成调节子LasR/3OC12-HSL,促进毒力因子的表达[21]。研究发现las系统能调控外毒素A、蛋白酶LasA、弹性蛋白酶LasB和碱性蛋白酶的产生,还能通过诱导上皮细胞的凋亡等途径减弱免疫缺陷患者的免疫应答[3]。
1.2 rhl系统
PA弹性蛋白酶LasB的表达需要LasR的激活[19]。同时向携带lasR质粒的大肠杆菌和携带lasR质粒的PA ΔlasR突变体添加外源PAI,都可以激活lasB表达,但激活PA的lasB表达所需的PAI浓度大约为大肠杆菌的200倍,远远大于正常浓度[21-22]。因此猜测PA中存在其他诱导因子,促进lasB的表达。经鉴定,PA中确实存在3OC12-HSL之外的PAI,其化学名称为N-butyryl-L-homoserine lactone(C4-HSL),和3OC12-HSL一样为AHL分子,这也是在PA中发现的第2个AHL信号分子[22]。C4-HSL不能直接与LasR作用,而且lasI也不能诱导C4-HSL的产生,因此推测PA中还存在其他QS系统,与las系统共同调控弹性蛋白酶的表达[22]。经研究发现,rhlABR基因簇编码的RhlR是LuxR和LasR的同源蛋白,rhlI是luxI的另一个同源基因,而且rhlI参与了C4-HSL的合成[23-24]。并证明RhlR蛋白能与信号分子C4-HSL作用形成复合物RhlR/C4-HSL,该复合物能调控弹性蛋白酶、鼠李糖脂、绿脓菌素的合成[24]。因此,rhl系统被证明是PA的另一个QS系统,并且与las系统是相互联系的。
1.3 pqs系统
pqs系统的发现也与弹性蛋白酶的研究有关。弹性蛋白酶LasB的表达是由las和rhl系统共同调控的,无论是lasI还是rhlI突变,lasB的表达量都会大幅降低。但在ΔlasR突变体中加入野生型铜绿假单胞菌PAO1的上清液,发现lasB表达显著升高,而单独加入3OC12-HSL、C4-HSL或者加入二者混合物都不能产生类似结果,这些现象表明PA中还存在第3种信号分子刺激弹性蛋白酶的产生[25]。经分析鉴定该信号分子化学名称为2-heptyl-3-hydroxy-4-quinolone,属于4-喹诺酮类化合物,Pesci等[25]把它定义为Pseudomonasquinolone signal(PQS)。随着PQS信号分子的发现,PQS的合成酶和受体蛋白的相关研究逐渐展开。之后发现铜绿假单胞菌PA14菌株的ΔmvfR(后来改名为pqsR)突变体对小鼠和拟南芥的毒力作用远远小于野生型PA14,pqsR编码的LysR家族转录调控因子PqsR不仅能促进信号分子(3OC12-HSL和PQS)、毒力因子(弹性蛋白酶和磷脂酶)的产生以及生物被膜的形成,还能通过参与phnAB操纵子的表达调节吩嗪的合成,证明PqsR调节蛋白参与PA的QS网络调控[26]。研究发现phnAB区域的多个基因突变都能减少PQS的产量,基于该区域的一个五基因操纵子pqsABCDE,在pqsR不变的条件下,对phnAB区域突变体进行基因回补实验,结果表明pqsABCD是合成PQS的必需基因,pqsE参与绿脓菌素的形成,但不是PQS合成的必需基因[27]。而且还证明lasR突变能大量减少pqsH的转录量,因此,pqsABCD、phnAB和pqsH都有编码PQS合成的功能[27]。
1.4 iqs系统
在PA临床分离菌株中,经常检测到ΔlasI和ΔlasR突变体,但这些突变体还能产生绿脓菌素等毒力因子,而且在磷酸盐耗竭胁迫条件下rhl系统、pqs系统的表达都呈现出phoB依赖性[10]。根据这些现象,Dekimpe等[28]在2009年提出PA允许另一个QS系统接替克服其中一个系统的缺陷。2013年,Lee等[29]证实PA中确实存在一个集成型QS系统,能将环境压力信号与QS网络相连接来增强环境适应能力,并综述了此系统与PA的其他QS系统之间的关系[10]。该系统的QS信号分子是2-(2-hydroxyphenyl)-thiazole-4-carbaldehyde(C10H7O2NS),命名为IQS,是由一个非核糖体肽合成酶基因簇ambBCDE参与合成的;干扰IQS能减少C4-HSL和PQS的产生,但对3OC12-HSL没有影响,因而推测是由las系统和phoB依赖方式共同调控IQS的合成[29]。敲除ambB,136个PA基因的转录表达发生了改变,下调了lasA、lasB、phzM、hcnA、hcnB、pchABCDREFG、rhlA和rhlB等基因的表达,同时,弹性蛋白酶、绿脓菌素、氰化氢、铜绿假单胞菌螯铁蛋白、鼠李糖脂的产量也出现下降现象,与基因表达下调呈现一致性[29]。然而,2019年,Ahator等[30]提出AmbBCDE酶负责抗代谢物(L-2-amino-4-methoxy-trans-3-butenoic acid)的合成,不负责合成IQS,且IQS可能是铜绿假单胞菌螯铁蛋白的前体等想法,对iqs系统的存在提出异议。之后,Cornelis[31]明确提出IQS作为PA群体感应信号分子的结论是错误的,IQS的结构与铜绿醛(aeruginaldehyde)的结构相同,是铜绿假单胞菌螯铁蛋白生物合成或降解的一种副产物,ambABCDE也不参与IQS的合成。综上所述,iqs系统还存在许多疑惑,例如IQS受体的结构、AmbBCDE酶合成产物在IQS中的作用及其与其他系统的联系等,都有待进一步研究。
1.5 铜绿假单胞菌群体感应系统的级联调控
研究发现,LasR和3OC12-HSL能激活rhlR的转录,3OC12-HSL能阻止C4-HSL与RhlR结合,证明las系统能够从转录和翻译后2个水平调控RhlR蛋白[32]。在ΔlasR突变体(ΔlasR突变体不产生PQS)中分别插入携带rhlI、lasI、rhlR、lasR基因的质粒,然后加入等量PQS,发现含rhlI基因的重组质粒表达显著上调,含rhlR和lasR的重组质粒表达量有所上升,而含lasI的重组质粒表达仅轻微上调[33]。PQS大力上调rhl系统,而对las系统作用不大,说明pqs系统很可能起连接las系统和rhl系统的作用。由此推测,las系统位于调控网络的顶层,正向调控rhl和pqs系统,pqs系统位于中间层级,起连接作用,正向调控rhl系统,并受rhl系统的反向调节[10]。
2 植物精油对细菌群体感应的抑制效应
2.1 植物精油的化学组分和生物学活性
QSI来源广泛,可分为人工合成化合物和天然产物2大类,而天然QSI又可以分为植物源类、动物源类和微生物源类[11]。植物精油,又称为精油或香精油(essential oil,植物学用途)、挥发油(volatile oil,化学和医药用途)、芳香油(aromatic oil,商业用途),是从植物的花、芽、种子、叶、枝、皮、根、树胶和果实中提取的芳香味油性液体[34]。植物精油的成分复杂,一种精油一般由几十种到几百种化合物组成,主要为萜烯类化合物、芳香族化合物、脂肪族化合物、含硫含氮化合物等小分子简单化合物[34]。通常,每种精油只有2~3种相对高浓度的主要成分,占20%~95%,其他成分都是微量存在的[35]。植物精油具有抗细菌、抗真菌、抗病毒、抗寄生虫、抗氧化、抗癌等生物学活性,而且这些特性通常都是由精油的主要成分决定的[36]。目前,已知的精油大约有3 000种,其中约300种具有商业用途,根据其特性,主要用在化妆品、食品添加剂、医疗、害虫防治等方面[36]。
2.2 植物精油的群体感应抑制机制
植物在与环境中细菌的长期互作过程中,进化出了一些抑制细菌QS的机制,其产生的QSI可以用来控制病原细菌,为激活防御机制争取时间,避免长时间暴露在病原细菌的侵染中[37]。根据QS系统的组成特点和作用机制,QSI可以在信号分子、信号分子合成酶、信号分子受体3个靶点作用以干扰致病菌的QS系统[38]。目前已经发现了几种干扰机制(相关QSI化学结构式见图1):①QSI为信号分子类似物,竞争性结合信号分子受体蛋白,阻止信号分子与受体蛋白结合,如丁香酚、6-姜酚和反式茴香醚[39-41];②QSI通过降解信号分子或减少信号分子的产生抑制信号分子的活性,如丁香酚、d-柠檬烯和法尼醇[42-44];③QSI降低信号分子合成酶或信号分子受体蛋白的活性,阻止QS通路,如芳樟醇和法尼醇[44-45]。由上可知植物精油可由多种机制共同干扰病原菌的QS系统。在对QS系统有了一定了解之后,QSI的筛选和合成成为了研究热点。Rasmussen等[38]提出理想的QSI是一种稳定的低分子量化合物,并对信号分子受体蛋白(LuxR同系物)表现出高度特异性;能显著下调QS相关毒力基因的表达,但对宿主无毒副作用,且不会在宿主的新陈代谢作用下被分解;此外,理想的QSI不会干扰细菌的基本生命过程,如RNA和蛋白质的合成等。根据植物精油分子量小、低毒以及高抗QS等特性可知,植物精油是一种天然理想的QSI。
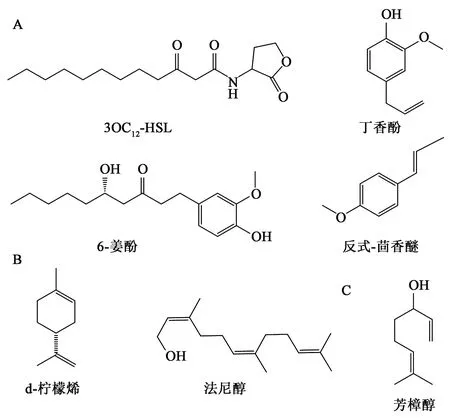
A:信号分子3OC12-HSL及其类似物丁香酚、6-姜酚和反式茴香醚的化学结构;B:d-柠檬烯和法尼醇的化学结构;C:芳樟醇的化学结构
2.3 植物精油的群体感应抑制活性
已有研究表明,多种植物精油及其成分具有细菌QS抑制活性。芳樟醇(3,7-二甲基-1,6-辛二烯-3-醇)是一种萜烯醇,全球超过200种植物精油含有芳樟醇,大量存在于芳樟(Cinnamomumcamphora)叶油、芫荽(Coriandrumsativum)油、薰衣草(Lavandulaangustifolia)油等约20种植物精油中[46]。研究表明,不同来源的芳樟醇均具有抗QS活性:从芫荽中提取的芳樟醇能抑制鲍曼不动杆菌(Acinetobacterbaumannii)生物被膜的形成,而且可以分散已形成的生物被膜[47];苦香树(CascarillaCrotonniveous)皮油和蜡菊(Helichrysum)精油及它们的成分芳樟醇在不影响白色念珠菌(Candidaalbicans)浮游细胞生长的情况下,能抑制其菌丝转化,减少生物被膜的形成,并且能降低白色念珠菌对秀丽隐杆线虫(Caenorhabditiselegans)的毒力[48];芳樟叶油的芳樟醇含量高达51.57%,芳樟醇对紫色色杆菌(Chromobacteriumviolaceum)紫色杆菌素产量的最大抑制率为63%,对其生物被膜的最大抑制率为77.64%,并且能下调AHL合成基因cviI、转录调节基因cviR的表达[45];研究人员也会直接从市场上购买精油化合物来研究其QS作用,研究发现亚抑菌浓度(sub-minimal inhibitory concentration,sub-MIC)的芳樟醇能破坏哈维氏弧菌60%~70%的成熟生物被膜,也能减弱其运动能力[49]。芳樟醇不仅能抑制细菌的QS系统,还具有杀菌作用,芳樟醇可以破环PA的生物被膜,导致核酸外泄,杀灭细菌[50]。植物精油及其化合物也用来与抗生素联合使用,协同抑菌,芫荽精油及其主要成分芳樟醇与抗生素联合使用,对革兰氏阳性菌金黄色葡萄球菌(Staphylococcusaureus)、表皮葡萄球菌(Staphylococcusepidermidis)和革兰氏阴性菌PA、大肠杆菌的抑菌效果都显著增加,而且能极大降低抗生素的MIC和病原菌对抗生素的耐药性[51]。
茶树精油是从互叶白千层(MelaleucaalternifoliaCheel)中提取的一种精油,常用来杀菌消炎,在医药、化妆品、香料等行业都得到广泛应用[15]。茶树精油约由100种不同活性成分组成,4-萜烯醇[4-甲基-1-(1-甲基乙基)-3-环己烯-1-醇]是其主要成分之一,低浓度的茶树精油及4-萜烯醇都能抑制紫色色杆菌的紫色杆菌素产生,并抑制金黄色葡萄球菌生物被膜的形成和PAO1的群集运动[15]。薄荷(Menthapiperita)精油能干扰嗜水气单胞菌(Aeromonashydrophila)、PA和紫色色杆菌的AHL依赖的毒力因子产生,其主要成分薄荷醇(2-异丙基-5-甲基环己醇)发挥重要作用[52]。薄荷醇是一种环类单萜,主要用于生产固体香料、清凉剂和止痛剂,香茅醛(3,7-二甲基-6-辛烯醛)或百里酚(5-甲基-2-异丙基苯酚)都可以合成薄荷醇[53]。此外,大蒜[4]、丁香[39]、牛至(Origanumvulgare)[54]、柠檬草(Cymbopogoncitratus)[55]、百里香(Thymusmongolicus)[56]等精油的化合物都可作为QSI,可在一定程度上抑制病原菌的毒力。
3 植物精油活性成分对铜绿假单胞菌群体感应系统抑制作用研究进展
3.1 萜烯类化合物
分子中含有双键的萜类化合物称为萜烯类化合物,萜烯类化合物广泛存在于植物体内。葡萄柚(Citrusparadisi)精油赋予食物风味与芳香,可作为食品的抗菌添加剂,Luciardi等[43]采用冷压法和水蒸气蒸馏法得到了2种葡萄柚精油,主要成分都为d-柠檬烯[1-甲基-4-(1-甲基乙烯基)环己烯]。随后,以2株PA菌株为受试菌株(一株为铜绿假单胞菌ATCC 27853,另一株从食物中毒患者体内分离而来),比较葡萄柚精油及其主要成分d-柠檬烯对PA的QS抑制效果,研究发现葡萄柚精油和d-柠檬烯都可以抑制PA生物被膜的形成,减弱弹性蛋白酶的活性,并减少AHL的产量,而且d-柠檬烯的抑制作用仅略低于葡萄柚精油,说明主要成分起主导作用,次要成分起协同作用[43]。此结论与前人的研究结果一致,Noumi等[15]发现茶树精油对PAO1群集运动的抑制率为33.33%,而其主要成分4-萜烯醇的抑制率为25%,接近于茶树精油,证明精油主要成分的QS抑制作用很强。薄荷精油及其主要成分薄荷醇也可以干扰PAO1的las和pqs系统,达到QS抑制目的[52]。
本课题组还发现了另一种萜烯类活性化合物,法尼醇(3,7,11-三甲基-2,6,10-十二烷三烯-1-醇),对PAO1具有QS抑制活性。法尼醇能够抑制pqs系统中PQS信号分子合成酶基因pqsABCDE和pqsH的转录和蛋白表达,但是不影响PQS受体编码基因pqsR的转录和蛋白表达,也不影响las和rhl系统中关键基因的表达。而且法尼醇不会抑制PA的生长,但却抑制了该菌PQS信号分子的合成,同时抑制了该菌绿脓菌素的产生[44]。此外,本课题组目前正在开展香茅(Cymbopogonnardus)活性化合物对PA的QS抑制效应与机制研究,前期分析了香茅精油的主要成分,并研究了其抗菌作用,发现香茅精油具有一定的抗真菌和抗细菌作用[57]。香茅精油主要为亚香茅植物的提取物,包括香茅醛、香叶醇(3,7-二甲基-2,6-辛二烯-1-醇)和香茅醇(3,7-二甲基-6-辛烯-1-醇)3种主要成分,均为萜烯类化合物,具有抗菌、抗氧化、驱蚊虫和伤口愈合等功效,因高效、低毒、高客户满意度被美国国家环境保护局注册为杀虫剂[58]。有研究报道亚香茅等多种哥伦比亚植物均具有QS抑制活性[59]。目前,香茅精油在QS方面的研究比较少,而且几乎都是QS抑制效应方面的研究,如香茅精油能抑制大肠杆菌[60]、金黄色葡萄球菌[61]、白色念珠菌[62]生物被膜的形成,但其抑制机理尚不明确,暂无关于PA的QS方面的研究。本课题组的研究表明了香茅醛、香叶醇、香茅醇3种香茅化合物对PA均有QS抑制活性,并且初步研究了它们的QS抑制机理。
3.2 芳香族化合物
芳香族化合物是一类具有芳环结构的化合物,是植物精油中的第二大类化合物,仅次于蒎烯类。丁香精油香气浓郁持久、安全性高、有抗菌作用,其主要成分丁香酚(1-烯丙基-3-甲氧基-4-羟基苯)已被中国、美国、欧盟等国家认定为食品防腐剂[63]。起初,研究人员发现丁香精油能抑制PA胞外蛋白酶、几丁质酶、绿脓菌素、胞外多糖等毒力因子产生以及减弱其泳动(swimming motility)能力和生物被膜的形成,并做了些简单的表型研究[14,64-65]。接着,开始尝试探索丁香精油的QS抑制机制,发现丁香精油能从以下几个方面抑制PA的QS系统。①阻止信号分子与受体结合。丁香酚通过疏水作用与LasR的关键氨基酸残基Arg61和Tyr41的氢键结合,阻止3OC12-HSL和受体LasR相互作用[39]。②下调QS系统相关基因的转录水平。丁香精油能抑制pqsA的转录,并通过猪皮肤体外研究实验证实了丁香精油能抑制生物被膜形成,促进已形成的生物被膜解聚[39]。③抑制信号分子的数量。之后又发现丁香精油能减少参与PA QS的AHL信号分子的数量,并且用PAO1菌株感染秀丽隐杆线虫,建立了动物发病模型,发现丁香精油能够减弱PAO1对秀丽隐杆线虫的毒力,降低其死亡率[42],以上丁香精油QS抑制作用研究所用PA菌株,除从临床分离得到的50株外[14],其他都为实验室保藏的PAO1菌株。
生姜(Zingiberofficinale)可食用,也可入药,具有驱寒、止吐、解毒、抗炎、抗氧化、抗癌、杀菌等功效,应用广泛[66]。6-姜酚[(S)-5-羟基-1-(4-羟基-3-甲氧苯基)-3-癸酮]是姜根茎油的主要活性成分之一,具有抗炎、强心、镇痛等作用[66]。研究表明6-姜酚也能抗QS,在低浓度下能抑制铜绿假单胞菌PA14生物被膜的形成,对其胞外蛋白酶、绿脓菌素、鼠李糖脂等毒力因子的抑制率分别达到19%~53%、21%~43%、36%~60%,6-姜酚也能减弱PA14对小鼠的毒害作用,使小鼠的存活率增加50%~70%[40]。研究发现6-姜酚的结构与信号分子3OC12-HSL类似,能和3OC12-HSL竞争性与LasR结合,减少3OC12-HSL的结合位点,用计算机进行分子对接分析,证实了6-姜酚能与LasR通过氢键和疏水相互作用发生分子结合[40]。6-姜酚类似物能通过破坏PA14的QS系统来缓解反渗透过程中的生物污染,但不会破坏反渗透膜的形态和化学结构[67]。
同丁香酚、6-姜酚一样,反式茴香醚[(E)-1-甲氧基-4-(1-丙烯基)苯][41]、反式肉桂醛[(E)-3-苯基-2-丙烯醛][1]和香芹酚(5-异丙基-2-甲基苯酚)[68]都是大量存在于植物精油中的芳香族化合物,而且都对PA表现出一定的QS抑制作用。反式茴香醚是茴芹(Pimpinellaanisum)精油的主要成分,常用来调味,经分子对接分析和蛋白质-配体相互作用研究,发现反式茴香醚与LasR的氢键作用方式类似于3OC12-HSL与LasR,反式茴香醚通过阻止信号分子与LasR的结合,阻断PAO1的QS系统[41]。反式肉桂醛是肉桂(Cinnamomumcassia)精油的主要活性化合物之一,低浓度的反式肉桂醛使PAO1的lasI和lasR表达水平分别下调了13和7倍,使胞外蛋白酶、弹性蛋白酶和绿脓菌素的产量分别下降了65%、22%和32%[1]。肉桂精油及其主要成分肉桂醛都具有抗菌作用,可作牙膏用香精,低浓度的肉桂精油也能减少PAO1毒力因子的产生,但是高浓度的肉桂精油对PAO1具有杀菌作用[69]。香芹酚存在于牛至等精油中,能减少铜绿假单胞菌ATCC 10154生物被膜的形成和绿脓菌素的产生[68]。
3.3 脂肪族化合物
脂肪族化合物是几乎存在于所有精油中的小分子化合物,但含量较少,并非精油的主要成分[34]。肉豆蔻酸(十四酸)是一种以甘油酯形式存在于豆蔻(AlpiniakatsumadaiHayata)油、棕榈(ElaeisguineensisJacq.)油、椰子(CocosnuciferaL.)油等植物油脂中的脂肪族化合物,研究发现肉豆蔻酸能抑制PA的QS活性[70]。用PA感染洋葱鳞茎伤口组织,发现相对于未被感染的组织,被感染的洋葱组织中缺少泛酸内酯、4,5-二氢-4,5-二甲基呋喃-2(3H)-1、肉豆蔻酸和亚油酸4种化合物[70]。并证明了肉豆蔻酸和泛酸内酯在不影响PA生长的情况下,能抑制毒力因子绿脓菌素、胞外蛋白酶、脂肪酶、果胶酶的活性[70]。
3.4 含硫含氮化合物
含硫含氮化合物存在于具有辛辣刺激的植物精油中。大蒜素(allicin),是从大蒜中提取的一种含硫化合物,该化合物不稳定。大蒜素通过气质联用检测,主要成分包括二烯丙基三硫醚和二烯丙基二硫醚(diallyl disulfide, DADS)等,具有抗癌、抗炎、抗菌、抗氧化等多种生物活性[71]。研究发现,大蒜素通过抑制PAO1的rhl和pqs系统,减少其弹性蛋白酶、绿脓菌素、铜绿假单胞菌铁载体和鼠李糖脂等QS相关毒力因子的产生[71]。本课题组研究发现,大蒜活性化合物DADS能够抑制PAO1 QS系统中关键基因的转录和蛋白表达,包括las系统中的lasI和lasR,rhl系统中的rhlI和rhlR,以及pqs系统中的pqsABCDE、pqsH和pqsR[4,72]。而且,低浓度的DADS不会影响PAO1的生长,但能够抑制该菌QS系统调控的毒力因子的产生,如抑制该菌弹性蛋白酶和绿脓菌素的产量,抑制生物被膜的形成,抑制该菌的群集运动等,而且DADS对这些毒力因子的抑制作用呈现剂量依赖关系[4]。
综上所述,萜烯类化合物、芳香族化合物、脂肪族化合物、含硫含氮化合物4类化合物抑制PA QS系统的靶点和作用机制不尽相同,表1综合了这4种化合物对PA QS系统的抑制作用。
4 展望
细菌的QS研究,从前期探索到概念提出,从信号分子发现到系统组成结构研究,从毒力调控机制探索到QSI应用,到如今已将近半个世纪。PA是QS研究的模式菌株之一,公认已经发现了las、rhl、和pqs3种PA的QS系统。las、rhl、pqs的发现和研究都发生在20世纪90年代末到21世纪初,对其QS系统的结构和组成、各系统的层级关系、以及相关毒力调控基因的研究都已经比较透彻。iqs系统于2013年才正式提出,相关研究较少,还存在许多疑惑和质疑,有待进一步深入研究。PA的众多毒力因子,如绿脓菌素、弹性蛋白酶、鼠李糖脂等的产生以及生物被膜的形成和群集运动都受到其QS系统调控。由于抗生素的大量使用,PA对多种抗生素产生了耐药性。QSI减弱致病菌毒力的同时几乎不抑制细菌生长,极大减少了耐药性问题,对致病菌的防御和治疗有极大意义。
研究发现多种化合物都可以抑制细菌QS,但是天然的理想QSI比较稀少。根据植物活性化合物分子量小、低毒等特性,植物精油QSI的研究受到广泛关注。研究发现大蒜精油、丁香精油等几十种精油及其提取物都能抑制PA的毒性。植物精油具有成为理想群体感应抑制剂的潜力,多种精油都有不错的QS抑制活性,但是QS抑制机制尚不清晰。找出植物精油的群体感应作用机制,大批量筛选具有QS抑制活性的植物活性化合物是亟待解决的问题,对解决PA等致病菌感染问题意义深远。

