数字PCR在食源性致病菌检测中的应用进展
卢海强, 焦新雅,, 吴思源, 王娅丽, 刘璐, 程书梅, 张晓, 苏晓峰*
1.河北农业大学食品科技学院,河北 保定 071001;2.中国农业科学院生物技术研究所,北京 100081;3.长春理工大学生命科学技术学院,长春 130022
随着生活水平的逐步提高,食品安全问题受到了越来越多的重视,而食源性疾病是影响食品安全的主要因素之一。食源性疾病主要是由食源性致病菌所引起的,会危害人们的身体健康,给世界卫生组织带来沉重负担,严重影响社会经济的发展。全世界每年约有1.5亿的腹泻病患者,其中由致病性微生物引起的占70%,而由食源性致病菌引起的腹泻病总数已达到致病性微生物的46.4%,占据主导地位[1]。因此,为确保食品安全,开发更高效、更灵敏和更经济的检测方法尤为重要。目前,用于检测致病菌的方法主要有分子生物学检测技术[2]、高光谱成像技术[3]、激光散射技术[4]和酶联免疫吸附检测法(ELISA)[5]等。近年来,分子生物学检测技术中的PCR技术受到了广泛关注。
到目前为止,PCR技术已经发展到了第三代。第一代PCR是传统PCR(endpoint PCR),即通过扩增获得更多的目的片段;第二代PCR是实时荧光定量PCR(real-time PCR,qPCR),即在扩增过程中对荧光信号进行实时检测;第三代PCR是数字PCR(digital PCR,dPCR),即针对单分子进行扩增的检测技术。数字PCR具有精准度高、特异性强、灵敏性好和能进行绝对定量等优点,目前已得到了广泛应用,尤其在病毒载量[6]、产前诊断[7]、癌症诊断检测[8]、转基因成分检测[9]和掺假成分检测[10]等方面。本文就dPCR在食源性致病菌检测中的研究进展进行了综述,以期为食源性致病菌的检测研究提供参考。
1 dPCR技术概述
dPCR是基于传统PCR基础上对核酸分子进行绝对定量的技术。早在1992年,Sykes等[11]第一次在传统PCR基础上提出三个重要原则:①对PCR反应物进行有限稀释;②只需观察有无荧光信号;③通过泊松分布进行统计处理,为今后dPCR的发展奠定了基础。1997年,Olga等[12]利用玻璃毛细管作为载体进行PCR反应,实验结果表明反应体系越小,扩增循环次数越多,TaqMan检测的灵敏度就越高,为日后单分子目标DNA检测应用提供了技术依据。1999年,Dressman[13]第一次正式提出数字PCR的概念,同时阐述其具有诸多优势。2003年,Vogelstein等[14]用BEAMing技术以及流式技术结合dPCR,通过磁珠克隆DNA。BEAMing技术是基于小珠、乳浊液、扩增和磁性这四个主要组分来构建的,将单分子目标DNA连接到磁珠上,然后对小珠进行荧光标记,并使用流式细胞仪对其进行计数。这项技术不仅能提高实验的灵敏度,可计算基因突变率,而且还降低了实验误差,为未来数字PCR的发展提供了技术依据。2006年,Fluidigm公司发明了第一台基于芯片的dPCR仪。
dPCR基本原理如图1所示,首先将参与扩增的组分分配成数百万个PCR反应,使每个反应中尽可能含有一个模板分子,再对每个反应进行PCR扩增;然后,通过读取荧光信号对反应结果的阴阳性进行判断;最后将判断结果根据泊松分布的原理估计靶分子的拷贝数和浓度[16]。在绝对定量时,dPCR不需要建立标准曲线,也不需要依赖标准品,因此实验的工作量较qPCR更少,精准度更高,同时dPCR还具有不易受抑制剂影响、对样品需求量很低、能很好地对稀有突变进行检测等优点[17]。目前,dPCR可基于分液方式的不同,分为微流体数字PCR(microfluidic digital PCR,mdPCR)、微滴数字PCR(droplet digital PCR,ddPCR)和芯片数字PCR(chip digital PCR,cdPCR)[18]。
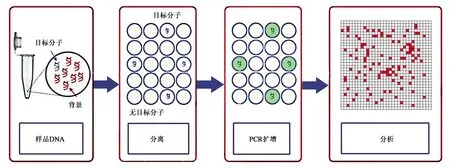
图1 dPCR基本原理[15]
2 dPCR在食源性致病微生物检测中的应用
引起食源性疾病的致病微生物种类有细菌、真菌和病毒,其中细菌是最主要的食源性致病微生物。这些食源性致病菌不仅污染食物,使食物腐败变质,还会造成间接感染,如果食用的食物中含有过量的食源性致病菌,可能会引发肾脏疾病、肠道疾病或视力障碍,甚至致命。常见的食源性致病菌包括空肠弯曲菌、沙门氏菌、蜡状芽孢杆菌、大肠杆菌、副溶血性弧菌和单核细胞增生李斯特氏菌等。此外,细菌和真菌产生的毒素是引起食源性疾病的主要原因,这些毒素在食品生产加工过程中也能保持活性,生的食物或即食的海鲜,都可能会被污染。
2.1 dPCR检测食品中大肠杆菌
大肠埃希氏菌(E.coli)通常被称为大肠杆菌,是一种兼性厌氧革兰氏阴性菌。大多数大肠杆菌不具有致病性,具有致病性的大肠杆菌根据它们的毒力机制可分为:肠致病性大肠杆菌(enteropathogenicE.coli, EPEC)、产肠毒素性大肠杆菌(enterotoxigenicE.coli, ETEC)、肠侵袭性大肠杆菌(enteroinvasiveE.coli, EIEC)、肠聚集性大肠杆菌(enteroaggregativeE.coli, EAEC)、肠出血性大肠杆菌(enterohemorrhagicE.coli, EHEC)、产志贺毒素大肠杆菌(shiga-toxigenicE.coli, STEC)、肠粘附性大肠杆菌(enteroadhesiveE.coli, DAEC)和肠聚集性出血性大肠杆菌(enteroaggregative haemorrhagicE.coli,EAHEC)。致病性大肠杆菌会引起胃肠道疾病、泌尿系感染、脑膜炎、菌血症、腹泻和败血症等疾病,一般存在于未经巴氏灭菌的牛奶、牛肉、蔬菜和鸡蛋等食品中。高达10%~15%的STEC感染患者会发展成溶血性尿毒症综合征(hemolytic uremic syndrome, HUS)[19],每年约有280万例由STEC引起的感染病例[20]。EHEC中最常见的致病性菌株是O157∶H7和六大非O157血清型(O26∶H11,O45∶H2,O103∶H2,O111∶H8,O121∶H19和O145∶H28)。在美国,每年约有23万人会感染EHEC,约有73 000人是由血清型O157∶H7引起的[21]。
2.1.1dPCR检测食品中STEC利用大肠杆菌纯培养物、添加培养物的牛粪、添加培养物的碎牛肉以及自然脱落的牛粪样品,Liu等[22]对产志贺毒素的大肠杆菌血清组进行检测。结果表明,与标准平板计数法相比,dPCR技术用时更少,通常一天内就可完成。同时证实了使用完整的细菌细胞作为dPCR模板和使用适当的样品进行稀释是dPCR检测成功的关键所在。Capobianco等[23]研究表明,DD-check检测方法不仅可以检测志贺毒素(Shiga toxin,stx)和紧密黏附素基因(intimin gene,eae)的存在,还可以评估这些基因之间的连锁性。
2.1.2dPCR检测食品中EHECMcmahon等[24]使用MuSIC ddPCR的方法检测EHEC,此方法利用ddPCR技术中微滴包裹完整单个细菌的特性以及分析stx和eae基因同时出现的连锁性以达到检测目的。该实验从食品(碎牛肉、碎猪肉和绿叶蔬菜)中提取增菌液,并对增菌液中的EHEC进行检测。在观察正负液滴荧光振幅强度时,检测stx的最佳温度在54~57 ℃之间,检测eae的最佳温度在56~59 ℃之间。结果表明,MUSIC ddPCR适用于食品增菌液的筛选,不适合检测stx2基因的stx2f亚型,大大降低了EHEC假阳性的检出率。
2.1.3dPCR检测食品中大肠杆菌O157∶H7 魏咏新等[25]对大肠杆菌O157∶H7纯培养液和经大肠杆菌O157∶H7污染的三文鱼样品进行检测,针对大肠杆菌O157∶H7的特异性单拷贝基因α-溶血素(hlyA)设计了引物探针,并比较了平板计数法、qPCR和ddPCR的定值效果。结果显示该研究建立的ddPCR检测方法对检测食品安全、开展风险评估、应急检测突发公共卫生事件、控制疫情扩散以及提高病原菌检出效率等均有重要意义。为提高灵敏度,Jang等[26]应用荧光图像对包裹不同数量的大肠杆菌O157∶H7和沙门氏菌的微滴进行研究。实验证明,ddPCR检测食源性致病菌具有从单细胞到多细胞水平的准确性和可行性。因此,已有的数据表明,dPCR在快速、灵敏和准确地量化样品中携带的致病菌含量方面具有极大的潜在应用价值。
2.2 dPCR检测食品中沙门氏菌
沙门氏菌(Salmonella)是一种革兰氏阴性细菌,可引起人畜共患病。这种细菌可以污染多种食品,如鸡蛋、水果、肉类、香辛料和蔬菜等,还能引起食物中毒、败血症、胃肠炎和菌血症等症状。据报道全球约有13亿例胃肠炎是由沙门氏菌引起的[27]。在中国,约有80%的食源性疾病是由沙门氏菌造成的[28]。在美国,每年近130万人感染食源性沙门氏菌,有500多人因其致命[29]。鼠伤寒沙门氏菌(Salmonellatyphimurium)是一种能引起致死性败血症的革兰氏阴性菌,在世界范围内,大约三分之一的食源性疾病是由鼠伤寒沙门氏菌引起的[30]。
2.2.1dPCR检测食品中的沙门氏菌赵新等[31]建立了沙门氏菌ddPCR的快速定量检测方法,检测灵敏度可达到102cfu·mL-1,结果证实了使用ddPCR方法检验食品中沙门氏菌具有检测快速、检出率高和操作方便等优点,且更适用于大批量应急预案样品的检测。Shaw等[32]开发了一种基于分子的方法,将基因工程标记到细菌染色体后,直接对微生物进行量化。在沙门氏菌野生型和突变菌株染色体上的无害位点上插入25个碱基对的DNA条形码(DNA条形码序列需要设计成便于使用的高质量探针序列),对每个菌株进行绝对定量,根据数值计算出每个菌株的竞争指数。这项技术提供了可观的敏感性、特异性、准确性和精确度,可以轻松地量化不同细菌群体中的单个菌株,并且可大量适用于所有染色体修饰的有机体,以及降低实验成本。dPCR具有很高的学术地位,但其致病菌检测应用的潜力尚有待深入研究,无论是在优化成本还是检测动态范围方面,均是刚开始商业化开发。随着技术的不断发展,dPCR极有可能成为核酸定量的标准检测方法。
2.2.2dPCR检测食品中鼠伤寒沙门氏菌Wang等[33]为了评估qPCR和ddPCR在实际样品中的应用效果和效率,制备了添加鼠伤寒沙门氏菌的牛奶,用qPCR和ddPCR进行检测:qPCR的LOD为103cfu·mL-1,ddPCR的LOD为102cfu·mL-1,因此ddPCR的检测限较低,具有更高的灵敏度,但动态范围窄。同时,ddPCR预培养时间比qPCR节省2 h,不受PCR抑制剂影响。这些均是传统qPCR无法达到的检测水平。dPCR在未来具有很好的应用前景。
2.3 ddPCR检测食品中金黄色葡萄球菌
金黄色葡萄球菌(Staphylococcusaureus)是一种典型的革兰氏阳性菌,在自然界无处不在,主要存在于生肉(95.5%)、熟肉制品(93.5%)、豆制品(86.7%)和腌制蔬菜(78.1%)。金黄色葡萄球菌可产生多种毒力因子,从而引起脓毒症、骨髓炎、菌血症、心内膜炎和肺炎等疾病。在中国约25%的食源性疾病是由于感染了金黄色葡萄球菌[34]。2000年,日本有13 420人因食用金黄色葡萄球菌污染的乳制品被感染[35]。美国每年约有50万人因金黄色葡萄球菌住院,其中有5万人致命[36]。因此,检测致病性金黄色葡萄球菌对食品安全非常重要。
赵丽青等[37]将叠氮溴化丙锭(propidium monoazide,PMA)与ddPCR技术相结合检测金黄色葡萄球菌活菌。实验结果表明,PMA-ddPCR方法能避免死菌DNA的干扰,并且有很高的灵敏度,因此在实际应用中具有极高的应用价值。周巍等[38]基于ddPCR技术,建立了发酵乳中金黄色葡萄球菌定量检测方法,其检测灵敏度为33 cfu·g-1。实验证明在致病菌的检测中ddPCR技术具有良好的应用前景。Pacocha等[39]用双滴数字PCR(direct droplet digital PCR,dddPCR)检测3种革兰氏阳性细菌(金黄色葡萄球菌、头葡萄球菌和表皮葡萄球菌),通过比较只含有目标菌的样品和含有目标菌以及背景菌稀释度的样品来检测dddPCR的实用性。实验表明,dddPCR对非特异性微生物的抑制作用比qPCR低,当PCR样品中细菌数量过多或生长培养基浓度过高会抑制dddPCR反应。值得一提的是,进行dddPCR检测,不需要提取和纯化DNA,同时对背景细菌的存在有更强的抗干扰能力。这使得这种一体化的dPCR平台在食源性致病菌检测中具有巨大的应用潜力。
2.4 dPCR检测食品中空肠弯曲菌
空肠弯曲菌(Campylobacterjejuni)是一种革兰氏阴性微嗜氧菌。感染空肠弯曲菌的主要途径是家禽,尤其是鸡肉,同时在未经巴氏灭菌的乳制品、水、牛肉和其他农产品中也能检测出,有研究发现野生动物可能是人类感染空肠弯曲菌的潜在宿主。空肠弯曲菌感染被认为是引起人类细菌性胃肠炎的主要病因,潜伏期为2~3 d,随后会出现腹泻、腹痛、发烧、呕吐等症状,具有自限性,大约7~10 d就可康复[40-41]。此外,该菌还会引起炎症性肠病、赖特氏综合征以及神经系统疾病米勒费雪症候群(Miller Fisher症候群)和格林-巴利综合征(Guillian-Barre综合征)。在美国,空肠弯曲菌感染人数大约为130万[40],给食品安全带来了巨大挑战,因此研究快速准确的筛选和检测方法具有重要意义。
Papic等[42]对75份肉鸡颈部样品进行空肠弯曲菌的定量检测,同时对dPCR、qPCR和标准平板计数法进行比较。在dPCR检测中,空肠弯曲菌最佳稀释度范围为10-3~102,LOQ为12 523 cfu·g-1。实验证明,虽然cdPCR和ddPCR都可以观察到假阳性样本,但由于cdPCR耗时较长以及较高的试剂成本,不适于空肠弯曲菌的常规检测和定量,而dPCR可以通过增加平行实验的次数、增加DNA模板体积和优化dPCR分析进行改善。
2.5 ddPCR检测食品中志贺氏菌
志贺氏菌(Shigella)是一种革兰氏阴性细菌。由志贺氏菌引起的疾病可能是通过食用被污染的水、肉类、鸡蛋和牛奶引起的。此菌可引起幼儿和成人的急性腹泻和痢疾,感染者在1~2 d内会出现腹泻、腹部痉挛、恶心、呕吐和发烧等症状。一般5~7 d内即使不治疗也可以康复,但免疫力低下的人可能还需要持续一段时间[43]。5岁以下的儿童最容易被感染,据报道每年约有7 500万儿童因感染志贺氏菌导致发育迟缓和消瘦,每年约有28 000人因志贺氏菌致命[44-45]。志贺氏菌每年导致全球1.9亿例腹泻[46]。美国每年约有45万人感染,6 380人住院,26人致命[43]。因此,定量检测食品中志贺氏菌已成为各国关注的热点。
Yang等[47]通过检测志贺氏菌来比较3种不同PCR的灵敏度和特异性,包括传统PCR、qPCR和ddPCR。ddPCR最佳退火温度为58 ℃,志贺氏菌增菌培养液LOD为10-1cfu·mL-1。ddPCR检测灵敏度是qPCR检测的10倍,是传统PCR的1 000倍。实验结果表明,传统PCR的灵敏度较低,qPCR可检测出10-4ng·μL-1基因组DNA或100cfu·mL-1细菌,而ddPCR可检出10-5ng·μL-1基因组DNA和10-1cfu·mL-1细菌,具有更高的灵敏度和准确性。因此ddPCR有检测时间短、特异性高、重复性好和准确性好等特点,更适合用于志贺氏菌的检测。
2.6 ddPCR检测食品中克罗诺杆菌
克罗诺杆菌(Cronobacter)是一种能在食品表面形成生物膜的革兰氏阴性条件致病菌。它共分为7个属,具有丰富的遗传多样性,感染后主要表现为败血症、致死性小肠结肠炎、脓毒症、脑膜炎以及菌血症等。它可引起所有年龄段人群感染,尤其是免疫力低下的早产儿和老年人,致死率高达40%~80%,其幸存者依然有严重的神经系统后遗症[48]。克罗诺杆菌广泛存在于自然界中,主要传播源是婴儿配方奶粉,另外牛奶、奶酪、肉类、蔬菜、谷物、香草料及中草药等也可作为其传播源。克罗诺杆菌最先鉴定出的毒力因子是肠毒素[49]。该菌耐热、酸碱、干燥、渗透压、辐射、抗生素和天然提取[48],因此需要加强食品中克罗诺杆菌的监测及污染控制。
Ma等[50]利用PacBio SMRT测序和ddPCR对7个山羊奶粉样品进行细菌污染检测,鉴定出10门119属249种。主要优势菌属有克罗诺菌属(Cronobacter)、类芽孢杆菌(Paenibacillus)、乳球菌属(Lactococcus)、嗜碱菌属(Alkaliphilus)、不动杆菌属(Acinetobacter)、肠球菌(Enterococcus)、链球菌属(Streptococcus)和气单胞菌属(Aeromonas)。实验说明,在食源性致病菌的检测中,ddPCR与其他检测手段结合使用的方法更适用于未来的研究,具有很好的应用前景。
2.7 dPCR检测食品中副溶血性弧菌
副溶血性弧菌(Vibrioparahaemolyticus)是一种嗜盐的革兰氏阴性细菌,该菌广泛分布于温暖的海洋或河口中,主要从贝类中检出,其次还常从海鱼、虾和蟹中检出。食用副溶血性弧菌污染的生的或未煮熟的海产品可引起急性肠胃炎、败血症,会导致以严重腹泻、腹部痉挛、恶心、呕吐、头痛和发烧为症状的疾病。1991—2001年,我国5 770起食源性疾病中有31.1%由副溶血性弧菌引起[51]。耐热直接溶血素(thermostable direct hemolysin,tdh)和TDH相关溶血素(TDH-related hemolysin,trh)被认为是该微生物的主要毒力因子[52]。为了有效地预防和控制疾病,发展快速副溶血性弧菌定量检测方法越来越重要。
方佩佩等[53]采用ddPCR以副溶血性弧菌中tlh为靶基因建立副溶血性弧菌快速定量检测系统,其副溶血性弧菌有效基因组DNA浓度范围为2~19 440 copy·20μL-1,灵敏度为0.2 copy·20μL-1,菌悬液浓度的检出限为50~4.86×105cfu·mL-1。结果证明,dPCR在检测副溶血性弧菌中具有较好的发展前景,可进一步应用于其他微生物的检测。总体而言,在致病菌检测中,dPCR已被证明能够成功地检测到低浓度的目标物质,并可获得非常可靠的检测结果。杨娟等[54]使用ddPCR与DNase处理法相结合对冷冻食品中副溶血性弧菌进行检测,并与qPCR进行比较。将DNase试剂与PMA染料分别作用于不同时期的冷冻基质,与PMA相比,DNase处理法无需强光照射,操作简便快捷,无试剂毒性。结果表明,ddPCR与DNase相结合适用于副溶血性弧菌活的非可培养状态(viable but non-culturable state,VBNC)的检测,能对冷冻食品中的微量活性副溶血性弧菌精准定量检测,其检测过程快速、安全、稳定。翁文川等[55]对水产品中活的副溶血性弧菌采用ddPCR与PMA新型染料相结合的检测方法,并与qPCR进行对比。实验表明,PMA-ddPCR的整个检测过程只需3~4 h,在食源性致病微生菌检测中有很大的发展空间。Li等[56]建立了副溶血性弧菌的定量检测方法,数据显示,原食品样品中tdh基因拷贝数为14.90 copies·mL-1,产生tdh的菌株与不产生tdh的菌株的比例约为1∶30。结果显示,单一的培养方法可能导致错误的结论,传统的弧菌选择性富集培养基对tdh产生菌的生长没有特异性的促进作用。因此,开发新的培养基也尤为重要。
2.8 ddPCR检测食品中单核细胞增生李斯特氏菌
单核细胞增生李斯特氏菌(Listeriamonocytogenes)简称单增李斯特氏菌,是一种革兰氏阳性、杆状、不产芽孢和兼性厌氧的病原菌,主要存在于即食食品和海鲜中,能够引起人畜共患病。单核细胞增生李斯特氏菌的毒力主要由6个毒力因子编码基因组成,分别为prfA、plcA、mpl、InlA、hly、actA和plcB[57]。单核细胞增生李斯特氏菌容易感染免疫力低的人群和动物,还可能导致孕妇流产、死产或胎儿死亡,致死率达20%~30%[58]。孕妇感染单核细胞增生李斯特氏菌的机率是正常人群的17倍,糖尿病患者和免疫力低下的人群感染单核细胞增生李斯特氏菌的概率是正常人群的25倍[59]。单核细胞增生李斯特氏菌能够在冷藏温度下生长和繁殖,对酸和盐具有一定的耐性,而且在低水分的环境中也能生长[58,60]。因此,单核细胞增生李斯特氏菌在食品检验中要加以重视。
程逸宇等[61]采用ddPCR检测方法对乳制品中单核细胞增生李斯特氏菌进行定量检测,实验选取单核细胞增生李斯特氏菌的iap基因为靶基因,结果显示与qPCR相比,ddPCR具有灵敏性强、精密度高、可重复性好和检测低浓度染菌样品更精确等优点。虽然qPCR是目前致病菌检测中最常用的方法,但dPCR比qPCR具有更多潜在的优势,更适合在食品检测中推广运用。赵丽青等[62]以单核细胞增生李斯特氏菌的hlyA基因为靶基因,建立了可准确定量的ddPCR方法;ddPCR反应中的最佳探针浓度为5 pmol·μL-1,检出限为(3.6±0.1)copies·20 mL-1,标准偏差为0.067%。因此,该研究建立的ddPCR系统可以为单核细胞增生李斯特氏菌的快速定量检测提供参考。Witte等[63]通过对单核细胞增生李斯特氏菌的检验发现,质量较差、保存时间较长的DNA会影响ddPCR的检测。与qPCR预混液相比,使用ddPCR预混液进行prfA分析时Ct值会显著提高。实验结果表明,ddPCR不仅对从纯培养物中提取的DNA具有很好的定量能力,而且对来自食品的样品也有很好的检测效果。
2.9 ddPCR检测食品中蜡状芽孢杆菌
蜡状芽孢杆菌(Bacilluscereus)是一种能形成芽孢的革兰氏阳性细菌,广泛存在于自然界和食品中,如奶制品、肉制品、香辛料、中草药、谷物、鸡蛋、蔬菜、水果和即食食品。当蜡状芽孢杆菌摄入浓度在105~108cfu·g-1之间时,便会引起食物中毒,主要症状为呕吐综合征和腹泻综合征[64-65]。呕吐综合征由毒素引起,通常与大米制品、淀粉类食物和奶酪制品有关;腹泻综合征由一种或多种肠毒素引起,与肉类、鱼类、牛奶和蔬菜有关;极少数情况下,呕吐和腹泻综合征会同时出现。蜡状芽孢杆菌对高温、低水分和其他影响因素都有很强的抵抗力[64, 66],因此,对食品中蜡状芽孢杆菌进行检测十分必要。
Porcellato等[67]优化并使用了一种新的ddPCR方法来检测和定量牛奶中的蜡状芽孢杆菌,并与qPCR进行比较。优化ddPCR的步骤如下:首先评估4种不同浓度探针的ddPCR结果,然后优化退火温度。实验分别从90个纸箱装的生奶、巴氏杀菌奶和包装奶样品中检测出蜡状芽孢杆菌组53份(58%)和18份(20%)阳性。结果表明,与qPCR相比,ddPCR表现出更好的性能,在食品样品检测中具有良好的应用前景。
3 展望
综上所述,dPCR较常规检测技术有绝对定量、精准度高、工作量少和特异性好等诸多优点。针对传统dPCR的检测方法,研究人员为了提升检测的精准度,将dPCR技术与试剂相结合并应用于致病菌的检测中:例如dPCR与PMA提高了检测的灵敏度;研究人员用DNase替换PMA,此方法无需强光照射,而且无试剂毒性,大大提高了检测效率,提高了检测质量;dPCR与DNA条形码相结合可以轻松地量化不同细菌群体中的单个菌株,提高精准度。因此,随着时间的推移,dPCR经过不断的改进和创新,在各个领域检测中具有巨大的优势和广泛的应用前景。
另一方面,dPCR虽具有上述优点以及巨大的应用潜力,但仍存在一定的局限性。例如:在dPCR检测中假阴性和假阳性的现象相对较少,但依旧存在,且引发人们对基于dPCR定量食源性致病菌的准确性的担忧;另外,由于dPCR吞吐量低和容纳样品的体积小,导致动态范围较窄、稳定性和精密度略低于qPCR;由于dPCR数据分析平台众多,且处理方式不尽相同,因此对数据进行规范的协同分析也是dPCR今后发展的重点。
现如今,dPCR是一种很强大的绝对定量方法,有可能彻底改变致病菌的检测方式。但实现完全自动化也是dPCR应用于检测食源性致病菌方面的主要挑战。因此,随着技术的革新,dPCR技术必将更加自动化。同时,如果dPCR能与一些新兴的检测技术如等温扩增技术和无透镜成像技术相结合,将有助于进一步精准的检测食源性致病菌。随着今后科技的不断发展,dPCR在食源性致病菌中的检测会更加精准、高效和广泛,为规范我国食品安全工作的实施提供强有力的技术平台,从而保障人民群众的食品安全。

