基于双酶偶联法合成尿苷二磷酸葡萄糖醛酸的研究
何丽丽, 窦文芳, 吕海超, 薛欣欣, 张文, 江南
江南大学药学院,江苏 无锡 214122
糖基供体通常是糖的活化形式。当以天然产物为糖基受体时,将糖基供体的高能磷酸键通过能量转移到糖基受体上,可以形成天然产物与糖的糖苷键[1]。常见的糖基供体有尿苷二磷酸(uridine diphosphate,UDP)-糖、胸苷二磷酸(thymidine diphosphate,TDP)-糖、鸟苷二磷酸(guanosine diphosphate,GDP)-糖等[2]。这些糖基供体在生物体内可以通过不同代谢反应实现相互转化。生物体内最常见的糖基供体为UDP-糖,其中,UDP-葡萄糖是形成其他UDP-单糖的基础原料,而UDP-葡萄糖醛酸是UDP-糖由六碳糖变为五碳糖的关键底物[3-4]。UDP-葡萄糖醛酸是细胞内重要的糖基供体,是结构多糖、透明质酸和细胞生长代谢必不可少的前体物质[5-7]。UDP-葡萄糖醛酸也可以作为单糖供体用来延长糖胺聚糖的糖链长度,对于研究不同分子大小的糖苷聚糖具有重要意义[8]。目前,因其合成难度大、价格昂贵,无法满足生产需求,因此,探究如何高效合成UDP-葡萄糖醛酸的方法已成为研究热点。
UDP-葡萄糖醛酸是生物体多糖合成的重要前提,与生物代谢有很大的联系。研究表明,存在两条合成UDP-葡萄糖醛酸的途径:一种途径为1-磷酸-葡萄糖醛酸通过UDP-葡萄糖焦磷酸化酶直接催化生成UDP-葡萄糖醛酸;另一条途径在动物和细菌中较为常见,以烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)为辅因子、UDP-葡萄糖为底物,通过UDP-葡萄糖6-脱氢酶氧化UDP-葡萄糖合成UDP-葡萄糖醛酸[9-10]。这为本实验室研究酶法合成UDP-葡萄糖醛酸提供了有效的思路,本研究是以来源于化脓性链球菌Streptococcuspyogenes的尿苷二磷酸葡萄糖脱氢酶(UDP-glucose dehydrogenase,UGD),催化UDP-葡萄糖氧化生成UDP-葡萄糖醛酸,偶联猪源的乳酸脱氢酶(lactate dehydrogenase,LDH)来减弱体系中反馈抑制作用(反应路线见图1),并通过高效液相色谱、质谱及核磁共振氢谱对反应产物进行检测,以期为后续UDP-葡萄糖醛酸制备提供新思路。
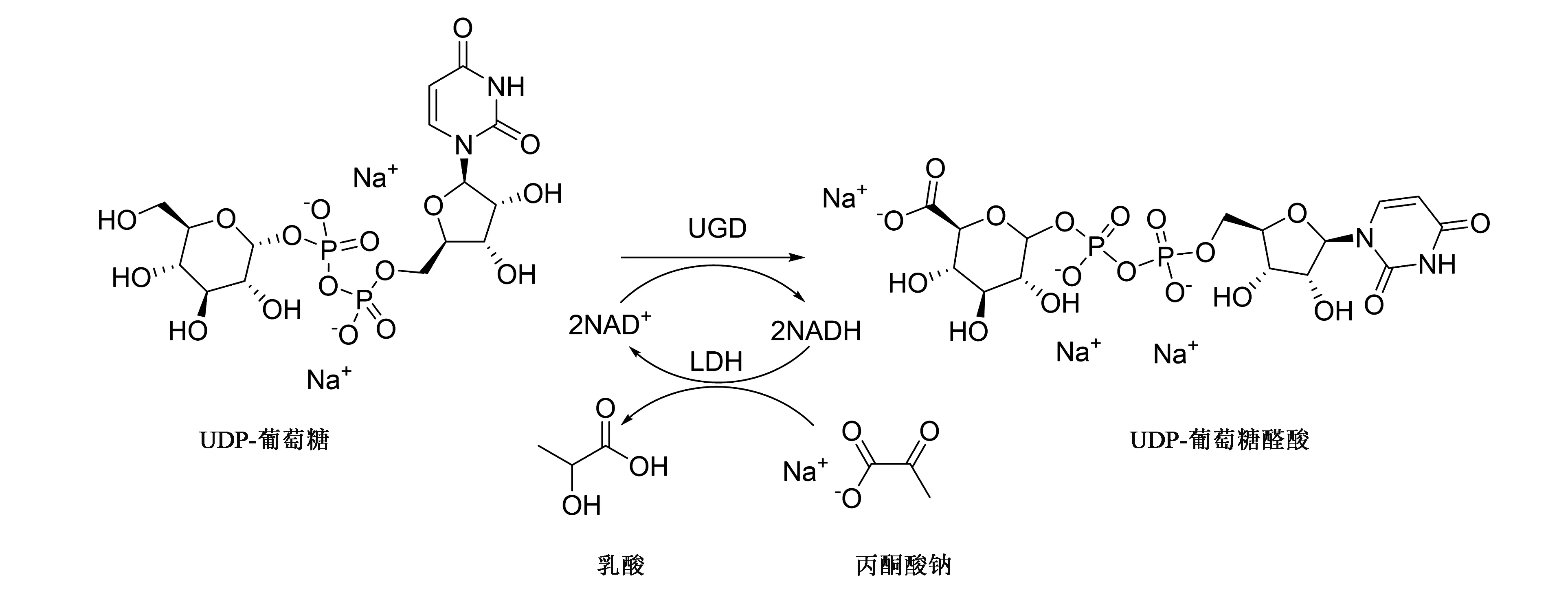
图1 UDP-葡萄糖醛酸酶法合成路线
1 材料与方法
1.1 材料
1.1.1菌种的来源基因工程菌EscherichiacoliBL21/pET-28a(+)-UGD、EscherichiacoliBL21/pET-28a(+)-LDH均由本实验室构建、保存。
1.1.2试剂UDP-葡萄糖由本实验室合成;UDP-葡萄糖醛酸标品购买自上海源叶生物科技有限公司;丙酮酸钠、β-巯基乙醇购买自生工生物工程(上海)股份有限公司;其他实验试剂均购买自上海国药集团。
1.1.3设备与仪器UV1800紫外分光光度计(皓堤仪器(上海)有限公司);QT-58B紫外检测器(上海琪特科技有限公司);1260高效液相色谱仪(美国安捷伦科技有限公司);MALDI SYNAPT MS超高相液相色谱串联四级杆飞行时间质谱联用仪(美国沃特世公司);Avance Ⅲ 400 MHz全数字化核磁共振波谱仪(德国布鲁克公司)。
1.2 UGD、LDH的表达与纯化
1.2.1重组菌的诱导表达分别挑取本实验室保存的重组菌pET-28a(+)/UGD、pET-28a(+)/LDH接种至50 mL的LB培养基中(卡那霉素终浓度为50 μg·mL-1),37 ℃、220 r·min-1培养过夜。再按2%的接种量接种至500 mL的LB培养基中,37 ℃、220 r·min-1培养,当OD600达到0.7~0.8时,加入异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)。UGD菌液中IPTG的终浓度为0.3 mmol·L-1,于25 ℃、220 r·min-1培养过夜;LDH菌液中IPTG的终浓度为0.5 mmol·L-1,30 ℃、220 r·min-1培养过夜。4 ℃、8 000 r·min-1离心15 min收集菌体,于-80 ℃保存。
1.2.2产物纯化称取6 g菌体,加入5倍体积的裂解液(20 mmol·L-1Tris,100 mmol·L-1NaCl,pH 8.0),采用超声破碎(破碎3 s停6 s,功率45%,时间35 min),4 ℃、15 000 r·min-1离心20 min收集上清,目标蛋白用His标签柱纯化,纯化得到的酶液加终浓度为15%甘油后置于-80 ℃冰箱保存。纯化的目的蛋白用12%聚丙酰胺凝胶电泳(SDS-PAGE)检验。
1.2.3酶浓度的测定采用考马斯亮蓝(Bradford)法蛋白浓度测定试剂盒测定[11]。取一定量的5 mg·mL-1牛血清蛋白标准液,用1×PBS稀释成终浓度为200 μg·mL-1,然后按一定的比例稀释,以1×PBS为溶剂稀释成终浓度分别为0、10、20、30、40、50 μg·mL-1备用。样品也以1×PBS为溶剂稀释成合适的浓度。各取不同浓度的牛血清蛋白标准液及样品100 μL,加入1 mL Bradford工作液,迅速混匀,室温反应5 min,以终浓度为0 μg·mL-1的牛血清蛋白标准液为对照,在分光光度计依次测定各管的A595值。以浓度为横坐标、相应的吸光度为纵坐标,绘制标准曲线。根据标准曲线可算出稀释后样品的蛋白浓度,再乘以相应的稀释倍数即可得到最终的样品蛋白浓度。本研究中计算公式如下:

1.3 UDP-葡萄糖醛酸的酶法合成及体系探讨
1.3.1HPLC检测方法色谱条件为:YMC-Polyamine(PAMN)(4.6 mm×250 mm,5 μm),缓冲液A为超纯水,缓冲液B为1 mol·L-1KH2PO4;运行程序为:0 min 20% B到40 min 60% B,流速为0.5 mL·min-1,进样量为5 μL,检测波长为260 nm,温度25 ℃。
1.3.2UDP-葡萄糖醛酸标品的定量精密称取UDP-葡萄糖醛酸标品10 mg,以纯水为溶剂,配制成终浓度为5 mg·mL-1,再根据不同的稀释倍数配成不同的浓度(0.4、0.6、0.8、1.0、1.2 mg·mL-1)。根据1.3.1 HPLC检测方法进行检测。以浓度为横坐标、峰面积为纵坐标,绘制标准曲线。
1.3.3单酶催化UDP-葡萄糖反应单酶催化反应体系为:2 mL 10 mmol·L-1UDP-葡萄糖、2.5 mL 10 mmol·L-1NAD+、100 μL 1 mol·L-1Tris、20 μL 1 mol·L-1MgCl2、10 μL β-巯基乙醇溶液,调节pH至8.0,混合后,加入2.3 mL 0.9 mg·mL-1UGD,补足纯水至10 mL。相同体系下,不加UGD酶为对照组。20 ℃水浴条件下反应过夜,HPLC检测产物的生成情况。并依次对5 mmol·L-1NAD+,5 mmol·L-1UDP-葡萄糖、0.5 mg·mL-1NADH、0.5 mg·mL-1UDP-葡萄糖醛酸的标品进行相同方法的HPLC检测,以判断各底物及各产物的出峰位置,方便对酶催化反应的图谱结果进行比对。
1.3.4双酶偶联催化UDP-葡萄糖反应双酶偶联催化反应体系为:2.4 mL 10 mmol·L-1UDP-葡萄糖、1.5 mL 10 mmol·L-1NAD+、100 μL 1mol·L-1Tris、20 μL 1 mol·L-1MgCl2、10 μL β-巯基乙醇溶液、1 mL 100 mmol·L-1丙酮酸钠,调节pH至8.0,混合后,加入2.3 mL 0.9 mg·mL-1UGD、500 μL 1.6 mg·mL-1LDH,补足纯水至10 mL。相同体系下,不加LDH酶为对照组。20 ℃水浴条件下反应过夜。HPLC检测产物的生成情况。
1.3.5双酶催化反应条件的优化基本反应体系(10 mL)为:2.8 mL 10 mmol·L-1UDP-葡萄糖、2.0 mL 10 mmol·L-1NAD+、100 μL 1mol·L-1Tris、20 μL 1 mol·L-1MgCl2、10 μL β-巯基乙醇溶液、1 mL 100 mmol·L-1丙酮酸钠,混合后,调节pH,加入2.3 mL 0.9 mg·mL-1UGD、500 μL 1.6 mg·mL-1LDH,补足纯水至10 mL。以此为基础,探究不同因素对双酶催化反应的影响。
①pH对酶活的影响。pH的测试范围为7.0、8.0、9.0、10.0、11.0,25 ℃水浴条件下反应过夜。产物经HPLC检测,根据产物生成率最高的对应pH为参照,计算各pH下酶的相对活力。
②温度对酶活的影响。pH调节至8.0,温度的测试范围为15、20、25、30、35 ℃,产物经HPLC检测,根据产物生成率最高的对应温度为参照,计算各温度下酶的相对活力。
③底物浓度UDP-葡萄糖对反应的影响。保持NAD+浓度不变,UDP-葡萄糖浓度的测试范围为1.6、2.0、2.4、2.8、3.2 mmol·L-1,pH调节至8.0,20 ℃水浴条件下反应过夜。产物经HPLC检测,根据产物的生成量及产率择优选择合适的底物浓度。
④底物浓度NAD+对反应的影响。选择最优的UDP-葡萄糖浓度,保持UDP-葡萄糖浓度不变,NAD+浓度的测试范围为0.5、1.0、1.5、2.0、2.5 mmol·L-1,pH调节至8.0,20 ℃水浴条件下反应过夜。产物经HPLC检测,根据产物的生成量及产率择优选择合适的底物浓度。
1.4 UDP-葡萄糖醛酸的分离鉴定
1.4.1UDP-葡萄糖醛酸的分离纯化根据1.3.5获得的最优体系搭建双酶偶联催化UDP-葡萄糖反应,反应结束后,将反应液稀释30倍,调节pH至8.0,过0.22 μm滤膜,上样至平衡好的Q Sepharose层析柱[12],以20 mmol·L-1Tris(pH 8.0)→1 mol·L-1NaCl进行梯度洗脱,紫外检测器进行监测,HPLC检测波长为260 nm。
1.4.2UDP-葡萄糖醛酸的液相色谱-质谱联用(LC-MS)检测分析为确定酶促反应中新生成物质的分子量,对纯化后的液体进行LC-MS分析。样品浓度范围为0.1~1.0 mg·mL-1,无需过滤膜,离心取上清即可,保证溶液澄清透明,置于装有内衬管的棕色小瓶中待检测。质谱条件:采用负离子化方式,毛细管电压为3.0 kV,锥孔电压:20 V,离子源温度100 ℃,脱溶剂气温度400 ℃。液相色谱条件:BEH C18(2.1 mm×150 mm,1.7 μm),缓冲液A为0.1%甲酸,缓冲液B为乙腈;运行程序:0 min 0% B到40 min 30% B,40 min 30% B到45 min 80% B,45 min 80% B到50 min 100% B,50 min 100% B到55 min 0% B,流速为0.3 mL·min-1,进样量为5 μL,检测波长为200~400 nm,温度45 ℃。检测UDP-葡萄糖醛酸的分子量。
1.4.3UDP-葡萄糖醛酸的核磁氢谱(NMR)检测分析为确定酶促反应中新生成物质的结构,对透析冻干的产物进行NMR分析。纯化冻干的产物称取10 mg,纯度>95%,溶于0.5 mL氘代重水中,保证溶液澄清透明,装入干净的核磁管中待测,需注意的是重水溶液常带有气泡,溶解后必须将气泡赶走。采用Bruker Avance Ⅲ 400 MHz核磁共振仪测定(TMS为内标)。
1.5 数据分析
所有的统计数据均进行3次以上的重复实验。使用Microsoft Office Excel 2016 绘制标准曲线,GraphPad Prism 8.0制图,Origin 8.0 处理液相图谱数据,MassLynx 4.1 处理质谱数据,MestReNova 9.0 处理核磁数据。
2 结果与分析
2.1 UGD、LDH纯化及浓度测定结果
UGD、LDH诱导表达后,经His标签柱纯化,纯化获得的目的蛋白通过SDS-PAGE分析,目的蛋白的大小分别为43.9、36.6 kDa。结果如图2所示,2种纯化蛋白条带大小与预期一致[13-14]。经测定,UGD酶浓度为0.82 mg·mL-1,LDH的酶浓度为1.56 mg·mL-1。

注:1—UGD蛋白;2—LDH蛋白。
2.2 UDP-葡萄糖醛酸标品的定量
分别取100 μL UDP-葡萄糖醛酸标准液过0.22 μm水系滤膜,重复3次,检测UDP-葡萄糖醛酸的峰面积。以浓度为横坐标、对应峰面积的平均值为纵坐标,得到标准浓度曲线。由图3可知,在0.4~1.2 mg·mL-1范围内,UDP-葡萄糖醛酸的浓度与吸光度呈良好的线性关系。

图3 UDP-葡萄糖醛酸含量标准曲线
2.3 单酶催化UDP-葡萄糖氧化反应
为研究UGD酶是否催化UDP-葡萄糖氧化反应,将反应体系中各底物分别进行液相检测,以判断各底物的保留时间,在相同体系下,以不加UGD酶为对照,通过对比以判断是否有新的物质生成,结果如图4所示。HPLC检测结果显示,由图4可以看出,当UGD氧化UDP-葡萄糖时,水浴过夜后,HPLC图谱显示在8.6 min左右为NAD+、11.8 min左右为UDP-葡萄糖,14.6和27.7 min左右出现新的吸收峰,表明酶促反应生成了新的物质。由4 C可知,14.6 min左右为NADH,另通过对比UDP-葡萄糖醛酸的对照品(图4D),两者在260 nm处吸收峰的保留时间分别为27.72和27.76 min,可以初步判断反应生成的产物为UDP-葡萄糖醛酸。表明经UGD酶的催化可氧化UDP-葡萄糖生成一种新的物质,初步判断为UDP-葡萄糖醛酸,经计算得出产物的生成量约为0.46 mg·mL-1。
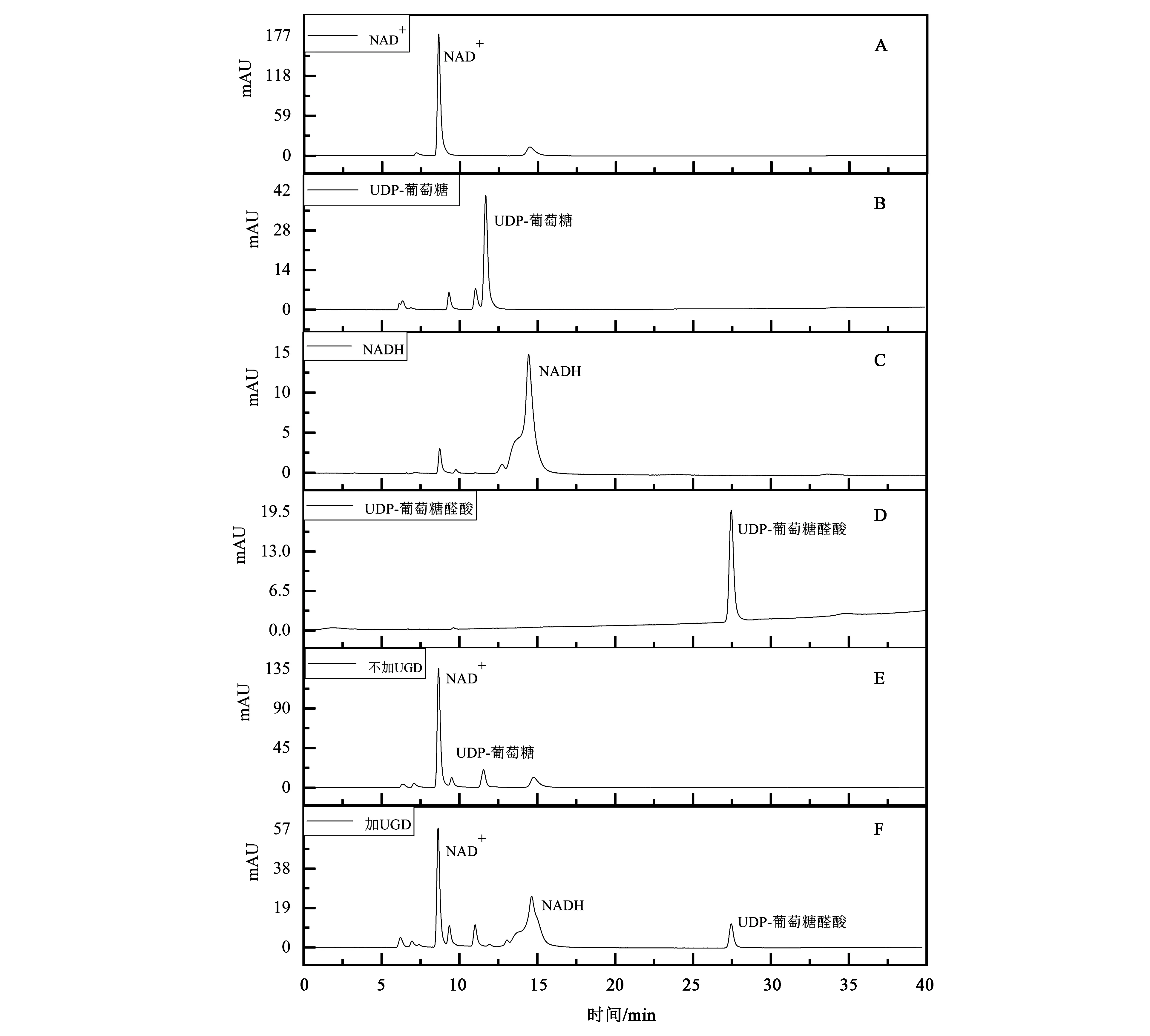
A:5 mmol·L-1 NAD+ HPLC检测图谱;B:5 mmol·L-1UDP-葡萄糖 HPLC检测图谱;C:0.5 mg·mL-1 NADH HPLC检测图谱;D:0.5 mg·mL-1 UDP-葡萄糖醛酸标品HPLC检测图谱;E:无UGD催化UDP-葡萄糖过夜反应图谱;F:UGD催化UDP-葡萄糖过夜反应图谱
2.4 双酶偶联催化UDP-葡萄糖反应
为研究LDH酶对催化UDP-葡萄糖氧化反应的影响,在相同体系下,以不加LDH酶为对照,比较生成的目标产物UDP-葡萄糖醛酸的峰面积情况,结果如图5所示。用HPLC分别对各个反应进行检测,HPLC检测结果显示,以图5A作为对照,由图5 B、C可以看出,27.7 min左右出现新的吸收峰,表明酶促反应生成了新的物质,加入LDH酶后,NADH的生成量明显减少,因此可以判定UGD、LDH有正确活性,能够催化UDP-葡萄糖转化成UDP-葡萄糖醛酸。根据目标物质的峰面积带入UDP-葡萄糖醛酸的标准曲线,算出目标产物的浓度。经计算,在相同体系下,当加入LDH酶后(图5 C),产物的生成量约为0.93 mg·mL-1,无LDH时(图5 B),产物的生成量约为0.49 mg·mL-1,所以加入LDH酶后产量提高了约0.9倍。

A:无UGD催化UDP-葡萄糖过夜反应图谱;B:UGD催化UDP-葡萄糖过夜反应图谱;C:双酶偶联催化UDP-葡萄糖过夜反应图谱
2.5 酶催化反应条件的探究
2.5.1pH对酶活的影响在25 ℃,pH 7.0、8.0、9.0、10.0、11.0的条件下,实验以UDP-葡萄糖和 NAD+为反应底物,研究pH对催化UDP-葡萄糖氧化反应的影响。由图6可知,这2种酶在pH 7.0~8.0时略有上升,在pH 8.0时酶活性最高,酶活性在9.0~11.0时迅速下降,说明双酶偶联的最适酶促反应的pH为8.0。

图6 pH对酶活力的影响
2.5.2温度对酶活的影响在pH 8.0,15、20、25、30、35 ℃的条件下,实验以UDP-葡萄糖和 NAD+为反应底物,研究温度对催化UDP-葡萄糖氧化反应的影响。由图7所示,20 ℃时酶活性最高,当温度上升至35 ℃时,酶活性急剧下降,但是在15 ℃及25 ℃时仍保留着较高的酶活力,说明这2种酶都带有低温酶的特征。所以双酶偶联选择的最适温度为20 ℃。

图7 温度对酶活力的影响
2.5.3不同UDP-葡萄糖浓度对反应的影响在pH 8.0、20℃条件下,探究不同UDP-葡萄糖浓度对反应的影响。由图8可知,随着UDP-葡萄糖浓度的不断增加,目标产物的产量也随之增加,当达到一定程度时,产量也随之减少。而从产率角度而言,当UDP-葡萄糖浓度在2.0~2.4 mmol·L-1时,产率有所增加,随着UDP-葡萄糖浓度继续增加时,产率随之减少。综合考虑,选择UDP-葡萄糖浓度2.4 mmol·L-1时为最优底物浓度。

图8 UDP-葡萄糖浓度对反应的影响
2.5.4不同NAD+浓度对反应的影响在pH 8.0、20 ℃条件下,探究不同NAD+浓度对反应的影响。由图9可知,随着NAD+浓度的增大,产量和产率的趋势都保持一致,综上,最适NAD+浓度为1.5 mmol·L-1。

图9 NAD+浓度对反应的影响
2.6 UDP-葡萄糖醛酸分离纯化结果
在一定pH条件下,利用不同物质所带电荷不同的性质,采用强碱性阴离子吸附柱Q Sepharose实现不同物质分离的效果[15]。样品冻融后稀释30倍,减少反应液中盐离子对目标物质吸附效果的影响,再经Q Sepharose 强碱性阴离子吸附柱交换纯化得到目标物质,采用NaCl作为洗脱盐,借助AKTA进行分离纯化。盐溶液开始洗脱时,在260 nm出现洗脱峰时开始收集,经HPLC结果显示(图10),在150 mmol·L-1NaCl处洗脱出目标物质UDP-葡萄糖醛酸,纯度为90%以上。
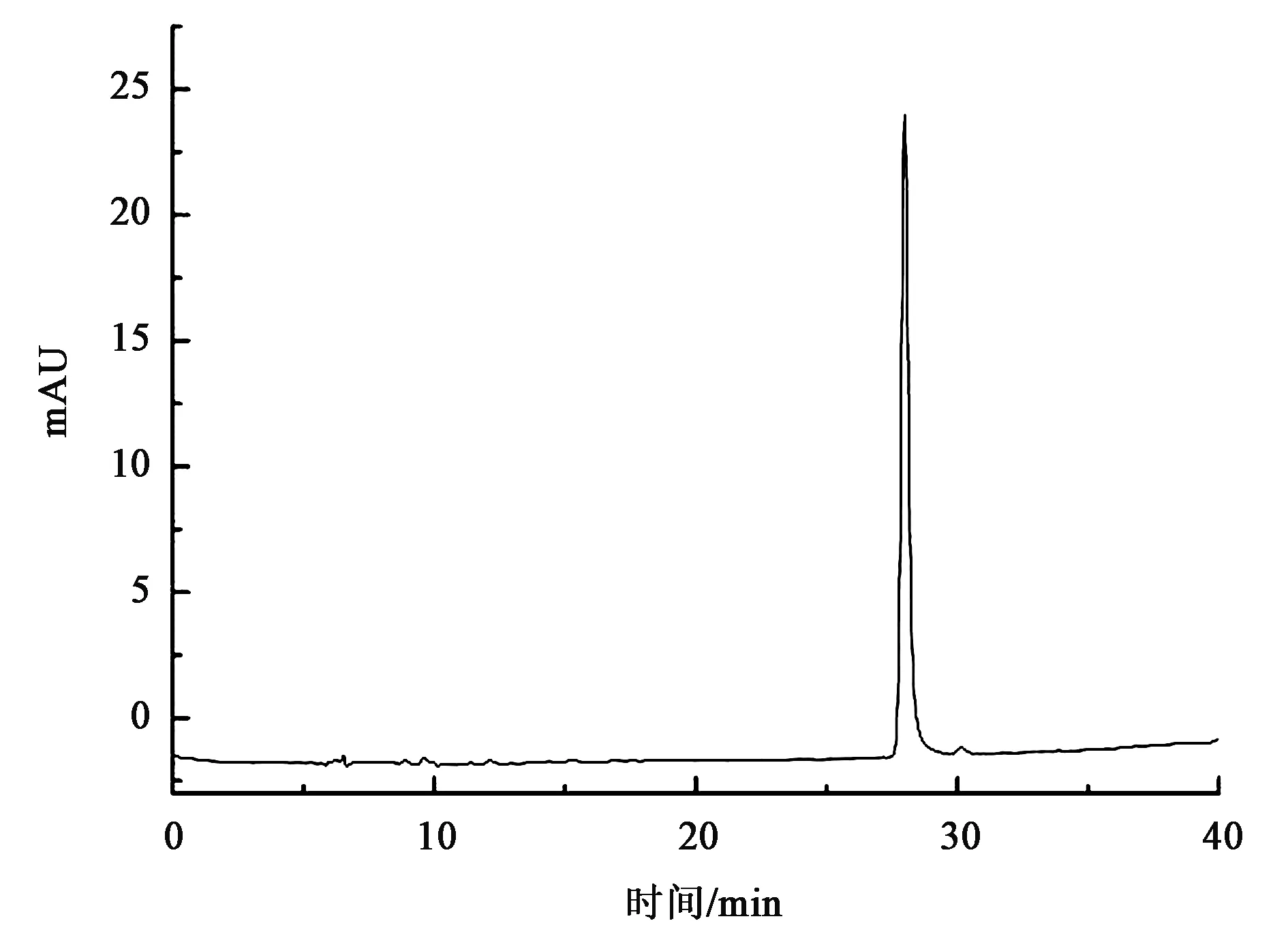
图10 UDP-葡萄糖醛酸纯化HPLC检测图谱
2.7 UDP-葡萄糖醛酸质谱分析
为确定反应体系中新生成物质的分子量,将反应液进行纯化后,分别对UDP-葡萄糖醛酸标品和UDP-葡萄糖醛酸样品做液相-质谱分析(LC-MS),由图11可知,纯化后的UDP-葡萄糖醛酸样品(图11 B)在质谱条件下荷质比为579.0,与标准品UDP-葡萄糖醛酸(图11 A)测得的荷质比吻合,本实验中,检测使用的是负离子源,所以显示的分子量是579.0。结果表明,经LC-MS检测标准品UDP-葡萄糖醛酸与纯化的样品荷质比一致,其分子量都为580.0。

A:UDP-葡萄糖醛酸标品质谱检测结果;B:UDP-葡萄糖与NAD+反应生成产物的质谱检测结果
2.8 产物结构分析
为确定反应体系中新生成物质的结构,将反应产物透析冻干后做相应的核磁共振氢谱检测,结果如图12所示。参考相关文献[16],采用氘代重水溶解,试样中加入TMS作为内标,该结构共有19个氢,其中有6个活泼氢会被氘取代,所以共有13个氢能通过共振吸收电磁波能量检测到相关信号。借助Chemdraw模拟的氢谱结果进行比较,并参考相关文献[17],证实双酶偶联催化生成的产物为UDP-葡萄糖醛酸,产物的结构及检测结果如图12所示。

注:1H NMR(400 MHz, Deuterium Oxide)δ 7.97(d, J = 8.2 Hz, 1H), 6.00(s, 1H), 5.63(dd, J = 7.6, 3.5 Hz, 1H), 4.38(t, J = 4.2 Hz, 2H), 4.30(p, J = 2.7 Hz, 1H), 4.23(dd, J = 4.5, 2.4 Hz, 1H), 4.20(dd, J = 5.5, 2.8 Hz, 1H), 4.15(d, J = 10.2 Hz, 1H), 3.79(t, J = 9.5 Hz, 1H), 3.74(s, 1H), 3.58(dt, J = 9.8, 3.1 Hz, 1H), 3.54-3.47(m, 1H)。
3 讨论
目前有关UDP-葡萄糖醛酸的研究并不多,大部分的研究都是以UDP-葡萄糖醛酸转移酶为主。UDP-葡萄糖醛酸生产成本高,价格昂贵。合成UDP-葡萄糖醛酸主要有2种方法,分别是化学合成和生物合成。因其结构复杂,化学合成相对困难且产量较低,同时给环境造成极大的污染[16];相比化学法,酶法合成是种有效的替代策略,具有很高的立体和区域选择性、安全性高等优点[17],可广泛用于研究。
齐晨[18]对大肠杆菌源的UGD进行重组表达及优化,以UDP-葡萄糖为底物催化合成UDP-葡萄糖醛酸,发现底物转化率并不理想。在UGD的催化下,UDP-葡萄糖氧化生成UDP-葡萄糖醛酸,将葡萄糖的C6从羟基氧化成羰基,且不释放中间体[19],产物之一的NADH会反馈抑制反应的进行,导致反应产量不高、效率较低且烟酰胺类辅酶成本高昂、稳定性较差,生产成本随之增高。纪小虎[14]以新鲜牛肝脏为原料,采用分步盐析-热变性法制备UGD粗品,加入市售的兔肌LDH,一锅酶法合成UDP-葡萄糖醛酸。基于已有研究成果,本研究以UDP-葡萄糖为底物、NAD+为辅因子,采用UGD和LDH双酶偶联催化,并对产物进行质谱及核磁共振氢谱检测,判定产物为UDP-葡萄糖醛酸。
该酶促反应中的2种关键酶UGD和LDH分别来源于化脓性链球菌和猪体内。本研究引入LDH减弱反应中的高能副产物对底物的反馈抑制作用,实现NAD+的循环再生,减少昂贵的外源NAD+的添加,从而降低成本;并有利于反应向正方向进行,产率提高了0.9倍,产量约为0.93 mg·mL-1。该反应在体外进行,相对胞内反应,反应更具可控性,更利于反应的进行[20]。由于这2种酶都带有His标签,可将其进行固定,省去纯化等繁琐步骤,实现酶的重复利用,这样可以使用固定化酶多次重复反应,具有更好的经济性,也可以寻求更具高活性的NAD+依赖型氧化还原性酶,来实现更高的UDP-葡萄糖醛酸合成效率。
——α-葡萄糖醛酸酶的研究进展*

