水分胁迫对温室双孢菇动态发育品质及水分利用效率的影响
姬江涛,赵向鹏,王荣先,赵凯旋,马 淏,金 鑫
水分胁迫对温室双孢菇动态发育品质及水分利用效率的影响
姬江涛1,2,赵向鹏1,王荣先3,赵凯旋1,马 淏1,金 鑫1
(1. 河南科技大学农业装备工程学院,洛阳 471003;2. 河南省机械装备先进制造协同创新中心,洛阳 471003;3. 洛阳理工学院机械工程学院,洛阳 471023)
为研究基质水分胁迫对双孢菇全育期内菇形的动态发育、产菇品质的影响,确定温室双孢菇适宜、高效的施水方案,以“奥吉1号”品种为试验材料,于2020年8月进行双孢菇全育期基质水分胁迫试验。该试验设置正常T1(基质饱和持水率的80%~90%)、轻度水分胁迫T2(基质饱和持水率的70%~80%)、中度水分胁迫T3(基质饱和持水率的60%~70%)、重度水分胁迫T4(基质饱和持水率的50%~60%)4种水分处理方案,出菇期测定双孢菇发育动态、单菇品质、区域产菇品质、产量与水分利用效率(Water Use Efficiency,WUE)。结果表明:1)菇盖与菇柄的形态指标、出菇品质与基质含水量呈正相关,菇高受水分胁迫影响不明显。2)盖厚、茎粗、菇高的发育经历逐渐增长、快速增长和缓慢增长3个阶段。在T4水处理下菇厚、茎粗的最大值比T1水处理减少26.1%、24.9%,出菇时间延迟16.5 h(<0.05)。随着水分胁迫的加剧,菇柄与菇盖的生长速率峰值逐步提前,迅速增长期延长。3)在T2水处理下,双孢菇WUE和产菇数最高,相比T1水处理提高2.3%和9.2%(<0.05),出菇产量和优质菇率略低于T1水处理。4)双孢菇结菇前期和后期可进行轻度水分胁迫提高WUE,形成耐旱机制。快速发育期内应保持基质充足含水量,以提高双孢菇品质,加快出菇时间。该研究为双孢菇水分精准管理提供理论依据。
含水率;温室;水胁迫;双孢菇;动态发育;水分利用效率
0 引 言
双孢菇又称白蘑菇,因其常生长2个担孢子而得名,其富含蛋白质和多种维生素、脂肪含量低、营养价值高,深受全球各地消费者的喜爱,至今已有近300年人工栽培历史。菌类工厂化栽培多分布于欧洲、北美等地[1-2],在中国华中、华南地区已经具有一定规模并有向西北地区引进趋势[3]。成熟的双孢菇根据形态、大小有着精细的分级,高品质的双孢菇色泽透白、菇盖肥厚、通体圆滑、质感硬脆;低品质的双孢菇,菇体发育畸形、质感绵软、表层有病斑[4-5]。工厂化栽培环境中的双孢菇在不同发育期内水分、温度、CO2浓度、通风、光线通过现代化技术和设备实现合理控制,能有效避免气候、纬度、降雨量等自然不定因素的干扰。过多施水易致表层积水、滋生杂菌,影响子实体发育制造病害现象;水分缺失严重会影响子实体吸收养分、内部物质积累及各器官分配比重,易导致子实体菇柄细长,发育缓慢,影响双孢菇出菇品质和产量[6]。因此探寻双孢菇对不同水处理条件下响应生长规律对提高出菇品质有着重要意义。
国内外在作物生理对水分胁迫的响应方面已有相当成熟的研究方法和相应结论[7-12]。杨再强等[13]在甜椒的结果期进行水分胁迫试验,研究表明:随着水分胁迫程度的加剧,整体叶面积和果径长度明显减少,果实的生长速率提前到达峰值且数值降低,但轻度胁迫下果实的生长速率相对正常灌溉水平有明显增大且到达最大生长速率的时间有所推迟,水分胁迫下甜椒的单株果实数、果实质量和平均产量都有所降低;张效星等[14]认为亏水会引起作物叶片气孔关闭、光合作用下降,影响作物的干物质分配,导致各器官发育不完善,进而造成其生长受抑制,果实发育缓慢。Gasque等[15-16]以Navelina橘为研究对象,表明轻度亏水处理在节水12%~27%的情况下,果橘的产量没有显著变化,并发现茎水势低于-2 MPa时亏水将会影响果橘的生长品质及整体产量。李雅善等[17-19]在葡萄未转色时实施水分胁迫发现:果实横纵直径发育会随着胁迫程度加剧而减小,进而造成出果产量降低。目前对于设施作物果实发育受水分胁迫影响的研究多为绿色植物[20],其叶面积的发育对水分胁迫同样敏感。与绿色植物不同,菌类生长发育多依靠根部吸收养分,没有叶子进行光合作用,其形态在水分胁迫下会发生显著变化。丁翠英[21]在杏鲍菇工厂化水分调控的研究中,总结菌包发酵、菌丝发育、出菇产菇等阶段的水分管理与基料水分、菇产量之间的相关性规律,得到高效的杏鲍菇生产水分管理模式。郭来民等[22]在食用菌相关研究中发现香菇菌丝阶段基质的最适含水率为58%~60%,子实体阶段基质的最适含水率65%左右。李彤等[23]在双孢菇的高效节水试验中发现,随着供水量增加,双孢菇的菇高、菇盖直径、菌丝长势、菌丝质量有着不同程度变化。供水量每次为400 mL/m2时,双孢菇的生长量达到最大,水分利用效率与经济状况达到最佳,水转化效益高。前人对双孢菇生长发育与水分之间规律的研究,多从出菇后子实体形态和产量来判断水分对子实体发育影响[24],从结菇到第一潮菇出菇约为1周内子实体的动态发育受水分影响的规律没有相关研究。不同程度水分胁迫后子实体动态生长变化值得探究。
利用自研温室环境控制系统,研究不同基质水分方案下双孢菇全育期动态发育规律,分析出菇阶段双孢菇品质指标、产量及水分利用效率对不同水分亏缺的响应结果,进而探讨双孢菇对培养料水分的生态适应性机理。精化温室双孢菇生长阶段适宜的施水方案,提高出菇品质和水分利用效率,为建立双孢菇生长模拟模型、完善自适应环境管控系统,打造智慧化食用菌工厂提供理论基础。
1 材料与方法
1.1 试验区概况
试验于2020年8—10月在河南科技大学食用菌智慧工厂实验室内进行。实验室由宽3 m 、长7 m的菇房和宽4 m 、长7 m的控制室组成。温室环境控制系统能够将菇房内温度、湿度、CO2调节到设定范围[25-26]。双孢菇的栽培过程环境要求:子实体适宜生长温度为16~25 ℃,适应空气湿度85%~90%,二氧化碳浓度以1 000~5 000mol/mol为宜[27-28]。菇房内搭建一列四层的菇床,1层菇床可摆置18包培养基料包。培养基料由洛阳奥吉特有限公司供试。培养基质饱和持水率为78%,主要为腐熟后的麦草和牛粪[29],按一定比例混制发酵而成,配置尿素、硫酸铵、过磷酸钙、石灰、石膏、草木灰。基料pH值为8.95。
1.2 试验设计
第1潮菇从菌丝生长到出菇整个生育期为10~15 d左右。供试基料包尺寸规格相同、基质养肥均匀。培养料含水率按照梯度大小设置4个水处理:正常水处理T1(基料饱和持水率的80%~90%)、轻度水分胁迫T2(基料饱和持水率的70%~80%)、中度水分胁迫T3(基料饱和持水率的60%~70%)、重度水分胁迫T4(基料饱和持水率的50%~60%)。每个处理的区域为1 m2,设3个不连续小区,共12个试验区域,将基料包均匀码放在同层菇床上后进入发酵工序。约两周后,基料表层出现菌团,并开始逐步扩散。将基质包上塑料袋拆除,同时用薄板隔分出12个试验区域。一周后菌丝长势良好且菌料呈现红褐色时进行覆土。基料包上层菇架安置CO2浓度传感器(RS-CO2-NO1-2,仁硕电子科技有限公司,济南,中国)和温湿度传感器(RS-WS-N01-2仁硕电子科技有限公司,济南,中国)。将土壤湿度传感器(RS485,仁硕电子科技有限公司,济南,中国)埋在基料约15 cm深处,采集培养料含水率信息。采集频率为60 min。经计算保留每天的平均值。
在双孢菇不同生长期内提供适宜的环境温度和湿度是保证其正常生长和发育的前提。双孢菇发育过程中,菇房内温度和湿度的调控至关重要。本试验过程中环境温度、温度和CO2浓度由自主研发的菇房环境调控系统进行精准控制[30]。环境信息经中央控制器分析处理后,向执行设备发出控制命令进行菇房温湿环境调控。环境温度、湿度传感器和土壤信息传感器安装布置情况如图1所示。
开启室内环境控制系统保持室内空气湿度在85%左右。通过计算机采集室内温度、湿度、CO2信息等环境信息。试验培养基料摆放完整后,提前进行水分预处理,使其满足菌丝发育的水分条件。当潮菇子实体开始冒出,形似黄豆般大小时,通过自制的水分管理控制系统开启控制电磁阀打开水路,定量施水,辅以喷雾器对各区域进行补充供水,施水额定按照此式计算
式中0为喷水强度,L/(min·m2);为试验区域内喷头数目;为设定喷水时长,min;为喷雾器底面积,mm2;1、2为施水前后容量刻度值,mm;为区域施水量,mL/m2。
1.3 测定指标与方法
1.3.1 子实体形态相关参数的模拟
在每个试验区选取6颗大小相仿、发育良好的双孢菇,做出标记,双孢菇子实体的截面几何模型如图2所示,其关键的形态尺寸包括菇盖最大直径1、柄粗2、菇高1、菇盖厚度2。当子实体发育至豆粒般大小,用游标卡尺测量不同水处理下标记子实体的菇盖、菇柄直径和菇盖厚度;用标准直尺测量菇高(以基质面为原点测量),测量单位均为mm,测量频率为4 h。菇盖厚度、直径、菇高、柄粗的的生长速率计算公式为
式中AGR为子实体菇高、菇柄直径、菇盖厚度的生长速率,mm/h;12为相邻两次时间内测量的数值,mm;12为相邻两次测定的时间,h。
注:1为菇盖直径,mm;2为菇柄直径,mm;1为菇高,mm;2为菇盖厚度,mm。
Note:1is the diameter of mushroom cover, mm;2is the diameter of mushroom stalk, mm;1is the height of mushroom, mm;2is the thickness of mushroom cover, mm.
图2 子实体截面几何模型
Fig.2 Geometric model of sub-solid section
1.3.2 双孢菇品质测定
双孢菇品质主要从2方面来判断,一方面通过区域内采收统计优质菇比例和畸形菇及病菇的数量。另一方面通过质构仪质地多面分析TPA(Texture Profile Analysis)试验法,对不同水处理下的双孢菇进行品质分析。试验仪器质构仪图3a型号TA.XTC.16(上海保圣实业发展有限公司,上海,中国)。参数设定为预压速度1 mm/s,下压、上行速度同为2 mm/s,2次下压间隔预留时间为5 s,当试样受压形变40%,触发力为0.3 N得到质地特征曲线,如图3b。其中表征双孢菇质地的参数有:硬度、凝聚性、弹性、咀嚼性。
1.3.3 区域产量
当双孢菇达到出菇标准即菇盖直径大小达到40 ~45 mm,开始通过人工陆续收采,直到第一潮菇发育期结束。将菇床清理完毕,记录每次的出菇数量和质量。最终产量为区域内第一潮菇采摘后累计的总量。
1.3.4 水分利用效率ETa
试验区水分平衡公式为[20]
式中为全育期降水量,mm;为降水小于一定界限值的降水量,mm;为施水量,mm;△为全育期内土壤储水的变化量,mm。因本试验为室内试验,、都为0。通过区域产量、基质耗水量及灌水量计算各水处理下双孢菇的水分利用效率WUE(Water Use Efficiency)公式为
式中为区域采收双孢菇产量,kg/m2;水分利用效率(WUE)为区域产量与全育期施水总量与培养料储水变化之和的比值,kg/m3。
1.4 双孢菇子实体形态指标生长模型
生长曲线用来描述大多数事物发展过程中经历的开始、发展、成熟3个阶段,每一段的持续时间和发展速率与事物本身性质密切相关[31-32]。本文选择Logistic模型曲线与双孢菇形态发育信息进行回归拟合,求得基础参数。Logistic模型广泛的用于描述和预测个体生长动态发育模拟及经济特性的领域,其适应性与解释性较强,计算与公式相对简单,适用于大多数作物的生长规律。
Logistic模型曲线方程为
式中为所测物质增长量(本文中为菇高、柄粗、盖厚,mm);为双孢菇从结菇到出菇的生长时间,h;为所测量的极限值;、为基础参数,e为自然对数的底数。对Logistic生长函求一阶导数,得到生长曲线的速率函数为
对Logistics曲线生长的速率函数求一阶导数,并令其等于零得到生长速率高峰时间点1。
1= (ln)/(8)
当=(ln)/时,其达到生长速率的最大值max。
对Logistics生长速度函数求二阶导数,并令其等于0得
2= (ln-1.317)/,3= (ln+1.317)/(11)
式中2、1、3分别对应双孢菇物质增长量的开始迅速增长时间点(始盛点)、增长高峰时间点(高峰点)、结束迅速增长时间点(盛末点)。双孢菇生长过程中形态指标变化渐增期为(0,2),快速增长期为(2,3),缓增期为3以后。
1.5 数据计算与处理
试验数据使用SPSS软件进行求平均值、误差分析和差异显著性测定,运用OriginPro 2016进行相关的拟合统计分析和图表绘制。质构特性、产量、耗水量结果采用均值表示[33]。
2 结果与分析
2.1 试验温室相关环境变化
双孢菇生育期内不同水处理下根系层土壤含水率的变化特征如图4所示。为保证双孢菇的存活率,覆土后统一施水1次,使基质表层无积水即可。前期不同水处理下基质含水率波动较大,后期通过水分管理控制,使基质含水率逐渐稳定在各要求梯度范围内。室内环境温度、基质温度满足双孢菇的栽培要求。在发酵阶段环境温度和基料温度均在25 ℃左右,覆土施水后环境温度有所降低,基料温度控制在28 ℃以下范围。在结菇期内环境温度逐次降低,降至19 ℃。基料温度随之下降到17 ℃。环境相对湿度控制在95%左右,环境相对湿度是菌丝发育阶段获得水分的重要途径。在栽培前期频率保持风机频率在25~35 Hz范围,CO2浓度逐步增加,达到5 000mol/mol。覆土后送风频率降低到18~20 Hz。结菇后控制CO2浓度逐次降低,保持在1 500mol/mol范围内。
2.2 水分胁迫对子实体动态发育的影响
2.2.1 水分胁迫对子实体发育的影响
由图5可知,水分胁迫对双孢菇子实体的菇盖与菇柄发育都有显著影响,导致了双孢菇出菇外观品质的变化。水分胁迫下菇高无明显差异。菇盖厚度、菇柄直径和菇体高度都呈现S型生长曲线。菇盖直径大小是判断采收的依据,与T1水分处理相比,不同程度水分处理下T2、T3、T4双孢菇达到采收标准的时间分别延长8.3、15.6、16.5 h(<0.05)。菇盖厚度开始缓慢增长阶段为0~40 h,线性增长阶段约为40~100 h,100 h后进入缓慢增长阶段,并逐渐稳定。在采收后T2、T3、T4水处理下菇盖厚度为24.6、21.56、18.7 mm相比T1水处理(25.3 mm)减少了2.7%、14.8%、26.1%(<0.05)。菇体高度受水分胁迫的影响不明显,其在不同水处理条件下逐渐增长阶段0~50 h和108 h以后的缓慢增长阶段无明显差异。菇柄直径缓慢增长阶段为0~32 h,呈线性快速增长阶段为32~108 h,108 h后进入缓慢增长阶段,并趋于稳定。菇柄直径随着水分胁迫加剧而减小。在采收后T2、T3、T4水分处理下双孢菇的菇柄直径分别为19.84、17.58、16.11 mm较T1水处理(21.45 mm)减少了7.5%、18.1%和24.9%(<0.05)。
2.2.2 水分胁迫对子实体生长速率的影响
图6a、6b、6c分别为双孢菇菇盖厚度、菇盖直径和菇柄直径生长速率对不同程度水分胁迫的响应结果。由图6可知菇盖厚度生长速率的最大值随着基质含水率的降低而减小,T2、T3、T4水处理下菇盖厚度生长速率峰值分别为0.41、0.36、0.28 mm/h占T1水处理(0.48 mm/h)的85.4%、75%和58.3%,且差异显著(<0.05)。菇盖直径生长速率随着土壤含水率的降低出现不同程度的减小,在20~90 h内菇盖直径生长速率进入稳定期。由图知菇柄直径生长速率的最大值同样随着基质含水率的降低而减小,T2、T3、T4水处理下菇柄直径生长速率峰值分别为0.31、0.29和0.24 mm/h占T1水处理(0.36 mm/h)的86.1%、80.6%和66.7%,差异效果显著(<0.05)。菇盖和菇柄形态及动态发育速率受水分亏缺胁迫影响显著。
2.3 水分胁迫对双孢菇出菇品质的影响
双孢菇的品质一方面从出菇外观品质判断,另一方面对内部质感进行分析。合格的优质菇通体洁白、质地较硬、体态匀称,其实际价值更高。低品质的次品菇外形、质地不满足要求,其价值相对较低,销售获取利润降低。
2.3.1 水分胁迫对双孢菇数量和优质菇比率的影响
在维持1周左右的采摘期内,对符合出菇标准的双孢菇进行分批采摘。分析不同基质含水率下区域产出双孢菇的品质状况。统计各试验区内总出菇的数量和畸形菇、开伞菇、病斑菇的数量。畸形菇包括菇柄细长的高脚菇、并蒂菇和菇盖不圆整的双孢菇,开伞菇为在采收后菇盖下表层伞幕有开裂的双孢菇,病斑菇特征为颜色深黄,菇盖上有褐斑,采摘后需要剔除。统计结果如图 7所示,T2水处理相较T1水处理区域产菇数量增加9.2%,优质菇占总菇数的比例相近(<0.05)。T3、T4水处理下畸形菇、病斑菇、开伞菇数量都明显增加,与T1水处理相比出菇数量减少14.2%和25.7%,优质菇比例下降11.4%、32.8%,且差异效果显著(<0.05)。轻度水分胁迫对双孢菇区域出菇品质无显著差异且致出菇数目增加。严重水分亏缺导致双孢菇畸形率都有了成倍的上升,产菇品质和出菇数目也显著下降。
2.3.2 水分胁迫对双孢菇TPA品质分析影响
由TPA试验得到不同水分处理下双孢菇质地特性的各项参数,从而分析出菇品质标准对水胁迫的响应程度。子实体的硬度、内聚性、咀嚼性与基质含水量呈正相关。如表1所示,随着水分胁迫加剧,子实体硬度下降显著,但轻度水胁迫下,与T1水处理相比差异不明显。子实体硬度直观反映了子实体密实程度。质地测试中子实体弹性与水分胁迫相关性较低,其受水分胁迫的变化不显著(>0.05)。凝聚性反映了子实体内细胞间结合力大小,其随着水分胁迫加剧,呈逐步降低趋势,表现出绵软特性。咀嚼性与硬度相关性很高,其模拟消费者食用时持续咀嚼下果实的抗性。以咀嚼性作为综合品质评价标准可知,T2、T3、T4水处理下子实体的咀嚼性相比T1水处理下分别下降了21.8%、47.9%和70.3%(<0.05)。中度、重度水分胁迫下,双孢菇品质差异显著较大,在双孢菇栽培期间,应通过环境调控尽量避免。
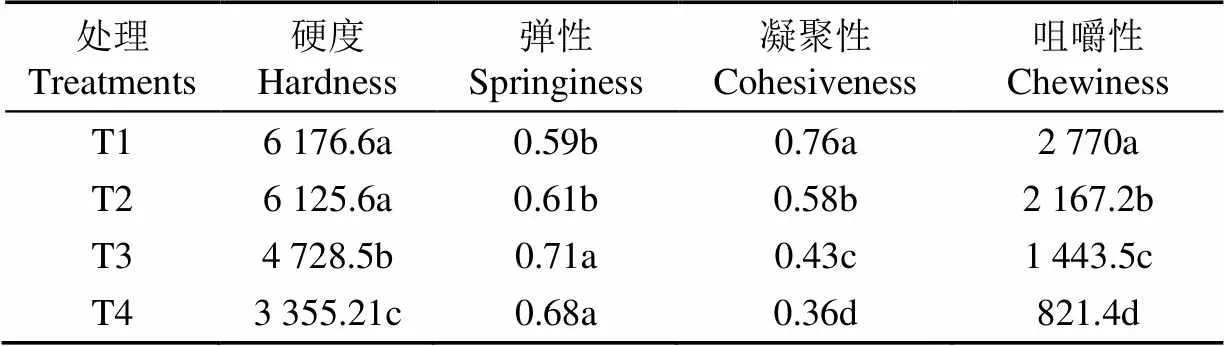
表1 不同基质水处理双孢菇口感品质
注:同列不同小写字母表示处理间差异显著(<0.05)。下同。
Note: Different lowercase letters in the same line indicate significant difference among treatment for same season (<0.05). Same below.
2.4 水分胁迫对双孢菇产量及水分利用效率的影响
不同水处理方案对双孢菇整个生育阶段的影响,在采摘后最终反映在作物的经济产量和水分利用效率上(WUE)。水分利用效率是衡量作物产量和用水量关系的重要指标,也是判断温室栽培水处理方案的决定因素。双孢菇第一潮菇在不同水处理下的产量、耗水量及WUE如表2所示。随着基质含水率的范围梯度下降,双孢菇耗水量、产量和WUE均呈现下降趋势,其差异化显著(<0.05)。与T1水处理下区域双孢菇产量10.416 kg/m2相比,T2、T3、T4水处理下,双孢菇产量分别降低了5.5%、26.3%、39.1%(<0.05)。T2水分胁迫下WUE为23.94 kg/m3,高于其他水处理,相比T1水处理提高约2.3%。T3、T4水处理下WUE相较T1水处理分别降低14.6%和25.3%。
2.5 不同水分处理子实体的Logistic 生长参数模型
经分析可知双孢菇菇柄直径和菇盖厚度在不同水分胁迫下的生长参数受影响显著,对菇盖和菇柄进行Logistic生长曲线拟合(<0.01),得到了模型特征参数。如表3所示,在T4水处理下双孢菇菇柄直径和菇盖厚度生长速率的始盛点、高峰点都显著提前。菇盖厚度与菇柄直径的始盛点相比T1水处理分别提前了21、17 h(<0.05)。T2、T3水处理下菇盖厚度的始盛点、高峰点和盛末点与T1水处理相比有不同程度的推迟(<0.05),但本身两种水处理相比无明显差异。随着水分亏缺的持续加重,菇盖厚度与菇柄直径的快速增长时间也明显延长。与T1水处理相比,T2、T3、T4水处理下菇盖厚度的快速增长时间分别延长了4.1、5.4、10.6 h。菇柄直径的快速增长时间分别延长了10、4.2、7.6 h(<0.05)。其中菇柄直径在轻度胁迫下相较其他水处理迅速增长期持续时间最久。
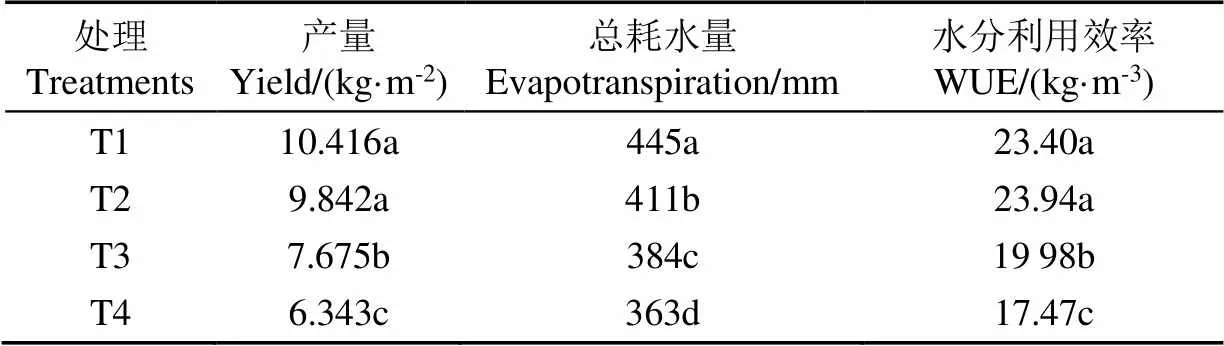
表2 不同水处理下双孢菇产量、耗水量及水分利用效率
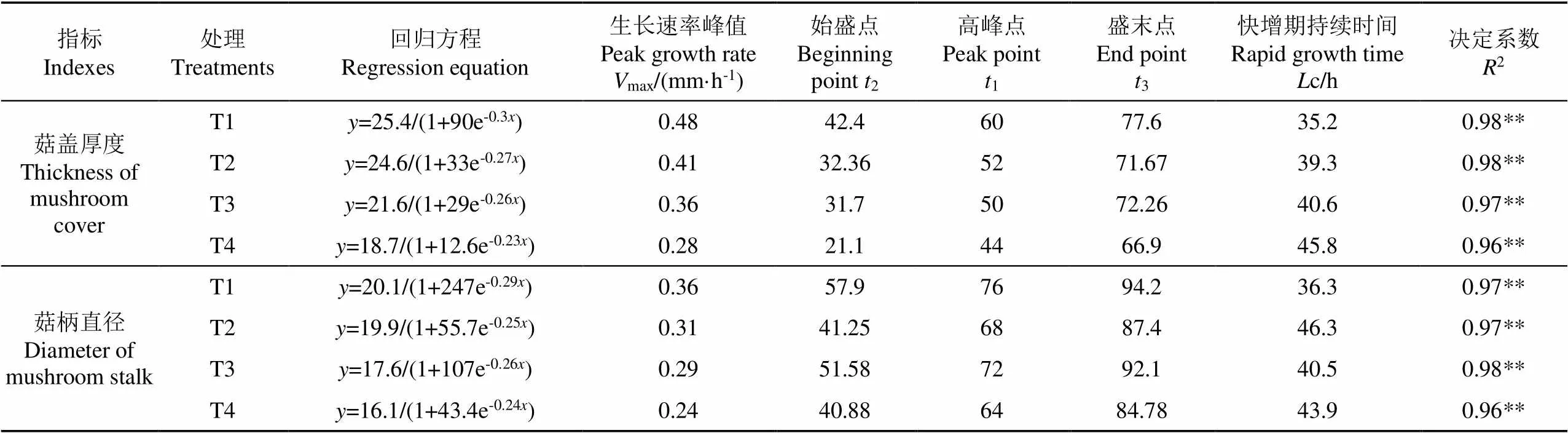
表3 不同水处理下双孢菇菇形指标的Logistic生长模型及特征值
注:*表示0.05水平上显著,**表示在0.01水平上显著相关,为柄粗、盖厚模拟值,mm;为结菇后时间,h。
Note:is the simulation value of stem diameter and cover thickness, mm;is the time after fruiting, h;<0.05(significant.*),<0.01(very significant.**).
研究表明在基质水分亏缺的情况下,双孢菇的形态如柄粗、盖厚的动态发育速率都受到显著影响,在水分胁迫加重时,出菇品质明显下降,畸形菇、开伞菇、病斑菇的数量相比T1水处理有了快速增加,优质菇比例下降明显。双孢菇在生育期内对轻微的水分胁迫有一定的自适应调节能力,轻微适度的水分亏缺锻炼了菌菇的耐旱能力,使物质积累倾斜于根部发育,提高了根部吸水能力,子实体快速发育时间和发育速率峰值提前。在快速增长期内,保持基质正常的含水率,能够为子实体的快速增长阶段提供充足水分,同时保证双孢菇正常的产出品质和产量,在结菇末期,子实体对于基质水分需求量降低,此时适当的水分亏缺对双孢菇的发育和品质未有消极影响。在水分亏缺严重的环境下,子实体不能很好的适应,其物质积累不足,地上、地下部分都不能正常发育。郭来民等[22]在香菇的最适基质水环境研究中,对菌丝日平均生长速率测量后的极差和显著性检测分析发现:香菇不同的发育阶段对于水分的需求不同,快速发育阶段基质含水量过低导致出菇个小、品质差。充足基质水分环境下,菌丝生长速度快、团丝健壮、密盛,子实体优质、高产,与本文试验结论相似。
环境湿度和温度同样是食用菌栽培过程中关键的环境因子。赵丽等[34]在杏鲍菇温湿环境研究中建立了棚内温、湿度机理模型,并通过回归分析得到杏鲍菇产量与菇形的综合预测模型。在菌丝生长的环境影响因子显著程度中温度高于湿度。通过响应面曲线计算出温度25.48 ℃、湿度66.8%下菌丝布满菌袋的最短时间为30.1 d,其对接下来双孢菇温湿环境试验有一定引导意义。在双孢菇基质含水量试验后,结合环境温度与湿度因素。双孢菇环境因素试验需进一步深入,得到重要环境因素的交互影响规律,达到建立双孢菇动态发育与产量综合预测模型的目的。
3 结 论
本文研究了全育期水分胁迫对双孢菇动态发育、品质、水分利用效率的影响,探究菇房高效施水管理方案,得到以下结论:
1)随着基质水分胁迫程度加剧,盖厚和柄粗的最大生长速率降低,生长速率峰值提前,快速增长期显著延长。轻度水分胁迫促进子实体根部发育和营养吸收,与T1水处理相比,盖厚、茎粗中期快速发育时间延长4.1、10 h(<0.05)。过多水分亏缺下,双孢菇质感绵软、畸形菇数目激增,在T4水处理下体现明显。
2)不同水处理下双孢菇产量、耗水量差异显著。与TI水处理相比,T2、T3、T4水处理下产量分别降低5.5%、26.3%、39.1%(<0.05)。双孢菇产量微降前提下,T2水处理下耗水量显著下降,水分利用效率达到最高,相比T1水处理提高2.3%(<0.05)。T2水处理方案在双孢菇部分发育阶段更加节约、高效,经济效益更高。
在结菇前期和期末进行适度水分胁迫(基质饱和持水率的60%~70%),有助于增强双孢菇根部发育,形成耐旱机制,提升整体施水方案的合理性。该研究为食用菌发育环境优化控制提供理论支持。
[1]钱振华,王秦越,何彦虎,等. 食用菌工厂化生产线控制系统设计[J]. 物流技术,2020,39(7):133-136. Qian Zhenhua, Wang Qinyue, He Yanhu, et al. Design of control system of edible fungus factory production line[J]. Logistics Technology, 2020, 39(7): 133-136. (in Chinese with English abstract)
[2]Aisala H, Linderborg K M, Sandell M. Fiber depth, column coating and extraction time are major contributors in the headspace solid phase microextraction gas chro-matography analysis of Nordic wild mushrooms[J]. European Food Research and Technology, 2018, 244(5): 841-850.
[3]杜昌战. 双孢菇高产高效生产及栽培技术[J]. 农业与技术,2018,38(13):47-48. Du Changzhan. High yield and high efficiency production and cultivation techniques of agaricus bisporus[J]. Agriculture & Technology, 2018, 38(13): 47-48. (in Chinese with English abstract)
[4]高振鹏,袁亚宏,岳田利,等. 超声波辅助提取双孢菇多糖的研究[J]. 西北农林科技大学学报(自然科学版),2012,40(7):215-220. Gao Zhenpeng, Yuan Yahong, Yue Tianli, et al. Study on the polysaccharides extraction of agaricus bisporus using ultrasonic[J]. Journal of Northwest A&F University (Natural Science Edition), 2012, 40(7): 215-220. (in Chinese with English abstract)
[5]冯自洋,李守勉,李明,等. 八个双孢菇品种比较试验[J]. 北方园艺,2016(19):160-163. Feng Ziyang, Li Shoumian, Li Ming, et al. Comparison test of eight agaricus bisporus varieties[J]. Northern Horticulture, 2016(19): 160-163. (in Chinese with English abstract)
[6]Gloria B, Carvajal M. Genetic regulation of water and nutrient transport in water stress tolerance in roots[J]. Journal of Biotechnology, 2020, 324: 134-142.
[7]Li S H, Huguet J C, Schuch P G, el al. Response of peach tree growth and cropping to soil water deficit at various physiological stages of fruit development[J]. J Hurt Sci, 1989, 64: 541-552.
[8]Cheryl H P, Chris V, Dean H, et al. Harmonization and translation of crop modeling data to ensure interoperability[J]. Environmental Modelling & Software, 2014, 62: 495-508.
[9]李婷,季宇寒,张漫,等. CO2与土壤水分交互作用的番茄光合速率预测模型[J]. 农业机械学报,2015,46(增刊1):208-214. Li Ting, Ji Yuhan, Zhang Man, et al. Tomato photosynthetic rate prediction models under interaction of CO2enrichments and soil moistures[J]. Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(Suppl.1): 208-214. (in Chinese with English abstract)
[10]胡瑾,隆星月,邓一飞,等. 基于水分利用率与光合速率的温室作物需水模型研究[J]. 农业机械学报,2020,51(10):362-370. Hu Jin, Long Xingyue, Deng Yifei, et al. Water demand model for greenhouse crops considering water use efficiency and photosynthetic rate[J]. Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(10): 362-370. (in Chinese with English abstract)
[11]王丽燕,朱梦婷,李莉,等. 施肥胁迫对温室番茄不同生长期表型数据的影响[J]. 农业机械学报,2017,48(增刊1):321-326. Wang Liyan, Zhu Mengting, Li Li, et al. Influence of different fertilization on phenotypic data of greenhouse tomato in all growth periods[J]. Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(suppl.1): 321-326. (in Chinese with English abstract)
[12]张忠学,陈鹏,郑恩楠,等. 基于Δ13C的不同水氮管理对水稻水分利用效率的影响[J]. 农业机械学报,2018,49(5):303-312. Zhang Zhongxue, Chen Peng, Zheng Ennan, et al. Effect of different water and nitrogen managements on rice leaf water use efficiency based on Δ13C[J]. Transactions of the Chinese Society for Agricultural Machinery, 2018, 49(5): 303-312. (in Chinese with English abstract)
[13]杨再强,侯梦媛,张曼义,等. 水分胁迫对设施甜椒结果期叶面积扩展及果实发育的影响[J]. 农业工程学报,2017,33(12):170-177. Yang Zaiqiang, Hou Mengyuan, Zhang Manyi, et al. Effects of soil water stress on expansion of leaf area and development of fruit in fruiting period of greenhouse sweet pepper[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(12): 170-177. (in Chinese with English abstract)
[14]张效星,樊毅,贾悦,等. 水分亏缺对滴灌柑橘光合和产量及水分利用效率的影响[J]. 农业工程学报,2018,34(3):143-150. Zhang Xiaoxing, Fan Yi, Jia Yue, et al. Effect of water deficit on photosynthetic characteristics, yield and water use efficiency in Shiranui citrus under drip irrigation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(3): 143-150. (in Chinese with English abstract)
[15]Gasque, Granero, Turegano, et al. Regulated deficit irrigation effects on yield, fruit quality and vegetative growth of 'Navelina' citrus trees[J]. Spanish Journal of Agricultural Research, 2010, 8(suppl.2): 40-51.
[16]Gasque, María, Martí, et al. Effects of long-term summer deficit irrigation on 'Navelina' citrus trees[J]. Agricultural Water Management, 2016, 169: 140-147.
[17]李雅善,李华,王华,等. 设施栽培下不同灌溉处理对‘希姆劳特’植株生长及果实的影响[J]. 中国农业科学,2014,47(9):1784-1792. Li Yashan, Li Hua, Wang Hua, et al. Effects of different irrigation treatments on the growth and fruit quality of himrod in protected cultivation[J]. Scientia Agricultura Sinica, 2014, 47(9): 1784-1792. (in Chinese with English abstract)
[18]张芮,王旺田,吴玉霞,等. 水分胁迫度及时期对设施延迟栽培葡萄耗水和产量的影响[J]. 农业工程学报,2017,33(1):155-161. Zhang Rui, Wang Wangtian, Wu Yuxia, et al. Effect of moisture stress level and stage on evapotranspiration and yield of grape under protected and delayed cultivation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(1): 155-161. (in Chinese with English abstract)
[19]张芮,成自勇,王旺田,等. 水分胁迫对延后栽培葡萄果实生长的影响[J]. 华南农业大学学报,2015,36(6):47-54. Zhang Bing, Cheng Ziyong, Wang Wangtian, et al. Effect of water stress on grape fruit growth under delayed cultivation[J]. Journal of South China Agricultural University, 2015, 36(6): 47-54. (in Chinese with English abstract)
[20]龚雪文,刘浩,孙景生,等. 日光温室番茄不同空间尺度蒸散量变化及主控因子分析[J]. 农业工程学报,2017,33(8):166-175. Gong Xuewen, Liu Hao, Sun Jingsheng, et al. Variation of evapotranspiration in different spatial scales for solar greenhouse tomato and its controlling meteorological factors[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(8): 166-175. (in Chinese with English abstract)
[21]丁翠英. 不同栽培基质对杏鲍菇品质及收益的影响[J]. 中国食用菌,2020,39(9):18-21. Ding Cuiying. Effects of different cultivation media on quality and economic benefits of pleurotus eryngii[J]. Edible Fungi of China, 2020, 39(9): 18-21. (in Chinese with English abstract)
[22]郭来民,刘文晖. 香菇对水分的要求及调控措施[J]. 食用菌,2013,35(4):49-50. Guo Laimin, Liu Wenhui. Water requirement and control measures of lentinus edodes[J]. Edible Fungi, 2013, 35(4): 49-50. (in Chinese with English abstract)
[23]李彤,高世铭,张朝巍,等. 不同灌水处理对日光温室双孢菇的生长及水分利用效率的影响[J]. 甘肃农业大学学报,2006,(6):53-57. Li Tong, Gao Shiming, Zhang Chaowei, et al. Effects of different supplying water treatments on development and water utilizing efficiency of agaricus bisporus in sunlight greenhouse[J]. Journal of GanSu Agricultural University, 2006, (6): 53-57. (in Chinese with English abstract)
[24]Sepulcre-Canto G, Gellens-Meulenberghs F, Arboleda A, et al. Estimating crop-specific evapotranspiration using remote-sensing imagery at various spatial resolutions for improving crop growth modelling[J]. International Journal of Remote Sensing, 2013, 34(9/10): 3274-3288.
[25]杜尚丰,何耀枫,梁美惠,等. 物联网温室环境调控系统[J]. 农业机械学报,2017,48(增刊1):296-301. Du Shangfeng, He Yaofeng, Liang Meihui, et al. Greenhouse environment network control system[J]. Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(Supp.1): 296-301. (in Chinese with English abstract)
[26]Ebrahimi-Mollabashi E, Huth N, Holzwoth D P, et al. Enhancing APSIM to simulate excessive moisture effects on root growth[J]. Field Crops Research, 2019, 236: 58-67.
[27]耿宇聪,张涛,刘宏斌,等. 不同压块模式对双孢菇生产的影响[J]. 农业工程学报,2016,32(增刊2):275-278. Geng Yucong, Zhang Tao, Liu Hongbin, et al. Effects of different briquetting modes on production of agaricus bisporus[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(Supp.2): 275-278. (in Chinese with English abstract)
[28]尤宇新,吴向格,胡自向,等. 双孢菇新品种W192的高产优质高效栽培技术初探[J]. 农业科技通讯,2019,(3):245-247. You Yuxin, Wu Xiangge, Hu Zixiang, et al. Preliminary study on high yield, good quality and high efficiency cultivation techniques of new agaricus bisporus W192[J]. Bulletin of Agricultural Science and Technology, 2019, (3): 245-247. (in Chinese with English abstract)
[29]Roland B. Simulating the yields of bioenergy and food crops with the crop modeling software BioSTAR: The carbon-based growth engine and the BioSTAR ET0 method[J]. Environmental sciences Europe, 2014, 26(1): 1-9.
[30]朱雪峰,赵凯旋,姬江涛,等. 双孢菇工厂化生产环境因子调控系统设计[J]. 农机化研究,2021,43(2):156-162. Zhu Xuefeng, Zhao Kaixuan, Ji Jiangtao, et al. Design and experiment of environmental factor control system for industrialized production of agaricus bisporus[J]. Journal of Agricultural Mechanization Research, 2021, 43(2): 156-162. (in Chinese with English abstract)
[31]崔党群. Logistic曲线方程的解析与拟合优度测验[J]. 数理统计与管理,2005(1):112-115. Cui Dangqun. Analysis and making good fitting degree test for logistic curve regression equation[J]. Application of Statistics and Management, 2005(1): 112-115. (in Chinese with English abstract)
[32]Thomas S A, Brick L A D, Micalizzi L, et al. Parent-adolescent relationship characteristics and adolescent cannabis use: A growth curve analysis[J]. The American Journal of Drug and Alcohol Abuse, 2020, 46(5): 1-11.
[33]Kenny Q, Hamada, Michael. A step-down lenth method for analyzing unreplicated factorial designs[J]. Journal of Quality Technology, 2001, 33(2): 140-152.
[34]赵丽,朱学军,白雪萍,等. 杏鲍菇栽培环境湿度建模与控制器设计及仿真[J]. 中国农机化学报,2016,37(6):79-83. Zhao Li, Zhu Xuejun, Bai Xueping, et al. Build model for humidity of the pleurotus eryngii cultivation environment and controller design and simulation[J]. Journal of Chinese Agricultural Mechanization, 2016, 37(6): 79-83. (in Chinese with English abstract)
Effects of water stress on dynamic development quality of Agaricus bisporus and water efficiency in greenhouse
Ji Jiangtao1,2, Zhao Xiangpeng1, Wang Rongxian3, Zhao Kaixuan1, Ma Hao1, Jin Xin1
(1.,,471003,; 2.,471003,; 3.,,471023,)
This study aims to examine the effect of matrix water on the expansion of mushroom shape, thereby determining the efficient water application of Agaricus bisporus in a greenhouse. A matrix water stress test of Abisporus bisporus during the whole growth period was conducted in the greenhouse in Henan University of Science and Technology of China in August 2020. The “Aoji No. 1” variety was taken as experimental material. An environmental control system was developed to adjust the temperature, air humidity, and CO2concentration in the greenhouse. Four groups of matrix moistures were set at the saturated water holding rate of 80%-90% (full water treatment, T1), 70%-80% (light stress, T2), 60%-70% (moderate stress, T3), and 50%-60% (severe stress, T4). A sensor of soil moisture RS485 was selected to monitor the water content of substrate soil. The key parameters were determined, including the development morphological index, single mushroom quality, regional mushroom quality, yield, and water use efficiency of Agaricus bisporus during the fruiting period. The results showed that: 1) The thickness of mushroom cover and the stalk diameter were evidently reduced with the increase of soil water stress. There was no significant influence of soil water stress on the height of mushrooms. The maximum thickness of mushroom cover and stalk diameter decreased by 26.1% and 24.9% under severe stress of soil water. The harvest time was delayed by 16.5 h, when the size of mushroom cover was used as the index of fruiting, compared with full water treatment (< 0.05). 2) The gradual, rapid, and slow growth stages were included in the development of cover thickness, stalk diameter, and mushroom height. Soil water stress reduced the peak of growth rate for the thickness of mushroom cover. The peak growth rate of mushroom stalk and cover were gradually advanced, whereas, the rapid growth time was prolonged significantly with the aggravation of soil water stress. Compared with full water treatment, the rapid growth time for the thickness of mushroom cover under light stress, moderate stress, and severe stress delayed by 4.1, 5.4, and 10.6 h, respectively, whereas, the rapid growth time of stalk diameter delayed by 10, 4.2, and 7.6 h, respectively, (<0.05). 3) The overall quality, yield, and water use efficiency of Agaricus bisporus reduced with the increase of soil water stress. The number of diseased spots and malformed mushrooms increased sharply under moderate and severe water stress, resulting in the decrease of high-quality mushroom yield. The yield of Agaricus bisporus under the mild, moderate, and severe soil water stress decreased by 5.5%, 26.3%, and 39.1%, respectively, (< 0.05), compared with full water treatment. Water use efficiency and the number of Agaricus bisporus reached the highest under the mild water stress, increasing by 2.3%, and 9.2%, respectively, compared with full water treatment (< 0.05). Fruiting- and high-quality mushroom ratio under the mild water stress were slightly lower than those of full water treatment. 4) The soil water stress during the whole growth period of Agaricus bisporus led to the changes of fruiting body and texture of monomer, as well as the reduction of yield and high-quality ratio. Appropriate soil water stress prolonged the period of rapid growth stage without affecting the quality of Agaricus bisporus. Mild water stress can be carried out in the gradual growth stage (0-40 h), and slow growth stage of mushroom to increase water use efficiency. The sufficient water content of the substrate should be maintained during the rapid development period (40 h-100 h). Water deficit treatment should not be carried out to improve the development rate and quality of Agaricus bisporus. This finding can offer an efficient application of water control in fungi substrate suitable for the precise management of water in Agaricus bisporus production.
water content; greenhouse; water stress; agaricus bisporus; dynamic development; water use efficiency
姬江涛,赵向鹏,王荣先,等. 水分胁迫对温室双孢菇动态发育品质及水分利用效率的影响[J]. 农业工程学报,2021,37(6):205-213.doi:10.11975/j.issn.1002-6819.2021.06.025 http://www.tcsae.org
Ji Jiangtao, Zhao Xiangpeng, Wang Rongxian, et al. Effects of water stress on dynamic development quality of Agaricus bisporus and water efficiency in greenhouse[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(6): 205-213. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.06.025 http://www.tcsae.org
2020-11-25
2021-01-31
国家自然科学基金面上项目(51975186);国家重点研发计划(2019YFE0125100)。
姬江涛,博士,教授,博士生导师,研究方向为农业智能化技术与装备、食用菌工厂化生产技术与装备。Email:jjt0907@163.com
10.11975/j.issn.1002-6819.2021.06.025
S274.3
A
1002-6819(2021)-06-0205-09

