瓜子金皂苷己通过SOCS3抑制氧糖剥夺/复氧所致小胶质细胞的炎症反应*
高 燕,付旭阳,贺 帅,高 冰,石瑞丽,4
(1.包头医学院基础医学与法医学院生理学教研室,内蒙古 包头 014040;2.包头医学院神经科学研究所;3.包头医学院基础医学与法医学院病理学教研室;4.内蒙古自治区低氧转化医学重点实验室;5.达拉特旗人民医院检验科)
脑卒中是常见的急性脑血管类疾病,其中缺血性卒中最为常见,其发病率、致残率、致死率都较高,主要的药物治疗方法有溶栓治疗、抗凝治疗、抗血小板聚集治疗、神经保护治疗等。其中缺血后通过溶栓尽快恢复脑血流量是挽救尚未梗死脑组织的有效方法,但恢复血液灌注后会诱发更为严重的脑缺血再灌注(cerebral ischemia reperfusion,CIR)损伤。CIR损伤发生机制复杂,其中炎症反应不仅在疾病发病期起重要作用,影响神经功能损害的程度[1],也与疾病预后密切相关。过度和持续的炎症反应不仅影响脑血管血流,而且可以直接破坏组织结构,造成缺血脑组织损伤。
CIR损伤发生时各种炎性细胞因子均需通过细胞信号转导发挥效应,其中Janus 激酶/信号转导与转录激活子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)信号通路与CIR损伤存在密切关联,是神经系统中重要的免疫反应及炎症反应的经典途径[2]。该通路的负反馈调控因子细胞因子信号抑制因子3(Suppressors of cytokine signaling3, SOCS3)在炎症反应中被炎性细胞因子激活,可通过负反馈抑制JAK2/STAT3信号通路的激活从而减轻炎症反应。SOCS3作为CIR损伤后的上调基因,可能参与了损伤后炎症反应的调节与修复,也可能参与了脑细胞凋亡的调节过程,起到内源性神经保护的作用。
瓜子金皂苷己(Polygalasaponin F, PGSF)是从远志科远志属植物瓜子金中提取的齐墩果烷型三萜皂苷类化合物,传统医学中主要用于散郁助眠、益智安神、解毒消肿。有研究发现PGSF可抑制LPS诱导的BV-2细胞炎症模型中IL-1β的表达[3]。本课题组也在该模型中发现,PGSF可降低一氧化氮合酶和环氧合酶-2的蛋白及mRNA表达[4]。但PGSF对氧糖剥夺/复氧(Oxygen and glucose deprivation/reoxygenation,OGD/R)所致BV-2细胞激活分泌的作用及其作用机制,目前尚无报道。本研究拟在细胞水平应用OGD/R模型诱导BV-2小胶质细胞神经炎症,以模拟脑缺血再灌注后炎症反应,初步观察PGSF能否降低炎症因子的表达水平,该作用是否与SOCS3表达相关。通过实验进一步明确PGSF的体外抗炎机制,为PGSF的开发应用提供实验基础和理论线索。
1 材料与方法
1.1实验细胞 小鼠BV-2小胶质细胞瘤细胞,购自中国医学科学院药物研究所。
1.2试剂与仪器
1.2.1试剂 胎牛血清、高糖DMEM培养基购自Gibco公司,TRIZOL试剂购自thermo fisher公司,QPCR试剂盒购自上海海方生物技术有限公司。
1.2.2仪器 超速低温冷冻离心机购自德国eppendorf公司,细胞缺氧试验培养箱系统购自Billups-Rothenberg公司,荧光定量pCR仪购自ABI公司,酶标仪购自thermo fisher公司。
1.3实验方法
1.3.1BV-2小胶质细胞培养及OGD/R模型的建立 将细胞置于含10 %胎牛血清和高糖DMEM的完全培养基中,于37 ℃、5 % CO2条件下培养,细胞长至70 %~80 %传代,选择对数生长期细胞进行实验。将BV-2细胞以2.5×105个/孔的密度接种于6孔板,培养24 h后换为无糖eagle液,置于缺氧装置中2 h。设置缺氧装置气体流量为20~25 L/min,持续充氮气5 min后将细胞放入,取出后重新在完全培养基中于正常条件下培养以完成复氧复糖,6 h后收集细胞用于后续实验。
1.3.2实验分组及处理 细胞分为5组。(1)Control组:将培养基换为含糖eagle+葡萄糖溶液孵育2 h,之后换为完全培养基培养6 h;(2)OGD/R模型组:将培养基换为无糖eagle溶液后放入缺氧装置中孵育2 h,之后换为完全培养基继续培养6 h;(3)OGD/R+PGSF-L组:将培养基换为含PGSF(0.1 μmol/L)的无糖eagle溶液置缺氧装置中2 h,再将孵育液换为含0.1 μmol/L PGSF的完全培养基继续培养6 h;(4)OGD/R+PGSF-M组:与OGD/R+PGSF-L组相同处理,PGSF浓度为1.0 μmol/L;(5)OGD/R+PGSF-H组:与OGD/R+PGSF-L组相同处理,PGSF浓度为10.0 μmol/L。
1.3.3QPCR检测基因表达 应用Trizol法提取细胞总RNA,根据反转试剂盒说明书进行mRNA反转录,应用实时荧光定量多聚酶链式反应(Real-time Quantitative PCR,QPCR)扩增cDNA。扩增体系:预变性95 ℃ 10 min、95 ℃ 15s~60 ℃ 60 s循环40次、溶解曲线75 ℃~95 ℃,每20 s升温1 ℃。结果处理采用ΔΔCT法:A=CT(目的基因,待测样本) - CT(内标基因,待测样本)、B=CT(目的基因,对照样本) - CT(内标基因,对照样本)、K=A-B、表达倍数=2-K。引物设计根据GenBank已发表的基因序列,利用primer premier 5.0软件设计NKCC1基因的pCR扩增引物,并同时设计内参β-actin基因扩增引物进行检测。引物由上海生工公司合成,序列见表1。

表1 目的基因引物序列

2 结果
2.1PGSF对TNF-α基因表达的影响 与正常对照组比较,OGD/R损伤后模型组BV-2细胞的TNF-α基因出现高表达(P<0.05);PGSF-L组、PGSF-M组、PGSF-H组TNF-α表达均明显低于模型组,差异具有统计学意义(P<0.05或P<0.01)。说明PGSF能够降低OGD损伤后的TNF-α高表达,且呈浓度依赖性。见图1。

图1 PGSF对TNF-αmRNA表达的影响
2.2PGSF对IL-1β基因表达的影响 与正常对照组相比,OGD/R损伤后模型组BV-2细胞的IL-1β基因表达明显升高(P<0.01);PGSF-L组、PGSF-M组、PGSF-H组IL-1β表达均明显低于模型组,差异具有统计学意义(P<0.01)。说明PGSF能够降低OGD损伤后的IL-1β高表达的情况,且呈浓度依赖性。见图2。

图2 PGSF 对IL-1β mRNA 表达的影响
2.3PGSF对IL-6基因表达的影响 与正常对照组相比,模型组BV-2细胞的IL-6基因出现高表达(P<0.05);PGSF-L组、PGSF-M组、PGSF-H组IL-6均明显低于模型组,差异具有统计学意义(P<0.01)。结果说明PGSF能够降低OGD损伤后的IL-6高表达的情况,且呈浓度依赖性。见图3。
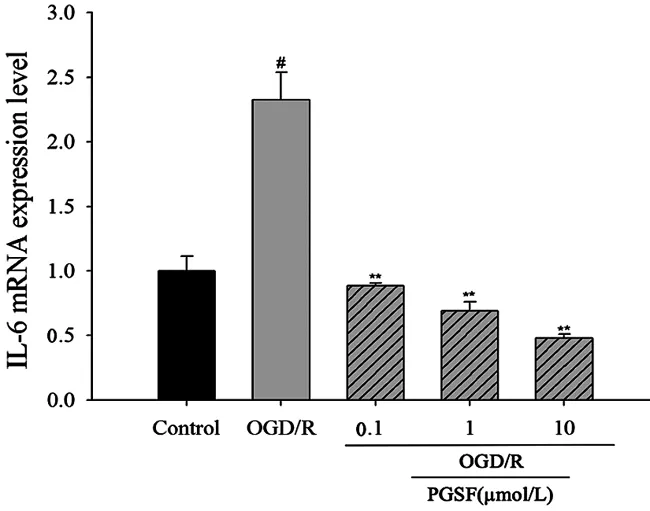
图3 PGSF对IL-6mRNA 表达的影响
2.4PGSF对SOCS3基因表达的影响 与正常对照组相比,模型组BV-2细胞的SOCS3基因出现高表达(P<0.01);PGSF-M组和PGSF-H组SOCS3表达明显低于模型组,差异具有统计学意义(P<0.05,P<0.01)。说明PGSF能够降低OGD损伤后的SOCS3高表达,且高剂量最佳。见图4。

图4 PGSF对SOCS3mRNA表达的影响
3 讨论
脑缺血再灌注损伤的发生机制复杂,兴奋性毒性、氧化应激、细胞凋亡等都会参与,其中,缺血后炎症反应在缺血性疾病的发生和发展进程中扮演着重要的角色。脑组织中主要的免疫应答细胞—小胶质细胞激活介导的炎症反应是导致脑I/R损伤的重要机制。神经损伤后产生的细胞碎片、自由基、活性氧等均可激活小胶质细胞,激活后的小胶质细胞迅速释放TNF-α、IL-1β、IL-6等促炎因子[5],放大炎症级联反应,促炎因子又可激活小胶质细胞,形成恶性循环[6]。本研究采用BV-2细胞制备OGD/R模型,是脑I/R损伤常用的体外缺血模型,能够很好地模拟神经元及神经胶质细胞的I/R损伤。结果发现缺氧处理后BV-2细胞明显被激活,细胞呈球状“阿米巴样”,给予PGSF可明显减轻形态学的改变;采用QPCR的方法检测各组细胞的炎性因子基因表达情况,发现BV-2细胞在OGD/R后表达了大量炎性因子,而PGSF可降低OGD/R处理后的炎性因子基因表达。说明PGSF能够抑制小胶质细胞激活,减少小胶质细胞释放炎性因子。
SOCS3作为细胞因子信号的负调控因子,可被多种细胞因子诱导生成,同时又可对相应的信号转导途径进行负性调节,应用这种方式维持内环境的稳态[7]。在经典炎症相关的JAK2/STAT3信号通路中,SOCS3本身是STAT3调节基因转录的产物之一,但又能负反馈抑制JAK2/STAT3信号的级联反应[8]。本研究预期给予PGSF干预可通过促进SOCS3表达抑制炎症相关信号通路进而发挥抗炎作用,但是与预期相反的是,SOCS3的表达不但没有上调反而出现了下降。为了解释这个现象我们需要对影响SOCS3表达的诸多因素进行综合分析。SOCS3可受多种信号通路的调节。比如汉黄芩素可以通过PI3K介导的MAPK信号通路激活、AP-1共有序列和STAT响应元件的激活诱导SOCS3生成,Toll样受体激活也诱导SOCS3表达。已有研究表明[9],在LPS诱导的BV-2细胞神经炎症模型中,PGSF是通过调节TLR4-PI3K/AKT—NF-κB信号通路减少神经炎性细胞因子的分泌,PGSF可以抑制炎症模型中TLR4表达、下调MAPK信号通路的p38磷酸化水平并抑制NF-κB核移位[10],而这些分子功能的抑制又可能导致SOCS3表达水平的降低。提示在PGSF的抗炎作用中,有多种信号转导途径参与,这些信号通路之间又存在复杂的交互作用。
本研究在细胞分子水平观察了PGSF在脑I/R损伤中的抗炎症作用,并发现PGSF能够降低SOCS3mRNA的表达,提示SOCS3相关信号通路可能介导了PGSF的抗炎作用,为PGSF防治缺血性脑病的研发工作提供了新的实验依据。

