IVF-ET周期中胚胎污染的实验室与临床结局分析
杜凤娇,李瑞岐,朱玉琴,欧阳能勇,区颂邦,王文军
(中山大学孙逸仙纪念医院生殖中心,广东广州 510120)
在体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)周期中,为使配子和胚胎在体外能够良好的生长发育,体外受精(in vitro fertilization,IVF)实验室执行严格的质量控制与管理,包括实验室仪器设备、培养用耗材与培养液、技术人员、培养环境等,实验室程序和操作的每一步都必须以严格的无菌技术纪律进行。然而人类泌尿生殖系统不能被认为是完全无菌的,经阴道穿刺所获卵泡液及手淫法所获精液可能携带微生物,胚胎在体外培养的各个环节也易受到微生物的污染,种种原因均会导致IVF-ET周期中胚胎污染事件的发生,并且难以杜绝[1-2]。由于胚胎污染最终导致的无可移植胚胎,不仅给患者带来时间和金钱的损失,也带来一定的精神损害[3]。最大程度地避免胚胎污染事件发生,制定有效的胚胎污染处理措施尤为重要。目前对于IVF-ET周期中胚胎污染的研究报道较少,国内外分别报道过最多38例[4]和97例[5]胚胎污染的发生,但其纳入的总样本量、研究年限等均带有局限性,此外,对于污染周期在体外培养不同天数下卵泡液、精液、培养液相关标本的污染发现率,三种标本的细菌类型差异比较,以及胚胎在新鲜周期和解冻周期移植后的临床结局比较尚未见报道。本研究纳入了10 年的胚胎污染资料,样本量接近3 万周期,全面系统的分析了IVF 实验室胚胎污染周期的各项数据,比较了胚胎污染发生的频率、污染原因、污染微生物种类、以及污染周期的实验室培养及临床结局数据,旨在探讨IVF 实验室胚胎污染的发生情况,明确胚胎污染周期的实验室及临床结局,以期为建立更完善的IVF 实验室胚胎培养体系提供依据。
1 材料与方法
1.1 研究对象
本研究统计了2010 年1 月1 日至2020 年12 月31 日在中山大学孙逸仙纪念医院生殖中心的29 583 个IVF-ET 周期资料,纳入的周期受精方式包括体外受精(IVF)、卵胞浆内单精子注射(intracytoplasmic sperm injection,ICSI)、半体外受精半卵胞浆内单精子注射(IVF-ICSI split insemination,h-ICSI)、补救性卵胞浆内单精子注射(rescue intracytoplasmic sperm injection,R-ICSI)四种类型。未获卵周期及冻卵周期未纳入。本研究已通过中山大学孙逸仙纪念医院伦理委员会批准,所有污染周期胚胎去向决定均经过患者知情同意。
1.2 方法
1.2.1 污染的判断 在胚胎体外培养的第1~3 天,若在高倍镜下观察到培养液滴出现不明杂质,部分表现为高密集性或高活动性,同时部分患者的胚胎培养液滴肉眼观察伴有轻度或重度浑浊,或部分患者胚胎出现不明原因的大量退化或死亡,随后对患者取卵日留存的卵泡液和精液取样,高倍镜下镜检发现类似的高密集性或高活动性的不明杂质,或精子大量死亡,则初步判断为疑似微生物污染。
1.2.2 污染胚胎的处理 发现污染后,立即用提前平衡好的新的培养液对污染胚胎进行反复洗涤,做到一个胚胎一根移卵针,每个胚胎洗涤所用培养液不混用。污染严重时采用在洗涤液中添加抗生素、胚胎透明带削薄或去透明带等特殊方法处理。处理好的胚胎移入新的培养皿和独立的传统培养箱或Time-lapse 培养箱中继续培养,并持续观察。后续培养中如发现污染再次出现,采用同样的处理方法。被污染的胚胎在处理后一般均选择囊胚培养,以鉴别后续是否继续存在污染,最终选择处理成功不继续带菌的胚胎进行移植或冷冻。
1.2.3 污染标本的送检与微生物鉴定 发现胚胎污染后,及时让患者知情,在做出送检建议后征求患者意见是否需要送检污染标本。本研究有12 例污染周期的患者拒绝送检。需送检的周期在污染发现当天分别收集患者取卵日留存的卵泡液标本、精液标本、以及污染胚胎所在培养液滴的培养液标本,注意严格的无菌操作。收集的标本送至本院检验科进行微生物培养与鉴定,3~5 d 后获得鉴定结果。
1.2.4 移植前胚胎和患者的准备 本研究污染周期所有移植的胚胎在移植前均已确认不存在微生物污染,并已告知患者详情征得患者同意。解冻周期首选囊胚培养后移植以再次鉴别胚胎是否存在污染。发生污染的患者在移植胚胎前,临床医生会根据患者检查结果决定是否采用抗生素治疗。如发现女方存在感染或炎症等不适宜胚胎移植的情况,将会选择冻胚,治疗结束后再解冻移植。
1.2.5 污染周期分组及结局评价 全污染组指患者本周期的所有胚胎均出现污染;部分污染组指在培养结束前只有部分胚胎污染,部分胚胎未污染;无可用胚胎周期指患者本周期没有可以移植或冷冻的胚胎,所有胚胎均丢弃;养成囊胚周期指形成三级及以上的可用囊胚;临床妊娠指患者移植后超声检查见孕囊及胎心;活产指患者移植后获得活胎分娩;本研究的不良妊娠包括晚期自然流产和生化妊娠两种,其中晚期自然流产指孕12~28 周内的自然流产,生化妊娠指移植2 周后测外周血人绒毛膜促性腺激素(β-hCG)≥50 U/L,此后自然流产,且移植后3~4周B超未检测到宫内或宫外妊娠孕囊者。
1.3 统计方法
本研究不同受精方式、培养不同天数、卵泡液、精液及培养液的胚胎污染情况,微生物的鉴定结果,无可用胚胎周期及养成囊胚周期情况均用率或构成比表示。胚胎移植后的临床妊娠、活产、不良妊娠结果用构成比表示。采用卡方检验或Fisher′s精确检验进行比较。使用SPSS 19.0 软件对数据进行统计分析。
2 结果
2.1 不同受精方式的胚胎污染率
在29 583 个IVF-ET 周期中,共有70 例胚胎污染,污染率为0.24%(70/29 583)。在4 905 个ICSI周期中未出现1 例污染,而IVF、h-ICSI、R-ICSI 污染率分别为0.28%、0.24%、0.49%。同时,在h-ICSI、R-ICSI 中出现污染的胚胎均是IVF 部分受精来源的胚胎,ICSI部分受精来源的胚胎均未污染。在IVF 周期中,每年都会出现胚胎污染,在2010 年污染发生率高达0.83%(表1)。
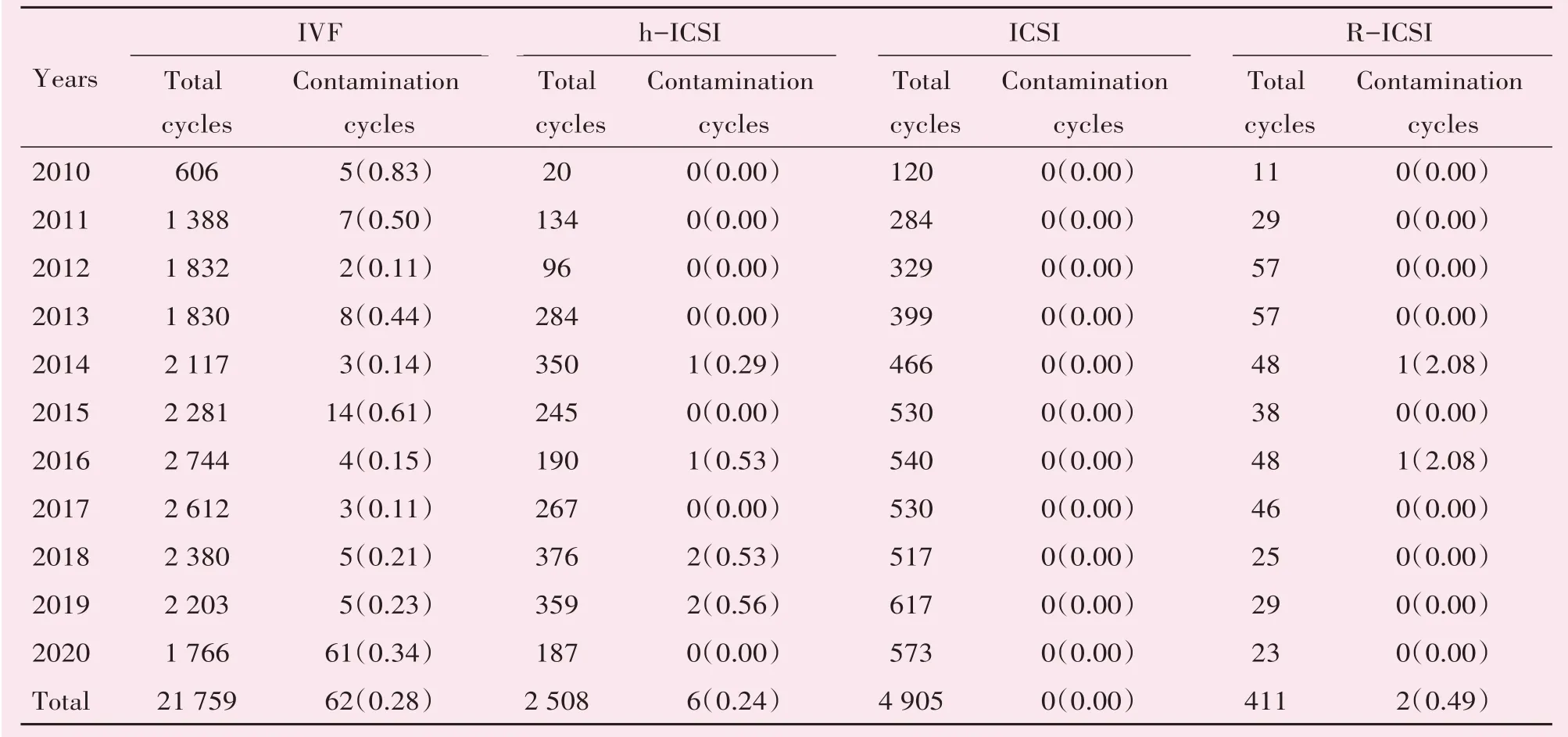
表1 不同受精方式胚胎污染情况比较Table 1 The incidence of microbial contamination during in vitro culture and the distribution number of different fer⁃tilization treatment cycles[n(%)]
2.2 不同培养天数下三种类型标本的污染率
70 例胚胎污染周期中(表2),送检周期58 例,送检标本总数159 例。在不同培养天数下,胚胎污染发现率最高的在D2(54.3%),其次为D1(32.9%),污染率最低的为D3(12.9%)。同时,D1及D2送检标本的污染率分别达到75.5%和75.6%,略高于D3 的70.8%。精液在D1、D2 的污染率显著高于卵泡液(D1:83.3%vs.37.5%,D2:84.6%vs.50.0%),D3 的污染率也高于卵泡液(62.5%vs.50.0%),但无统计学差异。
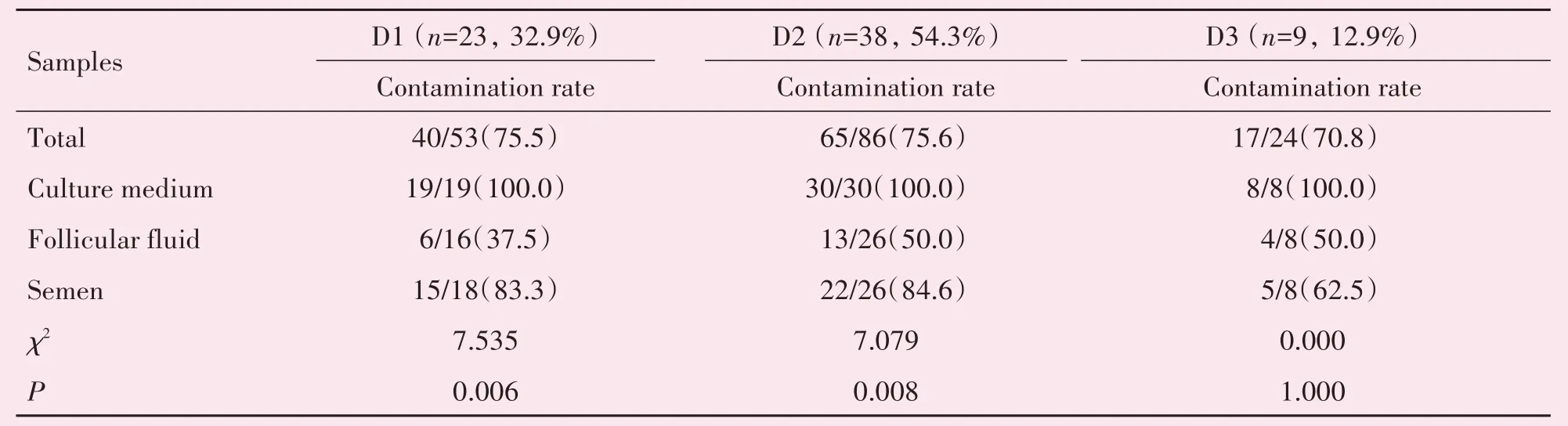
表2 不同培养天数下三种类型标本的污染情况比较Table 2 The number of samples examined and microbial contaminated on different culture days
卵泡液、精液、以及早期胚胎生长的各阶段,都有可能被微生物污染。图1A、B分别展示了污染发现当天,高倍镜下检查取卵日为患者留存的卵泡液和精液标本,可见卵泡液中大量退化的红细胞和精液中大量死亡的精子,并且两种标本中均可见密集分布的微生物,经鉴定卵泡液中微生物为克雷伯杆菌,精液中微生物为大肠杆菌;图1C、D分别展示了受精后第1 天的受精卵和第2 天的四细胞胚胎,受精卵周围可见大量长丝状细菌,四细胞胚胎周围可见大量密集均匀分布的微生物,经鉴定受精卵污染微生物为无乳链球菌,四细胞胚胎污染微生物为大肠杆菌+粪肠球菌。

图1 普通倒置显微镜下卵泡液、精液、受精卵、胚胎的污染情形Fig.1 Contamination of follicular fluid,semen,fertilized egg and embryo under general inverted microscope
2.3 送检标本的微生物鉴定结果
通过对送检的159 例标本进行微生物培养与鉴定(表3),结果显示共存在11 种类型的微生物,除1 例培养液为真菌(霉菌)污染外,其余均为细菌污染。卵泡液污染率最高的微生物为粪肠球菌(18.0%),精液和培养液污染率最高的均为大肠杆菌(59.6%,66.7%)。此外出现了5种类型的共同污染,污染例数最高的是大肠杆菌与粪肠球菌。
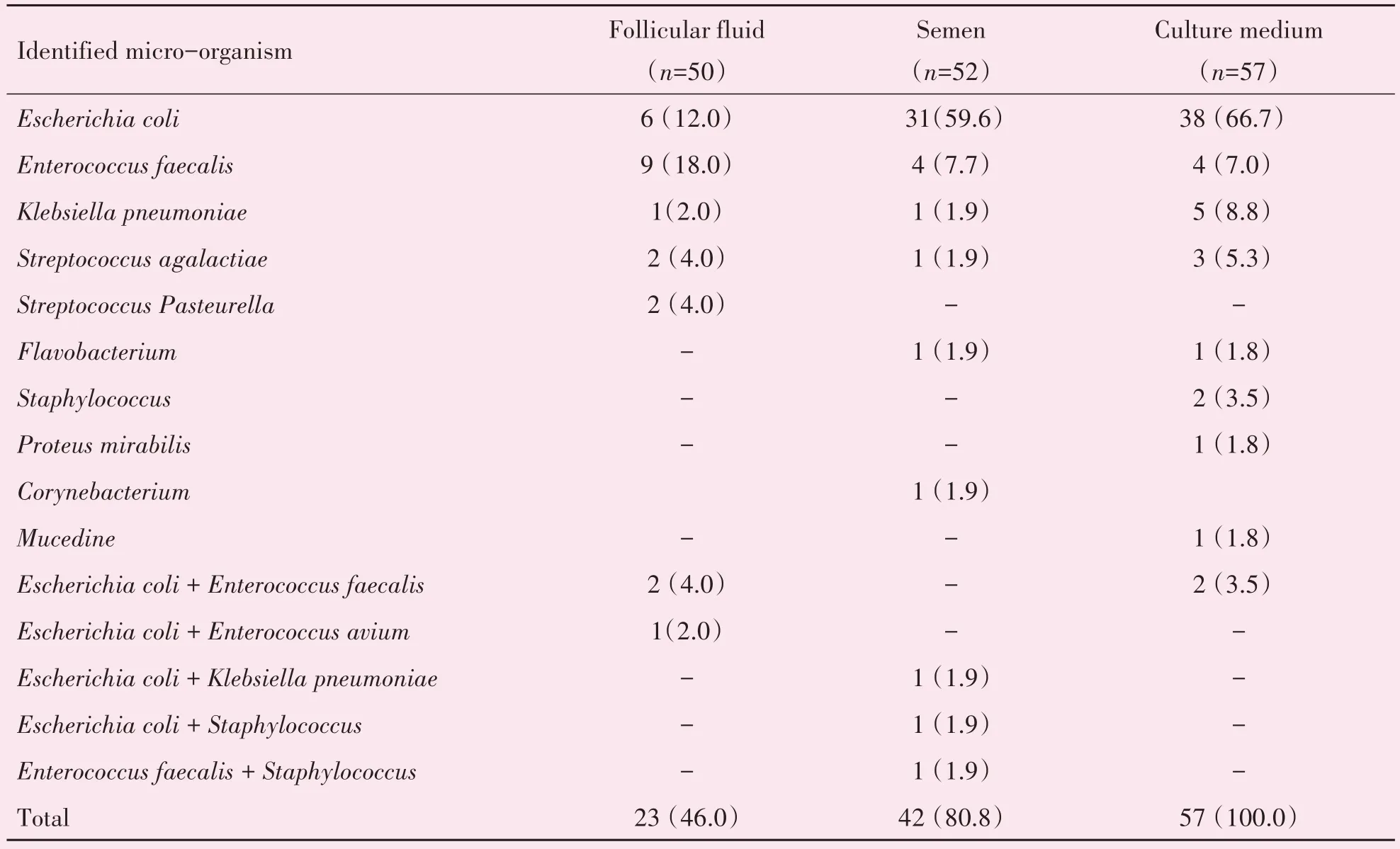
表3 三种类型标本的微生物鉴定结果分析Table 3 Incidence of identification of microbes in different contaminated samples[n(%)]
此外,在送检的58 例污染周期中,卵泡液、精液、培养液3 种标本均进行送检的周期为47 例,我们比较了这完整送检的47 例污染周期培养液微生物类型与卵泡液、精液微生物类型的一致性。结果发现,有5 例污染周期的培养液微生物类型与卵泡液或精液中微生物类型均不一致,病例1、病例2卵泡液和精液均污染了相同类型细菌,但培养液分别被奇异变形杆菌、葡萄球菌污染,病例4、病例5 卵泡液和精液均无菌生长,但培养液分别被无乳链球菌及霉菌污染(表4)。
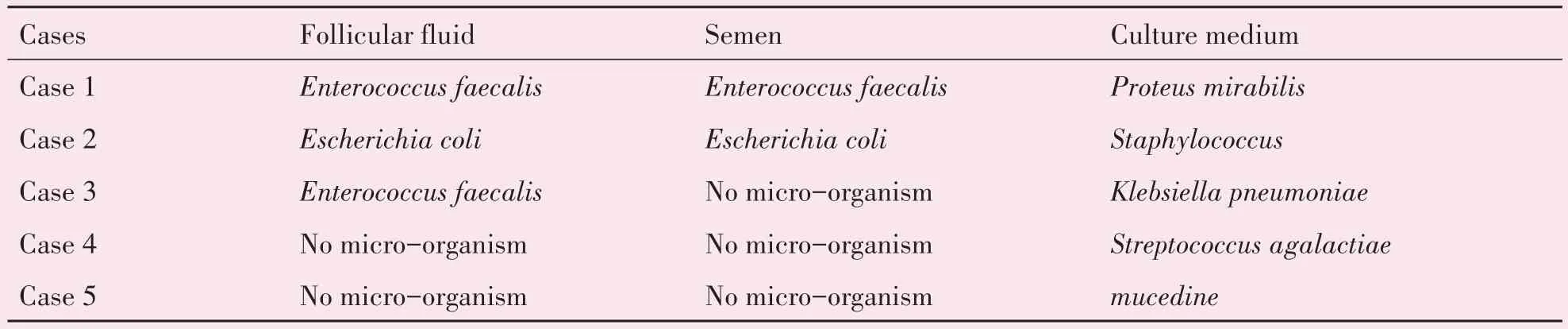
表4 5例污染周期胚胎培养液与卵泡液、精液的微生物类型鉴定结果差异Table 4 Results of difference of microbe types between culture medium and follicular fluid and semen in 5 contamination cycles
2.4 胚胎污染周期的实验室及临床结局
将70 例胚胎污染周期按污染情况分组,全污染组42 例,部分污染组28 例。全污染组有34 例最终无可用胚胎,其比率显著高于部分污染组的6 例(81.0%vs.21.4%)。全污染组7 例养囊胚周期仅2例形成囊胚(28.6%),而部分污染组12 例养囊胚周期有5 例养成(41.2%),但无显著性差异。比较新鲜移植周期与解冻移植周期的临床妊娠率、活产率及不良妊娠情况,全污染组分别有6 例新鲜移植和2例解冻移植,最终仅1例新鲜周期活产,部分污染组分别有16 例新鲜移植和13 例解冻移植,最终均有5 例临床妊娠和4 例活产。同时本研究共有4 例不良妊娠出现,且均来自部分污染组,新鲜周期与解冻周期均发生2 例不良妊娠,两组皆是1 例晚期自然流产,1例生化妊娠(表5)。
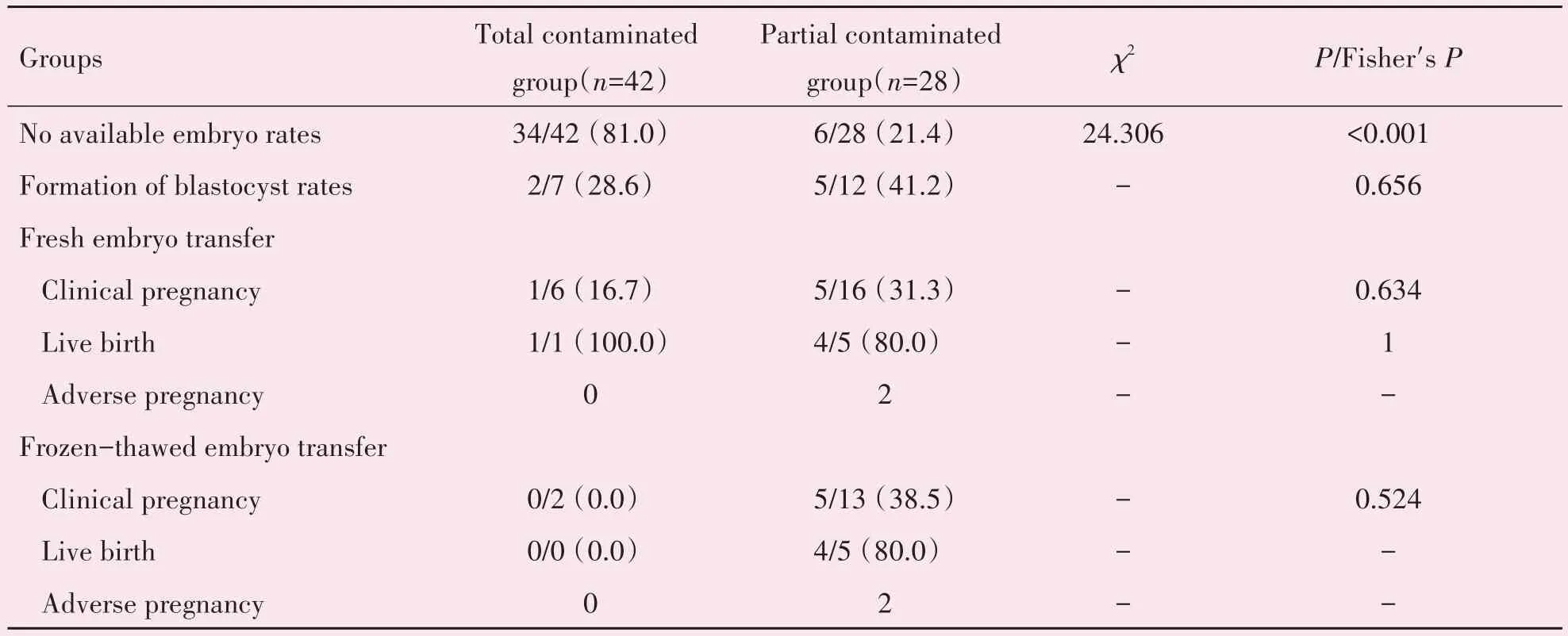
表5 全污染周期与部分污染周期的实验室及临床结局比较Table 5 The development and clinical outcomes of embryos in total contaminated cycles and partial contaminated cycles
3 讨论
本研究回顾性分析了基于10 年大数据基础的IVF-ET 胚胎污染情况,统计了各项实验室和临床指标。结果发现污染胚胎均发生在IVF 授精来源的胚胎,ICSI 胚胎并未污染,且胚胎污染最常在体外培养第2 天发现,精液带菌似乎是造成IVF 胚胎污染的主要原因,大肠杆菌和粪肠球菌是不可忽视的污染菌种,同时,当一个周期只有部分而非全部胚胎发生污染时,仍有相对较好的实验室培养和临床结局。
胚胎污染是IVF 胚胎培养过程中的小概率事件,目前报道较少。本研究统计的胚胎污染率0.24%,与国内外几项研究[4-7]所报道的胚胎污染率0.17%~0.86%较一致。IVF 周期中2010 年污染率高达0.83%,推测与胚胎实验室建立初期培养体系与环境的管理及监测经验有限有关。ICSI 周期胚胎未发生污染,h-ICSI 及R-ICSI 周期发生污染的胚胎均来源于IVF 受精部分,这与Kastrop 等[5]报道的一项较大样本量95 例污染的结果相一致。推测原因可能分为两方面:第一,ICSI 只需选择一条精子与卵子受精,而IVF 需要几百万条精子参与卵子受精,IVF 更易受到来自男方精液中微生物的可能污染;第二,ICSI 注射前需使用透明质酸酶去除卵子卵丘颗粒细胞,而已有文献报道透明质酸酶可有效去除体外培养的猪胚胎携带的微生物[8],同时在缓冲液中的反复吹洗动作可能有助于避免来自女方卵母细胞携带的微生物污染。
IVF 胚胎体外培养时多种原因均可造成胚胎污染。报道称女性或男性的泌尿生殖系统感染或疾病,手术穿刺取卵、手淫取精等不规范操作可能导致卵泡液或精液污染,IVF 培养体系和环境,如层流系统、仪器设备、器皿耗材、培养液及胚胎技术人员操作等也是潜在引入外源性微生物的来源[3,9]。我们发现在体外培养的第1~3 天,D2 污染发现率最高,其次是D1 和D3,推测可能与微生物的来源、生长模式及培养液中的抗生素半衰期有关。微生物在体外培养基中生长繁殖呈现迟缓期、对数期、稳定期和衰亡期的生长模式[10],D1 可能是细菌的迟缓期生长,无论内源或外源性的细菌来源,在D1由于微生物繁殖量的限制,部分菌种形态无法在观察胚胎生长时发觉;D2 可能是细菌从对数期到稳定期的生长,细菌繁殖量逐渐达到峰值,同时培养液抗生素含量及浓度的降低均不足以再抑制大量细菌繁殖,此时极易肉眼观察到培养液滴的浑浊,显微镜下也易观察到大量细菌生长;D3 污染推测可能与少部分菌种生长速度缓慢有关,或更可能是IVF培养过程中引入细菌的逐渐生长。
D1-D3精液的污染率均高于卵泡液,说明精液可能是导致胚胎污染的主要原因,这一结果与国内外几项统计结果均一致[5,11-12]。研究报道男性生殖道存在大量活跃的微生物,在对无生殖系统感染临床症状的男性精液进行微生物培养观察及PCR 鉴定后,其阳性率可达13%~97%[2,7,13],最近的一项研究[14]也表明,革兰氏阳性球菌在精液样本中的患病率很高,如葡萄球菌阳性率达80%,病毒链球菌阳性率达50%。精液污染的来源可能来自男性患有炎症或尿道细菌污染。精液由精子和精浆组成,精浆主要来源于前列腺、精囊腺、尿道球腺分泌的液体,任何一个腺体的感染都可能导致精液带菌。此外,射精时精液经过尿道,而男性尿道常有微生物寄居,如常见的生殖道支原体、需氧或厌氧菌,以及致病菌淋球菌、滴虫等。Willén 等[15]报道男性末端尿中的冠状沟菌株阳性率达71%,Cottell 等[16]报道男性精液以及前、中段尿液的细菌培养阳性率分别是51%、37%及27%,这些均提示尿道来源的精液污染。此外,取精时会阴皮肤中细菌也可能是诱发精液带菌的主要因素。而在IVF 实验室对带有微生物的精液进行洗涤之后,精液中的微生物可能依旧存在[17]。因此精液来源的细菌会导致IVF 周期有极大的污染风险。对ART 无症状感染的患者夫妇进行生殖道标本或卵泡液及精液标本微生物培养后,可得到上百种临床菌株,多以细菌为主,也存在真菌和支原体。Ricci 等[18]报道在855 份精液及阴道、宫颈拭子标本中共发现195 个菌株,粪肠球菌流行率最高,其次为链球菌和大肠杆菌。Kastrop[5]等报道在ART 周期中引起胚胎污染的主要微生物类型为大肠杆菌和念珠菌。本研究发现精液和卵泡液中的大肠杆菌及粪肠球菌是引起污染的主要因素,同时也有真菌的存在,细菌种类占比与样本量大小有一定关系。
此外,5 例污染周期的胚胎培养液微生物类型与卵泡液、精液的微生物类型均不一致。病例1、病例2 的卵泡液及精液均带菌,但未检出奇异变形杆菌和葡萄球菌,推测培养液不同类型的细菌来源可能分为两个方面。第一,患者的卵泡液或精液同时被两种细菌污染,如病例1 可能同时被粪肠球菌和奇异变形杆菌污染,但卵泡液、精液、培养液三者成分不同、酸碱度及渗透压不同、抗生素含量及类型不同、保存环境如温湿度、氧气及二氧化碳等气体环境等不同,因此为不同类型细菌生长繁殖所提供的条件存在差异,两种细菌同时存在同时繁殖,相互竞争营养,生长条件更适宜的细菌会迅速大量繁殖,而生长条件不利的另一菌种可能繁殖量极小或基本衰亡,普通的鉴定方法无法检测成功;第二,卵泡液或精液被一种细菌污染,但来自于卵泡液或精液的细菌在胚胎被转移进培养液前经过洗涤等操作已成功大量去除,或培养液提供的生长条件以及抗生素的存在等不适宜此种细菌的生长繁殖,从而导致其衰亡,而培养液中另一种细菌的出现可能与操作人员的无菌操作不严格、或培养箱微环境及培养室大环境不洁净、以及培养用的耗材、器皿等不洁净或受到污染有关。病例4、5 的卵泡液及精液均无菌生长,推测其培养液的污染亦来自操作人员、培养环境及耗材的污染等。此外,病例5 霉菌的污染更大可能是培养箱内不洁净,滋生霉菌导致的污染。
当污染发生时,全污染组的无可利用胚胎周期率达81.0%,养成囊胚周期率仅28.6%,说明微生物对早期胚胎的生长发育产生明显的抑制和损害作用。其机制可能是微生物会损害配子的超微结构,致使减数分裂过程异常和非整倍体率增加,损害受精过程并降低正常受精率[19-21],且微生物还会与胚胎竞争培养液供给的营养物质,胚胎得不到必须的生长因子。此外,细菌分解死亡时产生的内毒素会使受精率下降,胚胎碎片率及非整倍体率增加,胚胎退化及死亡率增加[22]。胚胎发生污染后临床结局不理想,全污染组仅1 例妊娠,这与Selman 等[23]研究报道的污染周期的胚胎植入率和临床妊娠率降低结果相一致。此外,本研究的部分污染组共有4 例不良妊娠出现,其中3 例移植的都是未污染过的胚胎,1 例移植胚胎D3 发现污染,经洗涤换液处理后D5 并未再次污染,而后冷冻后解冻移植。因此4 例不良妊娠因为胚胎携带细菌进入子宫并感染子宫从而引发流产的可能性不大,可能与胚胎本身染色体异常或微生物导致胚胎染色体异常,以及患者本身的母体因素和环境因素有关。研究表明,不孕妇女本身的生殖道感染或炎症会改变子宫局部的微生物体系,使氧化应激反应和活性氧释放增加,对胚胎的生存及发育不利[24-25],此外,子宫感染时其内膜的容受性会降低,将不利于胚胎在子宫的附植存活[5,26]。当胚胎污染发生时,及时有效的采取补救手段,能使一部分被污染的胚胎恢复正常,并获得较好的临床结局。本中心在胚胎污染发生时,立即对胚胎进行反复多次洗涤及更换培养液,添加一定量的抗生素抑制细菌生长,削薄或去除胚胎透明带后继续培养,女性在胚胎移植前进行抗生素治疗等手段,在部分污染组获得了相对较好的培养效果和临床结局。
ART周期中的胚胎污染难以杜绝,尽量避免污染事件的发生尤为重要。我们认为,针对精液的污染,重点要排查男性泌尿生殖系统感染,保证取精室的洁净程度,取精前加强男性手淫取精的卫生宣教,强调精液污染可能性,指导男性取精前必须严格洗手、清洗会阴、先排尿再手淫取精,强调精杯无菌使用的重要性,指导其勿接触精杯内壁,取精过程中如出现污染可能,在精液交接前需及时与医务人员沟通;针对卵泡液的污染,重点要术前做好清洁工作,注意术中的无菌操作,排查女性泌尿生殖系统感染;针对医务人员,重点要规范各项操作流程,加强无菌操作培训,做好人员质控;针对培养体系及环境,重点要落实各项质控制度,制定胚胎污染处理流程。胚胎污染发生时,要及时有效地做出补救措施,并追溯污染原因,做好当时的实验室及临床自查质控,以避免连续污染事件发生。
本研究具有一定局限性。首先,胚胎污染大多是微生物生长到一定量时才能够被发现,对于一些生长缓慢、繁殖量较小的微生物,甚至体积非常小的支原体、病毒导致的污染,普通倒置显微镜难以发现。其次,本研究纳入的污染样本量仍不够庞大,依然需要未来多年的数据积累。

