不同刺激模式诱致大鼠坐骨神经痛中星形胶质细胞作用机制的研究
于前进 洪磊 杨枭雄 林斌 李文锋 唐家广
坐骨神经痛是脊柱外科常见疾病,人群中发病率高达 40%,其中椎间盘来源的坐骨神经痛占 85%[1]。早在 80年前,Mixter 等[2]就报道了椎间盘突出和坐骨神经痛的关系。通过手术治疗可使许多患者的症状缓解,但仍有 3% 的患者术后出现并发症及慢性顽固性疼痛[3]。神经根受压程度与腰痛及下肢放射性疼痛程度也不完全一致,提示除了机械性压迫因素外,炎性刺激等非压迫因素在盘源性坐骨神经痛的产生中发挥了作用。
星型胶质细胞具有营养支持、调节突触传递、参与神经损伤修复、维护血管内皮细胞稳定及调节血流量[4]等作用。在神经病理性疼痛和炎性疼痛模型中星形胶质细胞均可被激活[5-6]。胶质纤维酸性蛋白 ( glial fibrillary acidic protein,GFAP ) 可在成熟的星形胶质细胞表达。星形胶质细胞激活后GFAP 表达明显增加,故可通过检测 GFAP 来判断星形胶质细胞的活化状态。
目前大鼠间盘刺破、神经根结扎等诱发坐骨神经痛的大鼠模型众多,但与突出的椎间盘对神经根的直接压迫和炎性物质刺激的病理生理过程仍有很大的差异。Hou 等[7]设计的大鼠模型很好地模拟了突出的椎间盘组织对神经根的机械性压迫和炎性物质刺激。不同刺激模式下的坐骨神经痛由不同的致病机制所致,推测在不同刺激模式诱致的坐骨神经疼痛模型中,星形胶质细胞活化也应会有所不同。本研究旨在探讨 Hou 设计的模型中大鼠机械刺激缩足阈值 ( paw withdrawal mechanical threshold,PWMT ) 变化、脊髓背角星形胶质细胞活化状况及两者相关性。
材料与方法
一、准备实验大鼠
选取健康完好的 90~100 日龄SD 雄性大鼠,体重 210~270 g,共 100 只。由解放军总医院第四医学中心骨科实验室实验动物中心提供并饲养。设置动物房和实验室温度在 22 ℃~26 ℃。灯照时间为每天8∶00~20∶00,行为学实验设定在 9∶00~17∶00间进行。实验过程严格遵循国际实验动物保健指导方针纲要的要求进行[8]。
二、实验模型建立
对大鼠称重并行药物腹腔注射 ( 3% 戊巴比妥钠,50 mg / kg ) 麻醉。先用 1-0 丝线在近端结扎鼠尾,再用尖刀在鼠尾近端 ( 距鼠尾起始 2 cm 处 ) 切断鼠尾,用 3-0 丝线间断缝合断端,按建模需要留取大鼠自体尾部纤维环、髓核等组织。选取后背正中切口,备皮消毒,以髂后上棘水平中点为中心,沿后背正中行 2 cm 纵向切口,钝性分离至棘突,沿左侧椎板分离并显露横突,确认并用咬骨钳咬除L4~5左侧关节突及左半部分椎板,显露并游离 L5神经根和背根节,用不同组织对 L5神经根造成压迫刺激 ( 具体见下文 )。生理盐水冲洗,丝线逐层缝合关闭切口。
三、实验分组及方法
用随机数字表法将大鼠分为椎间盘压迫 ( compression,CP ) 组、非压迫的炎性刺激组和空白对照( Sham ) 组。每组含 SD大鼠20只,其中8 只用于行为学实验,12 只用于取材行组织学实验。具体分组如下:( 1 ) CP 组:将大鼠自体尾部完整的椎间盘,放置于左侧 L5神经根背侧直接压迫神经根;( 2 ) 非压迫的炎性刺激组包括间盘移植 ( disc,DC ) 组:将大鼠自体尾部的椎间盘组织 ( 包括髓核和纤维环,各约 2 mg ) 无压迫放置于左侧 L5神经根近端旁侧;(3) 髓核移植 ( nucleus pulposus,NP ) 组:将取自大鼠自体尾部的髓核组织 ( 约4 mg ) 无压迫下放置于左侧 L5神经根近端旁侧;( 4 ) 纤维环移植 ( annulus fibrosus,AF ) 组:将大鼠自体尾部的纤维环组织( 约4 mg ) 取出,无压迫下放于左侧 L5神经根近端旁侧;( 5 ) Sham 组:手术仅切除半椎板并暴露 L5神经根,而不做自体组织压迫等处理。
四、PWMT 测定
在安静的观察室内,准备尺寸为 20 cm×20 cm×25 cm 的透明有机玻璃箱,放置于细格铁丝网覆盖的架子上,放入待测大鼠提前适应半小时。用刺激强度分别为 1 g、1.4 g、2 g、4 g、6 g、8 g、10 g、15 g、20 g、26 g、60 g、100 g、150 g、180 g、300 g 的尼龙丝 von-Frey 纤维穿过铁丝网格,对 SD大鼠的双侧后足底进行刺激。每个刺激强度重复进行 10 次,由小到大依次递增,两次刺激需间隔3~5 s。大鼠后足 PWMT 为诱发 5 次缩足反射以上的最小 von-Frey 纤维强度[7]。于手术前 1天测量 40 只 ( 5 组×8 只 ) SD 大鼠双侧后足 PWMT,作为基础痛阈值。后继续在设定时间点测定大鼠双侧后足底 PWMT。疼痛阈值变化用术后PWMT / 术前PWMT×100% 表示,< 100% 表明大鼠后足底刺激敏感性升高,反之则表明敏感性降低。
五、免疫组织化学染色
1. 大鼠脊髓取材及制片:分别于术前 1天、术后3天、7天、21天对各组内3只大鼠进行取材,共60只 ( 5组×4个时间点×3只 )。大鼠用戊巴比妥钠麻醉,心脏灌注后对脊髓腰膨大部分取材,4% 多聚甲醛 ( paraformaldehyde,PFA ) 固定,置于 15%、30% 蔗糖磷酸缓冲盐溶液 ( phosphate buffer saline,PBS ) 中,依次脱水沉底 ( 4 ℃ ),OTC( optimal cutting temperature compound ) 包埋剂包埋并置于 -20 ℃ 冰箱冰冻 2 h,再用冷冻切片机进行切片,切片厚度为 6 μm。放于 -70 ℃ 冰箱中低温保存备用。
2. 免疫组织化学染色方法:切片固定后浸入修复盒内柠檬酸 ( pH 6.0 ) 抗原修复液 ( 上海乔羽生物 ) 抗原修复后,阻断过氧化物酶,用牛血清白蛋白 ( bovine serum albumin,BSA ) 封闭。滴加 GFAP一抗 ( 1∶400,Abcam ),放于 4 ℃ 冰箱过夜。滴加辣根过氧化物酶 ( horseradish peroxidase,HRP ) 标记山羊二抗,室温孵育 60 min,用二氨基联苯胺( 3,3’-diaminobenzidine,DAB ) 显色后复染细胞核,脱水封片后光镜观察。
六、切片观察及数据测量
HE 染色及免疫组织化学染色后的切片用光学显微镜直接观察并拍摄照片。免疫组织化学取脊髓左侧背角染色 ( 黄色 ) 密集处的 4个随机 400 倍视野。照片用 Image Pro Plus 软件分析染色密集处随机区域 ( 面积为 5 cm×5 cm ),计算 GFAP 阳性细胞数和平均光密度值 ( optical density value,OD )。
七、统计学处理
采用 SPSS 19.0 软件进行统计学分析。计量资料采用±s表示。组内差异采用重复测量方差分析方法或 Friedman 检验;术后组间的差异采用重复测量方差分析方法或两因素方差分析方法进行统计学检验,术后某一时间点组间的差异采用 Mann-WhitneyU检验对比分析;数据相关性检验用 Pearson 相关分析,P< 0.05 为差异有统计学意义。
结 果
一、一般情况
有4只大鼠 ( DC组、AF组、NF组、Sham 组各1只 ) 在术后0.5~1.0 h 因麻醉过量死亡,并及时建立大鼠模型予以增补。余大鼠均于术后30 min 内苏醒,术后1~2 h 恢复运动。大鼠术后切口无感染发生,切口恢复愈合过程正常。体重及发育正常。
二、机械刺激疼痛阈值
1. 组内对照:实验组大鼠后足观察点术后PWMT% 均出现了降低,即机械刺激敏感性增高,较术前差异有统计学意义 (P< 0.001 ),提示 CP 组及炎性刺激 ( DC、NP、AF ) 组均对大鼠神经根造成了刺激,使大鼠足底痛阈降低。术后大鼠后足底PWMT% 逐渐降低,术后21天随访达到最低值,对侧足底 PWMT% 也出现类似变化 ( 图1 )。
2. 组间对照:为了区分机械压迫和炎症因素在痛觉过敏产生及发展中的不同作用,笔者进一步分析比较了 DC 组和 CP 组,差异有统计学意义 (P= 0.009 )。NP组、AF 组和 CP 组相比较时,差异同样有统计学意义 ( NP 组P= 0.011,AF 组P= 0.037 ) ( 图1 )。

图1 各观察点大鼠后足底 PWMT 降低程度及变化趋势。① 各组大鼠手术前后比较差异有统计学意义用星号 ( * ) 表示;② DC 组与 CP组比较差异有统计学意义,用 ( △ ) 表示;③ NP 组与 CP 组比较差异有统计学意义,用 ( ▲ ) 表示;④ AF 组与 CP 组比较差异有统计学意义,用 ( ★ ) 表示Fig.1 PWMT changes of rats. Significant differences pre- and post-surgery ( * ). Significant differences between DC and CP group ( △ ).Significant differences between NP and CP group ( ▲ ). Significant differences between AF and CP group ( ★ )
三、免疫组织化学染色
免疫组织化学染色浅,GFAP 阳性表达呈黄色或棕黄色,标记后阳性的星形胶质细胞似蜘蛛形或星形,由胞体发出许多长而光滑的突起,分支少。突触多分布于神经细胞间隙,细胞突起的末端常膨大,有些则附在邻近的毛细血管壁上 ( 图2~6 )。
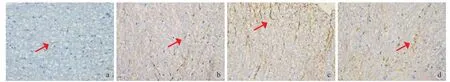
图2 CP 组,红色箭头所示为星形胶质细胞 ( GFAP × 400 ) a:术前 1天;b:术后3天;c:术后7天;d:术后21天Fig.2 GFAP-stained astrocytes of CP group ( red arrows ) ( × 400 ) a: 1 day before surgery; b:3days after surgery; c: 7 days after surgery;d: 21 days after surgery
1. 组内对照:实验组术后测定 GFAP 阳性细胞数及 OD 明显增大,较术前差异有统计学意义 ( 表1 ),提示多种神经根刺激模式均诱导了星形胶质细胞活化 (P< 0.05 )。术后21天随访内 GFAP 阳性细胞数、OD 均维持在较高的水平,其中术后7天细胞计数明显增多,OD 亦明显增大,组内比较差异有统计学意义 (P< 0.05 ) ( 表1,图7、8 )。
2. 组间对照:做模型组术后不同观察点 GFAP阳性细胞计数及光密度值的柱状图及趋势图,对各组中术后不同观察点 GFAP 阳性细胞计数及光密度值比较,均呈现出 DC组>NP组>AF组>CP组>Sham 组的变化趋势 ( 图7 )。对 4个实验组 GFAP 阳性细胞计数及 OD 做两两比较,差异均有统计学意义 (P< 0.05 )。

图3 DC 组,红色箭头所示为星形胶质细胞 ( GFAP × 400 ) a:术前 1天;b:术后3天;c:术后7天;d:术后21天Fig.3 GFAP-stained astrocytes of DC group ( red arrows ) ( × 400 ) a: 1 day before surgery; b:3days after surgery; c: 7 days after surgery;d: 21 days after surgery
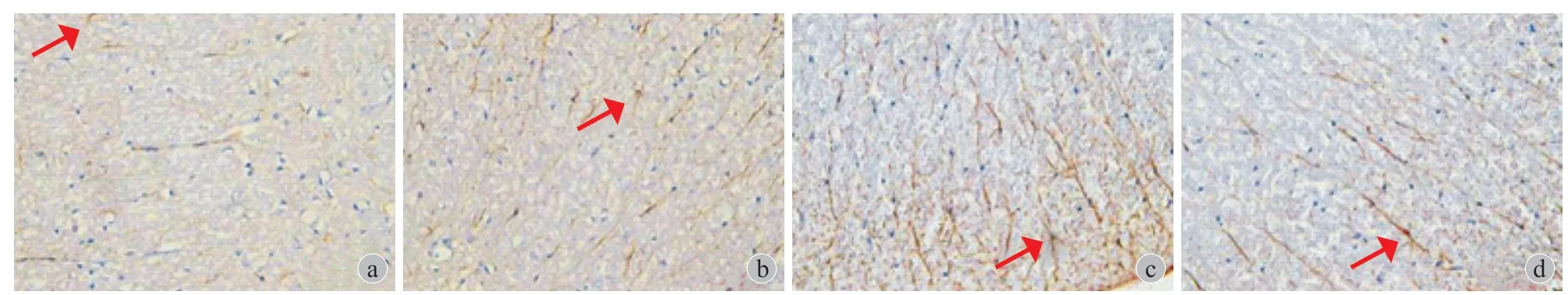
图4 NP 组,红色箭头所示为星形胶质细胞 ( GFAP × 400 ) a:术前 1天;b:术后3天;c:术后7天;d:术后21天Fig.4 GFAP-stained astrocytes of NP group ( red arrows ) ( × 400 ) a: 1 day before surgery; b:3days after surgery; c: 7 days after surgery;d: 21 days after surgery

图5 AF 组,红色箭头所示为星形胶质细胞 ( GFAP × 400 ) a:术前 1天;b:术后3天;c:术后7天;d:术后21天Fig.5 GFAP-stained astrocytes of AF group ( red arrows ) ( × 400 ) a: 1 day before surgery; b:3days after surgery; c: 7 days after surgery;d: 21 dayss after surgery
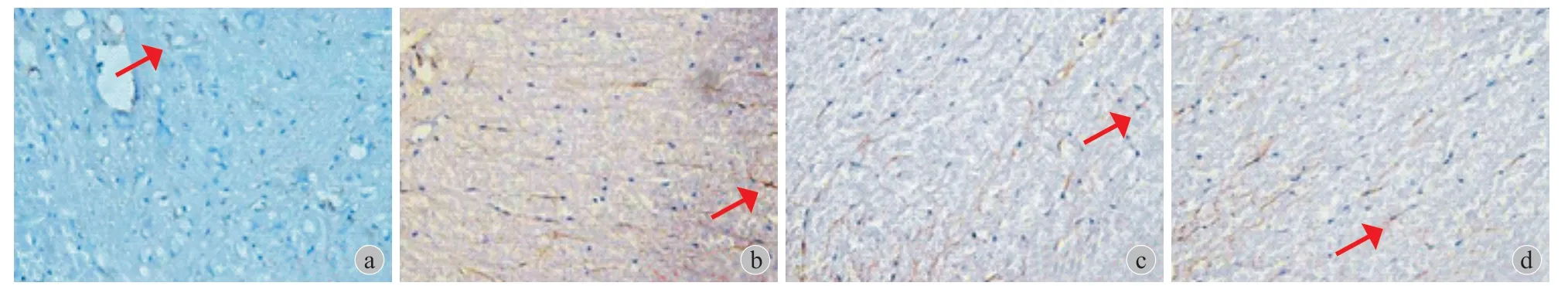
图6 Sham 组,红色箭头所示为星形胶质细胞 ( GFAP × 400 ) a:术前 1天;b:术后3天;c:术后7天;d:术后21天Fig.6 GFAP-stained astrocytes of sham group ( red arrows ) ( × 400 ) a: 1 day before surgery; b:3days after surgery; c: 7 days after surgery;d: 21 days after surgery

图7 不同组别中各观察点 GFAP 阳性细胞计数Fig.7 GFAP positive cell count at each observation point in different groups

图8 不同组别中各观察点平均光密度值 ( mOD )Fig.8 mOD at each observation point in different groups
表1 大鼠模型脊髓 GFAP 阳性细胞数 / 平均光密度值 (±s,n= 60 )Tab.1 Mean optical density values / the number of GFAP positive cells (± s, n= 60 )

表1 大鼠模型脊髓 GFAP 阳性细胞数 / 平均光密度值 (±s,n= 60 )Tab.1 Mean optical density values / the number of GFAP positive cells (± s, n= 60 )
注:① 手术前后比较差异有统计学意义用 a 表示;② 术后7天与其余时间点比较差异有统计学意义用 b 表示Notice: aStatistically significant differences before and after operation; bStatistically significant differences 7 days after operation and at other time points
项目 Sham 组 CP 组 DC 组 NP 组 AF 组术前 1天阳性细胞数 6.77±1.21 6.67±1.76 6.50±1.19 6.83±1.84 6.51±1.58平均光密度值 0.057±0.02 0.058±0.03 0.057±0.03 0.058±0.03 0.058±0.02术后3天阳性细胞数 6.78±2.07 9.13±2.26a 16.11±4.01a 13.82±2.83a 10.67±2.16a平均光密度值 0.057±0.01 0.12±0.01a 0.22±0.03a 0.19±0.02a 0.15±0.03a术后7天阳性细胞数 6.80±1.72 13.67±4.89ab 19.64±3.63ab 17.45±1.66ab 15.83±2.71ab平均光密度值 0.057±0.03 0.17±0.04ab 0.48±0.04ab 0.32±0.03ab 0.21±0.03ab术后21天阳性细胞数 6.77±1.41 11.57±3.42a 18.51±3.17a 15.68±1.27a 13.53±2.35a平均光密度值 0.057±0.01 0.10±0.02a 0.28±0.03a 0.17±0.02a 0.12±0.03a
四、PWMT 与星形胶质细胞活化状况相关性分析
对 4个实验组大鼠按观察时间顺次编号,分别做 PWMT和GFAP 阳性细胞计数、PWMT和GFAP阳性细胞 OD 的 Pearson 相关性分析。结果均呈负相关性,差异有统计学意义 (P< 0.001,相关系数为-0.918;P= 0.002,相关系数为 -0.701 )。
讨 论
椎间盘突出和坐骨神经痛的相关研究由来已久,神经根性疼痛的“压迫学说”现已得到认可。在研究椎间盘突出的动物实验中,大鼠坐骨神经痛模型众多,Chen 等[9]报道了大鼠坐骨神经结扎模型后大鼠后爪姿势异常,此外还有间盘刺破模型[10]、异 / 自体髓核移植模型[11]、腰神经根结扎模型[12]等,但与临床上突出的间盘对神经根的直接压迫和炎性物质刺激的病理生理过程仍有很大的差异。
Hou等[7]设计的大鼠模型将大鼠自体椎间盘成分区分后直接干预神经根造模,创新地模拟了人体突出椎间盘组织对神经根的机械性压迫和炎性物质刺激。本实验中,CP组为代表的单纯机械性压迫组成功诱发盘源性坐骨神经痛。与Hou 等[7]报道结果一致。这是因压迫致使神经根内产生缺血、水肿,局部血管通透性增加导致痛阈降低、神经根传导速度下降,以及病理生理改变所致持续重复或者自发性放电;神经纤维脱髓鞘后引起神经根损伤和产生疼痛[13-14]。外科手术解除压迫治疗有效也支持这一观点。
炎症介质也是导致盘源性坐骨神经痛的原因之一,实验中DC、NP和AF 组在仅有炎性刺激时同样引发持续的机械刺激疼痛过敏,显示炎性因素在盘源性坐骨神经痛的早期 ( 21天 ) 发挥了更为显著的作用。这与Kameda等[15]报道的结果一致。已知髓核等诱导的自身免疫反应在动物及人体神经痛觉过敏发病、发展中发挥一定作用,在纤维环裂隙及间盘疝出的髓核被免疫系统认为“异己成分”,诱发免疫反应,进一步召集巨噬细胞、淋巴细胞和其它炎症细胞聚集,并分泌肿瘤坏死因子 α ( tumor necrosis factor α,TNF-α )、前列腺素 E2 ( prostaglandin E2,PGE2 )、一氧化氮 ( nitric oxide,NO )、干扰素g ( interferon-g,IFN-g )、神经生长因子和 P 物质诱发产生疼痛[3,16]。激活淋巴细胞引发炎性反应的正反馈调节,并引起椎间盘和神经根的损伤。有研究表明大鼠突出的髓核组织能产生 TNF-α 等多种炎性介质,已经证实 TNF-α 与邻近神经根的激惹相关[17]。在这些炎性介质共同作用下可引起神经根损伤,可出现神经根水肿、电生理信号转导异常,导致疼痛过敏。同样纤维环碎片也可引起炎症反应,刺激内源性间盘细胞产生炎性介质,引发免疫反应[18]。Molinos 等[19]研究发现纤维环细胞和神经元样细胞相互作用,纤维环破裂后诱发新血管形成 / 神经内生长,以及纤维环和神经组织相互作用引发 TNF-α /IL-1β 参与的炎性反应,而 TNF-α 可直接参与痛觉过程。本实验的数据提示机械压迫和炎症反应在不同时间可能发挥不同作用,这可能涉及间盘内各种内因子在炎症反应过程的不同阶段扮演不同角色,起到不同作用[20-23]。同时两者不是孤立的单独作用,Omarker 等[14]指出机械性和炎症性刺激诱发的疼痛不是简单的相加关系,而是交叉相互作用。结果中出现了大鼠对侧后足 PWMT 降低,推测这可能是由于脊髓双侧背角间存在信号通路所导致[24]。而 Wang等[25]分析当外周神经损伤会产生中枢敏化,靠触摸能在非手术的对侧足底引起痛觉。
神经元细胞参与了疼痛调节观点由来已久。近年来研究表明,星形胶质细胞活化后释放的炎症细胞因子诱导炎性反应及免疫激活,在神经疼痛发生及维持中发挥着重要作用[26-27]。星形胶质细胞通过多种直接和间接的方式影响突触活动,通过应答中枢神经系统或产生各种细胞因子参与炎症反应调节,这些机制提供了星形胶质细胞参与神经疼痛信号转导的依据[28]。神经根组织损伤后可释放活性氧、NO、聚合或错误折叠的蛋白质和核因子等,进一步诱发星形胶质细胞激活。此外,星形胶质细胞可识别损伤组织特定的分子模式,通过类似传统的细胞免疫而激活。星形胶质细胞可识别 Toll 样受体 ( Toll-like receptors,TLRs ),引发类似免疫反应的过程,如促炎细胞因子的释放和细胞吞噬作用,这些过程进一步刺激 IL-1β、TNF-α和IL-6 经由星形胶质细胞释放,从而保持星形胶质细胞活化[29]。星形胶质细胞激活后,表达各种功能的神经递质受体,包括离子型 N-甲基-D-天冬氨酸 ( N-methyl-Daspartate,NMDA ) 受体和非天门冬氨酸 NMDA 受体、代谢性谷氨酸 ( mGluR3和mGluR5 ) 受体、嘌呤受体和 P 物质受体等。此外,IL-1β、TNF-α和IL-6可独立或联合参与脊髓背根神经节及背角中枢敏感化和疼痛扩大化,而 NMDA 受体通道开放导致的Ca2+内流可使 NO和PGE2 增加,并进一步产生疼痛[30]。本研究高度模拟了人体椎间盘突出的大鼠模型研究中,在不同刺激模式干预下,实验组大鼠术后GFAP 阳性细胞 OD、阳性细胞数均有不同程度的增加,反映星形胶质细胞活化增高,以髓核和纤维环共同刺激的 DC 组最为突出 ( 髓核组其次 ),该组模型也最接近人体常见的椎间盘突出方式。术后1周实验组 ( 尤其是DC组 ) GFAP 阳性细胞活化最为明显,符合急性腰椎间盘突出患者疼痛发展的特点。这与 Park 等[31]报道的术后2天 GFAP 基因表达上调,在2周时明显下降的结果类似。此外在不同的刺激模式下,实验组大鼠 GFAP 阳性细胞活化与后足底 PWMT 改变呈现出显著的负相关,进一步说明星形胶质细胞参与了疼痛的过程。随疼痛阈值的降低,星形胶质细胞活化增强。
综上所述,大鼠实验模型很好地模拟了人体椎间盘突出及诱发的疼痛,不同刺激模式诱致的坐骨神经疼痛模型均可诱发大鼠术后PWMT 降低。炎性因素较机械压迫在盘源性坐骨神经痛的早期 ( 21天 )发挥了更显著的作用。星形胶质细胞参与了疼痛的过程,在不同的刺激模式下,随疼痛阈值的降低,星形胶质细胞活化增强,呈负相关性。此外,动物实验研究显示炎性因素在盘源性坐骨神经痛的早期( 21天 ) 较机械压迫因素发挥了更为显著的作用,进一步提示早期非甾体、激素等抗炎治疗腰椎间盘突出的可行性,实验尚未能对炎症细胞因子作用机制做深入研究。未来的研究重点也会放在不同刺激模式诱致坐骨神经痛中星形胶质细胞和炎症细胞因子的具体作用机制上。

