非洲猪瘟血清学诊断靶点的研究进展
杨文兵,邹亚文,蒋一凡,余婉婷,杨 毅,邬 静*,王乃东*
(1.湖南农业大学动物医学院,长沙 410128;2.兽用蛋白质工程疫苗湖南省重点实验室,长沙 410128;3.兽用疫苗逆向创制湖南省工程研究中心,长沙 410128)
非洲猪瘟病毒(African swine fever virus,ASFV)是目前唯一已知的虫媒DNA病毒,该病毒外壳呈二十面体对称(260~300 nm),有囊膜,且拥有较大的基因组(170~194 kb)[1-2]。ASFV具有复杂的逃逸宿主免疫机制[3],可引起急性、热性、出血性和高致死性的传染病,即非洲猪瘟(ASF)[4]。1921年,首次报道了肯尼亚ASF疫情[5],此后该疫病蔓延,相继在葡萄牙、意大利、法国和俄罗斯等地出现[6-8]。2018年8月,中国沈阳确诊首例ASF,对该地ASFV进行系统进化分析发现,该病毒株属于p72基因Ⅱ型和CD2v血清群8,被命名为ASFV SY18株(亦称China 2018/1)[9-10],随后ASF在我国内陆所有省份出现,至今已给中国养猪业造成了巨大经济损失[11-12]。
消除ASF疫情需要长期战略。目前尚无商品化疫苗[13-14],所以积极、长期监测猪群中ASFV感染的相关情况,能为发现病例并采取及时的应对措施提供有效依据[15-16]。目前检测猪体内ASFV病原基因或其抗原(体)是判断猪群是否感染的重要手段,而血清学检测可用于猪群ASF监测筛查和辅助诊断[11]。猪感染 ASFV后,特别是亚急性感染,存活个体作为病毒携带者,可在感染后保持可检测的抗体水平,此时基于抗原检测抗体是了解发病特定区域内的猪群ASF发病情况所不可或缺的,因此监控ASFV特异性抗体在确定感染状态方面很重要[16]。而如果ASFV弱毒疫苗或不同组分亚单位疫苗在临床上实现应用,ASFV抗体检测方法作用亦尤为重要,比如野毒感染和疫苗免疫的鉴别诊断、疫苗效果评估等。
ASFV重要蛋白的保守性及其抗原性具有实验室诊断学意义。ASF血清学检测研究已经采用了p30、p54和p72等多个保守蛋白,其中p30蛋白含量丰富,为早期病毒蛋白(CP204L基因编码)[17],可在感染细胞后2~4 h内观察到,并在整个感染周期中持续表达,当检测到细胞表达p30蛋白时,表明病毒已经进入细胞和脱壳,并且早期病毒基因表达已经开始[18-19];p30蛋白是ASFV感染过程中引起体液免疫应答重要的抗原蛋白,针对p30的抗体可阻止病毒内吞,能够在病毒与细胞吸附之前或之后中和病毒,是重要的病毒早期诊断靶点[20-21]。p54也为早期病毒蛋白(E183L基因编码),蛋白分子中含有一段跨膜区域,对病毒蛋白经过内质网膜转化成病毒包膜前体起重要作用[22],而p54在Vero细胞的瞬时表达,可导致效应因子caspase-3的激活和细胞凋亡[18,23];用重组 p54 蛋白免疫猪可诱导产生中和抗体,针对p54的抗体可在病毒与细胞吸附之前中和病毒,p54蛋白抗原性良好,其抗体可在猪感染ASFV 8 d 后出现,并可持续数周,是高敏感性和特异性ELISA 等抗体检测方法的重要候选蛋白[20,24]。p72是在病毒感染后期表达的主要结构蛋白(B646L基因编码),是ASFV二十面体衣壳的主要成分,p72分子可形成稳定的三聚体,呈典型双“果冻卷”结构[25]。p72是ASFV高免疫原性蛋白之一,亦是ELISA等血清学诊断的重要靶点,p72抗体也可阻止ASFV吸附到巨噬细胞,但不能在抗体介导的免疫保护中起决定性作用[18,26];CD2v在病毒感染后期表达(EP402R基因编码),是CD2的同系物,可引起病毒毒力增强、红细胞吸附现象[27]。CD2v和C型凝集素蛋白介导ASFV的血凝抑制(hemagglutination inhibition,HAI)血清学特异性,CD2v和C型凝集素特征序列为ASFV血清型分组提供了一种简单方法[18,28]。先前研究认为CD2v免疫原性较弱[29-30],但近期研究发现CD2v蛋白或其多克隆抗体均表现出良好的免疫反应性[30-32],这提示CD2v蛋白可能是潜在的血清学诊断靶点。而ASFV CD2v(EP402R)基因的缺失苗对亲本(BA71)与异源毒株(Ⅰ、Ⅱ型毒株)均具有一定的保护作用[33-34]。
1 ASF血清学诊断靶点的应用
1.1 抗体检测方法
自ASFV发现以来,陆续有利用p72、p54和p30等候选蛋白研发不同形式的ASFV抗体血清学检测方法。目前已经有世界动物卫生组织(Office International Des Epizooties,OIE)介绍的INgezim PPA COMPAC ELISA[35]、俄罗斯商用试剂盒“VNIIVViM ASF-ELISA Ab/Ag”[36]、法国ID-VET间接ELISA试剂盒、瑞典SVANOVIR抗体ELISA试剂盒、西班牙INGENASA抗体ELISA试剂盒[37-38](表1)。而利用ASFV蛋白建立准确、灵敏和方便的ELISA应用于抗体检测仍是研究热点之一,其中p72或p30为包被抗原检测ASFV IgG抗体的ELISA可应用于血清或粪便抗体筛查,两种ELISA最早可在感染ASFV减毒株(Ken05)第9天 的粪便样本中检测到抗体,粪便抗体检测结果可比血清样本推迟达2.67 d[39];基于重组蛋白p30 的ASFV IgG抗体ELISA可用于血清或唾液样本中抗体检测,而且该p30间接ELISA可以在低毒力ASFV分离株(NHV/P68)感染的第8天时检出唾液中的ASFV抗体,计算26 dpi(day post inoculation)内的S/P值,将血清与口腔液结果进行比较,除12和18 dpi外,其余各天反应均无显著差异(P≤0.01)[40]。张蕾等[41]根据ASFV的p30、p54和p72蛋白设计3条合成肽,并建立了抗体ELISA检测方法,与西班牙INGENASA抗体ELISA试剂盒结果符合率达92.9%。
除了间接ELISA检测方法外,侧向流免疫色谱分析、量子点检测试纸条、免疫印迹和免疫磁珠法等也被陆续研发,并应用于ASFV抗体检测(表1)。其中,INgezimPPA CROM lateral flow device (INGENASA)以p72蛋白为捕获抗原,可检测血拭子样本中ASFV抗体[42];将量子点与免疫层析技术结合起来的ASFV抗体量子点检测试纸条使检测方法简便、稳定和灵敏,利用该试纸条可对320倍稀释的ASFV阳性血清进行检测[43];而以重组p30蛋白为捕获抗原建立的免疫印迹方法,可对ASFV强毒株(Stavropol 01/08、К-49)、弱毒株(КК-262/C)等不同毒力、不同血清型感染6~8 d后的血清和免疫系统器官样本进行有效的抗体检测[44]。以ASFV p72和p30等为捕获抗原的免疫磁珠法,在Benin病毒株感染猪8~15 d后采集的血清中,检测的ASFV抗体阳性率(68%)高于INgezim 11.PPA.K3 ELISA方法(58%)[45]。
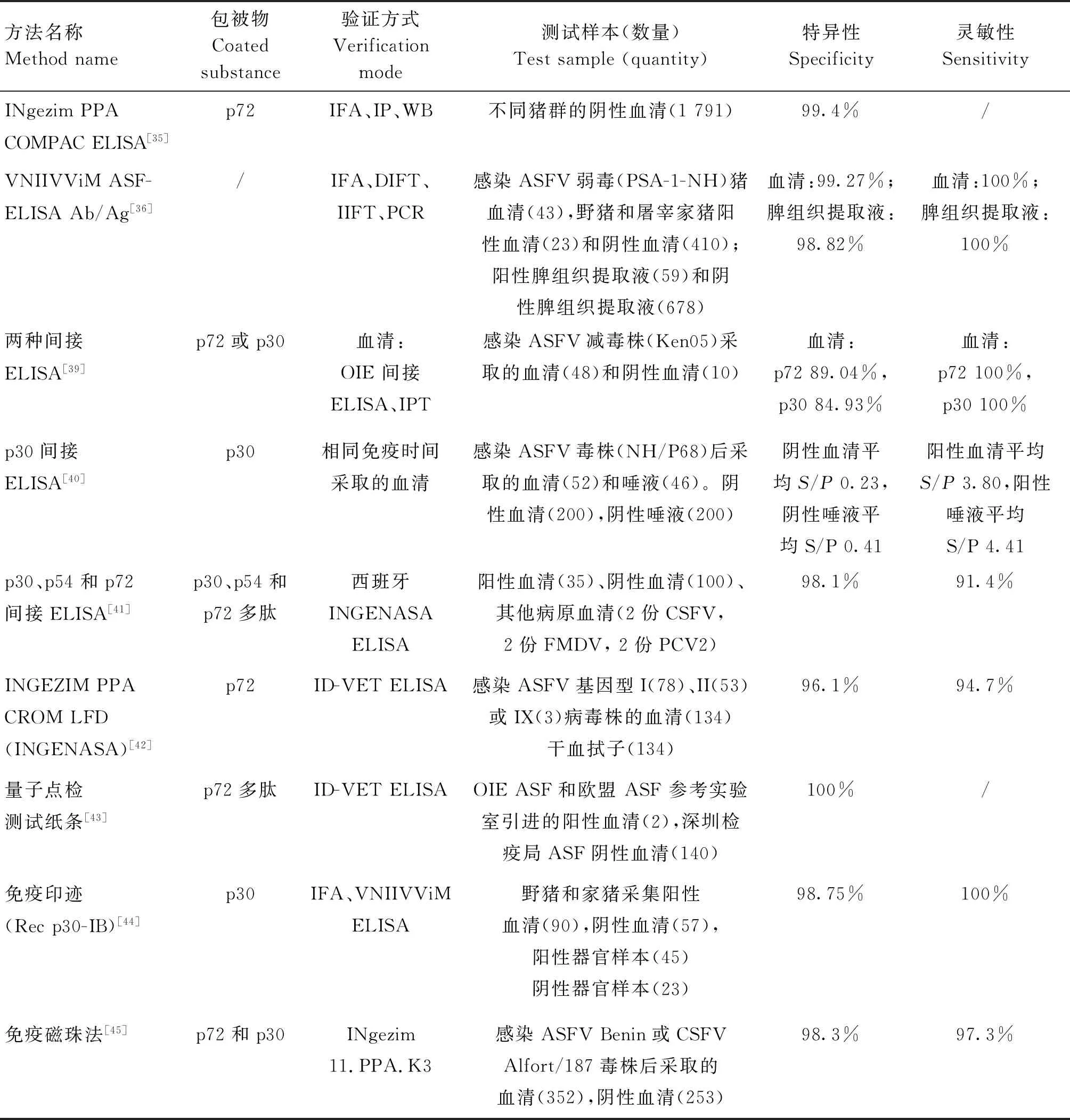
表1 ASFV血清学抗体检测技术Table 1 Serological antibody detection technology for ASFV
对接种ASFV/NH/P68病毒株后的猪血清进行荧光微球免疫试验(fluorescent microsphere immunoassay,FMIA),发现ASFV重组蛋白p30与免疫血清中lgG的反应性明显高于p72与p54[40];而Murgia等[46]构建了表达ASFV p30、p54和p72蛋白的α病毒复制子颗粒(replicon particles,RPs),并接种Vero细胞和试验猪,发现p30在Vero细胞中表达量最高,免疫原性最强,这些工作提示p30是建立间接ELISA的最佳候选蛋白之一。
目前,国内外获批商品化试剂盒未将CD2v蛋白作为诊断靶标。但钟秋萍等[31]利用ASFV SY18病毒株CD2v 胞外区(24~206 aa)与铁蛋白融合,大肠杆菌BL21表达系统表达并免疫 BALB/c 小鼠制备了多克隆抗体,经间接免疫荧光试验(indiect immunofluorescence assay,IFA)验证该抗体具有特异性。于浩洋等[32]利用真核表达系统表达了CD2v胞外区(1~206 aa)的蛋白,在间接ELISA的初步试验中发现,该蛋白片段对猪阳性血清具有良好的免疫反应性(98.9%特异性、100%敏感性)。周晓慧等[30]利用ASFV SY18病毒株CD2v胞内区(231—333 aa)进行表达研究,使用重组CD2v抗原进行ELISA试验,检测已知的30份猪ASFV阳性和阴性血清,结果均符合。这些结果表明,CD2v蛋白中存在抗原表位,其重组抗原有应用于抗体检测方法的潜力。
pp62蛋白虽作为法国ID-VET商业化试剂盒选用的诊断靶点,但将其应用于血清学诊断方法的研究报道不多。Gallardo等[47]在杆状病毒表达系统中表达了p30、p54和pp62蛋白,并初步应用于ELISA血清学诊断方法,结果表明,pp62的抗体检测特异性(99%)高于p30与p54(97%),而且pp62蛋白可对保存质量不佳(如热处理后)的猪血清进行ASFV抗体检测,提示pp62可能与ASFV抗体结合更加稳定,或与ASFV抗体亲和力高于其他蛋白[47]。
1.2 抗原检测方法
近期基于p72抗体的ASFV抗原检测方法陆续被研发、报道,包括夹心ELISA、侧向流免疫色谱分析(lateral flow assay,LFA)和胶体金免疫层析法等(表2)。其中,使用抗ASFV Uganda分离株p72的IgG抗体建立了夹心ELISA方法,但应用中发现抗原浓度较低的样品(慢性ASFV感染)可能会出现假阴性,其结果敏感度较低[48];以抗p72蛋白的单克隆抗体(18BG3)为捕获抗体建立了一种用于抗原检测的侧向流动分析法,其敏感性为RT-PCR的67.86%,超过50%的LFA检测为阴性的血清样本在RT-PCR结果中为阳性(CT值30),而这些血清样本来自感染ASFV 2周后的猪,说明该LFA检测方法敏感性较低[49];胶体金免疫层析法将胶体金与免疫层析技术结合,以p72蛋白制备的单抗为捕获抗体,可识别15 ng的抗原量(原核表达载体pET-30A表达的ASFV p72蛋白)[50]。Szeredi等[51]使用商品化小鼠单克隆抗体(1BC11),建立了免疫细胞化学(immunocytochemical,IC)和免疫组织化学(immunohistochemistry,IHC)方法,并用于检测ASFV p72蛋白,虽然不适用于大规模检测,但可作为急性ASF的实验室辅助诊断。
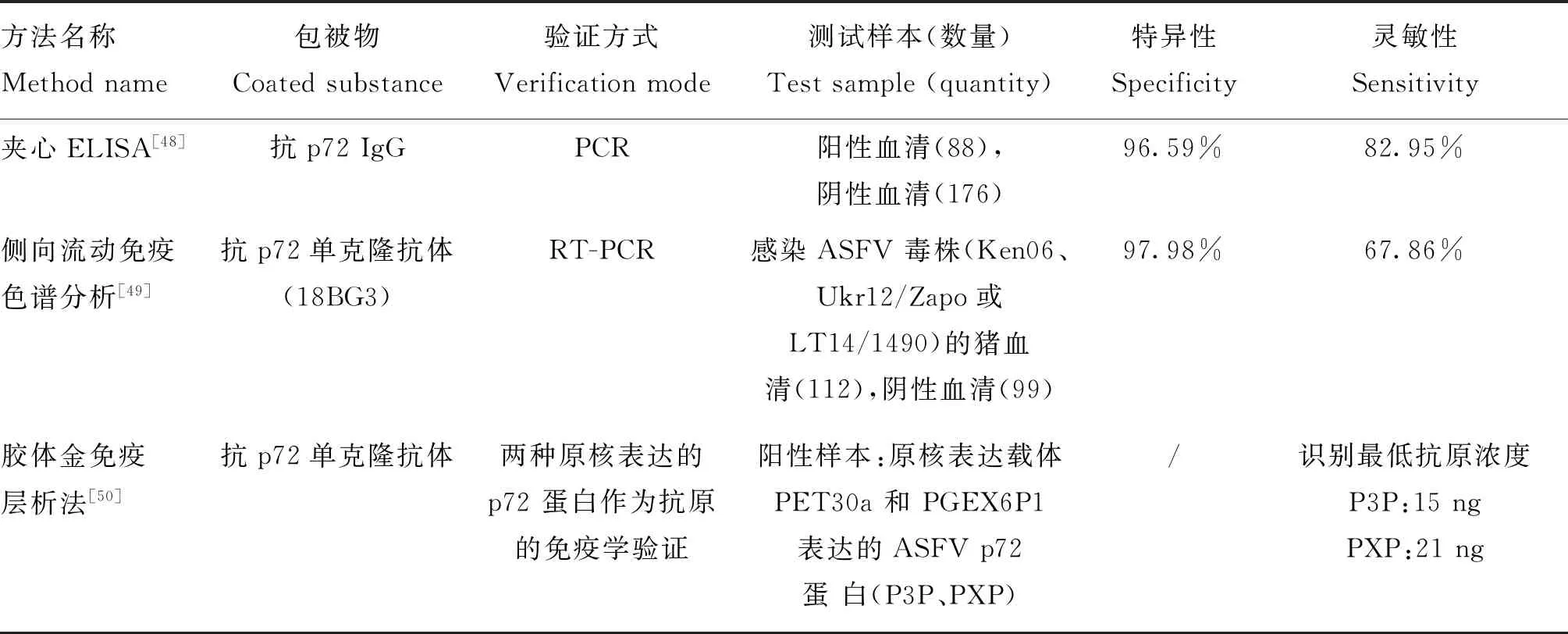
表2 ASFV血清学抗原检测技术Table 2 Serological antigen detection techniques for ASFV
2 ASF血清学诊断靶点的抗原表位
最近,陆续报道了利用单抗对ASF血清学诊断靶点p30、p54和p72的表位进行鉴定,获得了丰富的表位信息,对ASFV血清学诊断靶点的抗原表位进行解析,将为ASF血清学诊断和疫苗的研究提供新的靶点。
2.1 p30蛋白
用大肠杆菌表达系统(pHUE载体)表达了ASFV BA71V病毒株p30全长蛋白(204 aa),利用该蛋白制备、筛选获得3株阳性单克隆抗体(47-3、62-35和142-4),利用大肠杆菌表达系统(pHUE载体)以及哺乳动物细胞(pEGFP-C3载体)表达p30多肽,并对单抗识别p30蛋白区域进行鉴定,发现单抗识别p30片段的表位序列(mAb47-3识别61—93 aa;mAb62-35 和mAb142-4识别120—204 aa),其中mAb47-3单抗识别的表位在至少10种ASFV基因型中保守,提示该单抗至少可以检测10种基因型毒株[52]。
Wu等[53]使用Sf9昆虫细胞杆状病毒表达系统(pFastBac载体)表达了ASFV Georgia 2007/1病毒株p30基因片段(70—564 nt),利用该片段制备筛选获得14株阳性单克隆抗体。利用大肠杆菌表达系统(pHUE载体)表达ASFV BA71V病毒株p30多肽和购置的ASFV Georgia 2007/1病毒株的p30寡肽(GenScript公司),对单抗识别p30蛋白的区域进行鉴定,发现5个p30的单抗识别的表位序列(mAb8H2-6识别61—84 aa;mAb3E10-9识别84—90 aa;mAb63、mAb181和mAb192识别96—105 aa;mAb2B9-1、mAb4B6-1、mAb214、mAb330、mAb355和mAb428识别116—125 aa;mAb8G12-1、mAb81和mAb362识别146—160 aa),其中p30蛋白的116—125 aa与146—160 aa区域和抗体反应的阳性信号明显高于其他区域,且更具有免疫优势。通过对NCBI基因库中86个p30蛋白序列进行比较,发现116—125 aa与146—160 aa区域高度保守。Murgia等[46]也同样发现了p30的C-末端(111—130 aa)为免疫优势区域,Vlad等[54]使用GeneSilico MetaDisorder server预测BA71V病毒株p30蛋白,发现固有无序(intrinsically disordered proteins,IDP)的区域(91—143 aa),表明它可能是不稳定的,但IDP在ASFV p30蛋白功能中的意义仍需要进一步揭示[52-54]。
2.2 p54蛋白
使用Sf9和Hi-Five昆虫细胞杆状病毒系统(pFastBac载体)表达ASFV Georgia 2007/1病毒株p54蛋白片段(60—178 aa),利用该片段制备和筛选出5株单克隆抗体(154-1、143-1、7、117和101),之后用单克隆抗体对大肠杆菌表达系统(pHUE载体)表达ASFV BA71V病毒株p54多肽和购置的ASFV Georgia 2007/1病毒株p54寡肽(21stCentury Biochemicals公司)对单抗的识别表位区域进行鉴定,发现4个p54的单抗识别的表位序列(mAb154-1识别65—75 aa;mAb143-1识别93—107 aa;mAb7识别97—113 aa;mAb117和mAb101识别118—127 aa)[46-47]。用BA71V病毒株p54多肽和寡肽分别与一批感染ASFV OURT 88/3弱毒株第17 天的猪血清进行抗体结合鉴定,发现113—127 aa区域可与62.5%的ASFV感染猪血清抗体反应,且明显高于其他表位区域,但遗憾的是,通过对26株不同ASFV病毒株的p54蛋白序列对比发现p54(117—126 aa)区域具有高度的差异性[55]。
2.3 p72蛋白
Heimerman等[56]使用Sf9和Hi-Five昆虫细胞杆状病毒系统(pFastBac载体)表达了ASFV Georgia 2007/1病毒株p72蛋白片段(20—303 aa),利用该片段制备并筛选获得6株阳性单抗(23、4A4、85、65-3、6H9-1和8F7-3)。随后利用大肠杆菌表达系统(pHUE载体)表达ASFV BA71V病毒株p72重叠多肽与寡肽对上述单抗识别区域进行鉴定,发现4个单抗分别结合p72的不同抗原表位(mAb 85识别156—165 aa;mAbs 65-3 和 6H9-识别265—280 aa;mAbs 8F7-3 和 23识别 280—294 aa;mAb 4A4识别290—303 aa)。其中,mAb85、mAb8F7-3和mAb23识别的p72基因中的表位在10种基因型的ASFV毒株中相对保守,这些抗体有助于开发抗原捕获或阻断ELISA。但部分ASFV毒株的p72基因不保守,特别是在C末端,所以选择p72抗原区域或表位研发血清学诊断方法时需谨慎考虑C末端的使用[53,57]。
3 展 望
ASFV含有151~167个开放阅读框,可编码160多种结构蛋白和非结构蛋白[55,58-60],ASFV编码蛋白具有复杂性,为ASF感染血清学诊断的新方法研制带来了挑战,也带来了机会。基于目前的ASFV抗体检测方法进展发现,近年来用于ASFV抗体检测的ELISA大多以p30与p72蛋白为基础。p30与p72 联合应用于免疫磁珠法可提高检测技术敏感性[45],使用p30、pp62和p72为包被抗原的法国ID-VET试剂盒也已商品化[37,61],提示多种蛋白的联合应用可提高检测方法性能,这为开发检测ASFV抗体和抗原的新方法提供了机会。
病毒蛋白表位及其特性鉴定不仅有助于更好地了解病毒的病理学和宿主免疫反应,而且基于保守表位的血清学检测方法有望提供更广泛的诊断范围。近年来,基于多抗原表位的血清学诊断方法已应用于检测登革热病毒、丙型肝炎病毒和甲型肝炎病毒等的抗体,并且方法具有高敏感性和特异性[62-64]。如甲型肝炎病毒(hepatitis A virus,HAV)感染可刺激机体产生针对病毒结构蛋白和非结构蛋白的抗体。然而,接种灭活或减毒的HAV疫苗只产生针对结构蛋白的抗体,而不会产生或产生非常少的针对非结构蛋白的抗体。Su等[64]构建了以HAV非结构蛋白多表位诊断抗原为基础的双抗原夹心ELISA(double-antigen sandwich ELISA)来区分这种情况,诊断准确性和实用性均较好(灵敏度93.75%,特异性93.75%)。重组蛋白或表位多肽在血清学诊断方面可能比天然抗原更具有优势[65-66]。多表位重组蛋白由免疫优势表位区域组成,没有非特异性部分,这可能提高检测方法的质量[66-68]。而基于近期陆续获得的ASFV候选蛋白的单抗和已定义的p30和p54等保守抗原表位或区域,借助生物信息学分析技术,筛选设计表位或多表位组合,有望为改进ASFV检测、监测和疾病控制提供有价值的新靶点或新组合,并推动ASF血清学诊断的潜在应用。而深入了解ASFV保护性抗原、相关表位及其在自然界中的多样性,也将有助于ASFV亚单位疫苗的设计和开发。

